La aprobación de algunas inmunoterapias para la EM en Suiza difiere en parte considerablemente de las de los países vecinos. Por ello, un grupo de neurólogos, con la participación de la Sociedad Suiza de EM y la SNS, ha elaborado recomendaciones en el sentido de un consenso terapéutico.
Según la Sociedad Internacional de Esclerosis Múltiple, la esclerosis múltiple afecta a unos 10.000 pacientes en Suiza [1], aunque cabe suponer, de forma análoga a los datos de otros países, que también hay un mayor número de personas afectadas en Suiza [2]. La incidencia de la enfermedad está aumentando [3]. Como enfermedad desmielinizante inflamatoria crónica del SNC, la mayoría de las EM son recidivantes [4]. Sin embargo, debido a las nuevas opciones terapéuticas, el 10-15% de las EM primarias progresivas (EMPP) se han convertido recientemente en el centro de interés. Hasta la fecha, no se conoce ninguna terapia con un enfoque curativo. Sin embargo, el panorama de las terapias modificadoras del curso se ha ampliado considerablemente en los últimos años, de modo que en la actualidad existen alrededor de una docena de terapias modificadoras del curso disponibles para reducir la tasa de recaídas o la progresión de la discapacidad, entre otras cosas, y cuya actividad puede detectarse mediante resonancia magnética. Debido a los diferentes mecanismos de acción, modos de aplicación y perfiles beneficio-riesgo, cada vez es más posible una terapia individualizada. De este modo, es posible reaccionar de forma específica a las situaciones vitales actuales y a los objetivos deseados, como la capacidad de caminar, los aspectos profesionales o el embarazo [5].
Esta creciente complejidad requiere directrices en las que se discutan las indicaciones, los beneficios potenciales, así como los aspectos de seguridad y los perfiles de efectos secundarios. La mayoría de estas directrices son válidas en general. Esto incluye, por ejemplo, la recomendación de iniciar la inmunoterapia lo antes posible tras el diagnóstico [5].
Sin embargo, varios aspectos, como las diferentes evaluaciones beneficio-riesgo, los distintos procedimientos de aprobación o las diferentes priorizaciones políticas, legales y específicas de cada país, conducen a menudo a aprobaciones divergentes de terapias individuales en algunos países vecinos [6].
Por ejemplo, en ocasiones existen diferencias significativas en cuanto a la aprobación (por ejemplo, terapia de primera línea frente a terapia de segunda línea, grupos de pacientes) y los requisitos de seguridad de las inmunoterapias para la EM en Suiza en comparación con el área europea (Agencia Europea del Medicamento, EMA).
Además, en Suiza, se requiere una evaluación de costes y beneficios por parte de la Oficina Federal de Salud Pública (OFSP) para la inclusión de un medicamento en la lista de especialidades (LS), institucionalmente separada de la autorización de comercialización. La LS enumera los preparados que son reembolsados por el seguro de enfermedad obligatorio y las posibles limitaciones.
En comparación con los países vecinos, estas condiciones especiales dan lugar a diferencias significativas en el uso de ciertos preparados. Los enfoques específicos en Suiza se basan en estas diferentes aprobaciones y limitaciones, por lo que son necesarias las correspondientes consideraciones específicas de cada país.
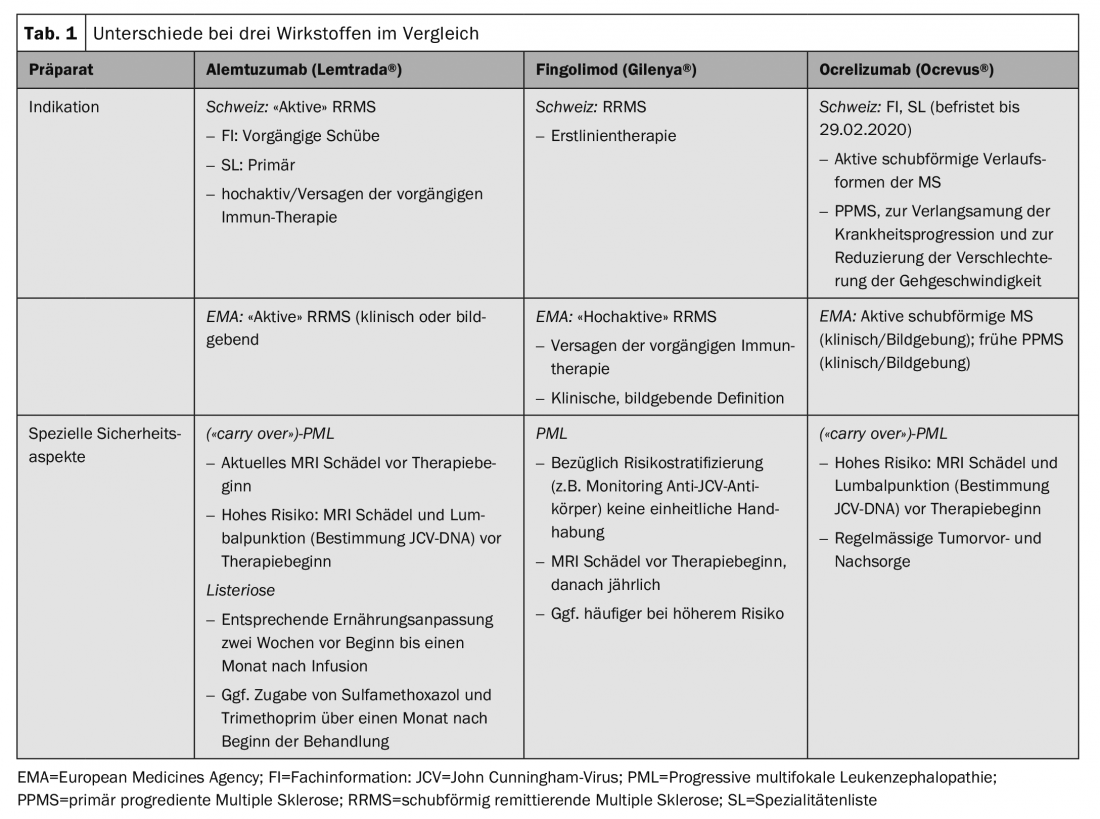
Estos aspectos específicos en Suiza, junto con recomendaciones prácticas para la acción, fueron resumidos por un grupo de neurólogos especializados en la terapia de la EM y coordinados en el sentido de un consenso con el consejo asesor científico de la Sociedad Suiza de Esclerosis Múltiple y la Sociedad Neurológica Suiza (SNS) [7]. Existen diferencias prácticas en particular para las sustancias alemtuzumab (Lemtrada®), fingolimod (Gilenya®) y ocrelizumab (Ocrevus®), así como para el trasplante autólogo de células madre hematopoyéticas (aHSCT) (Tab. 1).
Indicación
El uso de algunos preparados requiere un cierto grado de actividad de la enfermedad, por lo que el término “EM activa” o incluso “muy activa” no suele estar claramente definido y se interpreta de forma diferente en los textos de autorización de comercialización. Así pues, la evaluación del médico que le atiende desempeña un papel decisivo, que a su vez tiene implicaciones con respecto a una posible solicitud de garantía de costes.
Según el SmPC suizo, el alemtuzumab puede utilizarse en la EM activa remitente-recurrente (EMRR). Esto se define clínicamente en términos de al menos dos recaídas en los dos años anteriores al inicio de la terapia (con al menos una recaída en el año inmediatamente anterior). La LS restringe aún más la indicación y exige un fracaso de la terapia previa o, en ausencia de terapia previa, EM “primaria muy activa”, de nuevo sin una definición clara de los términos. Según la LS, se requiere una aprobación de costes para los pacientes no tratados con una forma de progresión muy activa, que -debido a la falta de una definición- requiere una evaluación de la situación individual, que queda así a discreción del médico tratante. Especialmente para este grupo de pacientes, para los que el inicio a tiempo de una terapia eficaz es de especial relevancia, nos parece importante hacer hincapié en que los aspectos formales no deben provocar un retraso significativo.
Las limitaciones del IF y el LS se corresponden en parte con los criterios de inclusión de los estudios relevantes para su aprobación [8,9]. Sin embargo, se correlaciona con la práctica clínica actual que la preterapia no se limita al acetato de glatiramero o al interferón-β – como fue el caso en el ensayo pivotal – sino que también debería aplicarse a las otras inmunoterapias aprobadas.
En contraste con esta indicación relativamente estricta en Suiza, existe una autorización más general en la zona EMA, por la que pueden utilizarse tanto los hallazgos clínicos como los de imagen para confirmar la actividad de la enfermedad. Esto, a su vez, impone mayores exigencias a la evaluación beneficio-riesgo individual del médico prescriptor.
También existe una mayor diferencia en términos de aprobación para el fingolimod. Está aprobado como tratamiento de primera línea en Suiza, pero sólo como tratamiento de segunda línea en la región de la EMA. Esto puede explicarse posiblemente por una interpretación diferente de la relación beneficio-riesgo o, sobre todo, por una interpretación diferente de la población de estudio de los estudios de homologación. En los ensayos FREEDOMS, el 57% de los pacientes no habían recibido tratamiento, en el ensayo TRANSFORMS el 44% [10,11]. También se encuentran aspectos divergentes con esta preparación en términos de seguridad. En Suiza, sólo se prescribe una interrupción de la terapia cuando el valor de linfocitos es inferior a 100/μl, mientras que el límite en la zona EMA es de 200/μl.
A diferencia de la autorización europea, que se basa en la población de estudio de los estudios de registro, la indicación del ocrelizumab en Suiza está formulada de forma mucho más general tanto por Swissmedic como en la LS. Se requiere una forma de progresión activa y recidivante, pero esto no se explica ni se restringe más. Para el tratamiento de la EM primaria progresiva (EMPP), la terapia se incluyó en el SL sin restricciones, lo cual es comprensible debido a la falta de alternativas inmunoterapéuticas. En este caso, el objetivo de la terapia con Ocrevus® es ralentizar la progresión de la enfermedad, por lo que no sólo debe referirse a la capacidad de caminar, sino también a la preservación de otras funciones residuales relevantes, como la función del brazo/mano o la motricidad fina, en el sentido de una evaluación beneficio-riesgo individual. En esta situación en particular, es esencial una evaluación detallada y, si es posible, cuantificada de la progresión de la enfermedad antes y durante la terapia (“Escala ampliada del estado de discapacidad”, EDSS; “Compuesto funcional de la esclerosis múltiple”, MSFC).
Especialmente los pacientes más jóvenes con un curso más corto de la enfermedad y una actividad de la enfermedad detectable por imagen (lesiones que absorben el contraste) parecen beneficiarse de la terapia. Sin embargo, a la inversa, no es automáticamente cierto que los pacientes sin actividad de la enfermedad en las imágenes no sean aptos para la terapia.
También existen diferentes enfoques para el trasplante autólogo de células madre hematopoyéticas (aHSCT), que ha sido aprobado en algunos casos en la región EMA o puede utilizarse según la opinión de los expertos y fue aprobado en Suiza por el FOPH el 01.07.2018 para su reembolso por el OKP bajo estrictas condiciones. Los pacientes tratados, por ejemplo, deben anotarse en un registro. Debido a las amplias alternativas terapéuticas para las formas recidivantes de la enfermedad, a los efectos secundarios potencialmente graves de este tratamiento invasivo y a la falta de estudios controlados y aleatorizados, la terapia sigue siendo controvertida. En la actualidad, se recomienda utilizarlos sólo en casos cuidadosamente seleccionados y en centros académicos altamente especializados. Entre los criterios para los que podría debatirse una terapia correspondiente se incluyen el grado de discapacidad más bajo posible a moderado (hasta EDSS 6,5), una edad más joven del paciente (<50 años), una duración más corta de la enfermedad (<10 años) y el fracaso de una inmunoterapia previa altamente activa.
Aspectos especiales de seguridad
Los aspectos generales de seguridad, como los controles de laboratorio, no son objeto de este artículo ni de la recomendación consensuada y pueden consultarse en la información técnica correspondiente.
En principio, las terapias deben ser llevadas a cabo por neurólogos con experiencia en EM en centros que garanticen un seguimiento y una evaluación seguros de los pacientes y que puedan detectar y tratar los efectos secundarios en una fase temprana.
En este contexto, cabe mencionar también los exámenes de imagen y los controles de progreso. Las imágenes tomográficas por RM son cada vez más importantes no sólo en el campo del diagnóstico, sino también en el contexto de las investigaciones de seguridad. Por este motivo, independientemente de la inmunoterapia establecida, el seguimiento debe utilizar protocolos estandarizados y ser evaluado por neurorradiólogos con la experiencia adecuada [12].
Se han descrito casos de leucoencefalopatía multifocal progresiva (LMP), una infección vírica oportunista del SNC, con varios agentes inmunoterapéuticos. Así, de las sustancias aquí comentadas, se han descrito varios casos con fingolimod, correspondientes a un riesgo general de 1/15.000 pacientes, así como varios casos de “arrastre” con ocrelizumab y alemtuzumab tras una terapia previa con natalizumab o fingolimod [13].
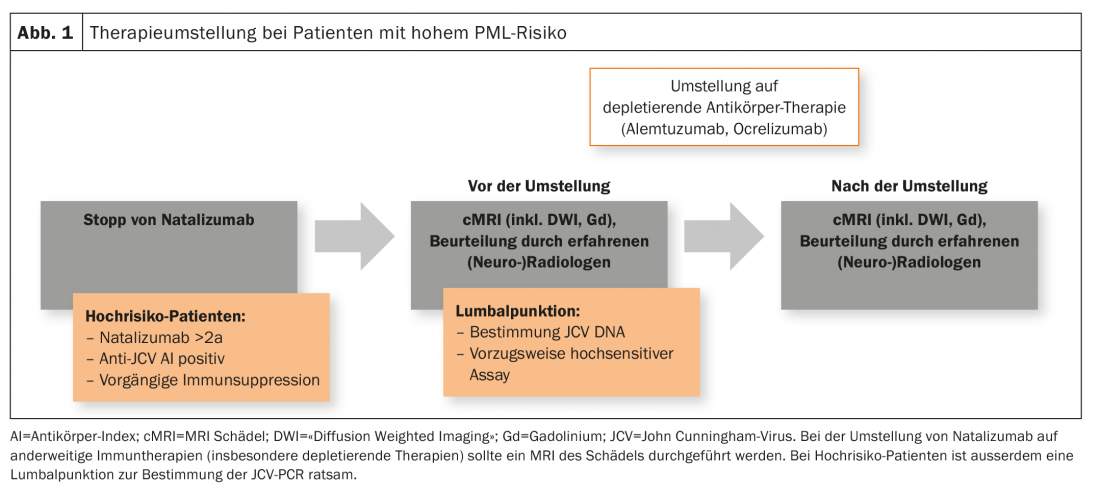
Los pacientes de alto riesgo (duración de la terapia con natalizumab ≥2 años, anticuerpo anti-JCV positivo, inmunosupresión previa) deben recibir una RM craneal actualizada como parte de un cambio de terapia. Además, también es aconsejable realizar una punción lumbar con determinación del ADN del VJC (preferiblemente en un ensayo de alta sensibilidad). Esto se aplica en particular al cambio de terapia de natalizumab a terapias depletoras como alemtuzumab u ocrelizumab, pero también se lleva a cabo en ciertos centros cuando se cambia de fingolimod o a fingolimod (Fig. 1). Sin embargo, en Suiza no existe consenso al respecto.
Informe público suizo de evaluación
Como parte de la revisión de la Ley de Productos Terapéuticos (TPA, Art. 67), Swissmedic publica información adicional de interés general en el ámbito de los productos terapéuticos. Por ejemplo, en el caso de los medicamentos de uso humano, se elabora un informe resumido de evaluación (“Informe público suizo de evaluación”, SwissPAR) tras la decisión de aprobar o rechazar una autorización de comercialización, con el fin de aumentar la transparencia del procedimiento de autorización. Esto es tanto más importante cuanto que otros países (por ejemplo, los países en desarrollo) toman ejemplo de la autorización suiza [6,7].
Literatura:
- Federación Internacional de EM: Atlas de la EM. www.msif.org/about-us/who-we-are-and-what-we-do/advocacy/atlas, última consulta: 28.02.19.
- Dippel FW, et al: Los datos del seguro médico confirman la alta prevalencia de la esclerosis múltiple. Akt Neurol 2015; 42(4): 191-196.
- Koch-Henriksen N, et al: La incidencia de la EM ha aumentado notablemente a lo largo de seis décadas en Dinamarca, sobre todo en los casos de aparición tardía y en las mujeres. Neurología 2018; 90(22): 1954-1963.
- Noseworthy JH, et al: Esclerosis múltiple. N Engl J Med 2000; 343(13): 938-952.
- Montalban X, et al: Directriz ECTRIMS/EAN sobre el tratamiento farmacológico de las personas con esclerosis múltiple. Mul Scler 2018; 24(2): 96-120.
- Dalla Torre Di Sanguinetto S, et al: Una revisión comparativa de las decisiones de autorización de comercialización en Suiza, la UE y Estados Unidos. Ther Innov Regul Sci 2019; 53(1): 86-94.
- Achtnichts L, et al.: Aspectos específicos de la inmunoterapia para la esclerosis múltiple en Suiza: un comentario estructurado. Clinical and Translational Neuroscience [en prensa).
- Cohen JA, et al: Alemtuzumab frente a interferón beta 1a como tratamiento de primera línea para pacientes con esclerosis múltiple remitente-recurrente: un ensayo de fase 3 aleatorizado y controlado. Lancet 2012; 380(9856): 1819-1828.
- Coles AJ, et al: Alemtuzumab para pacientes con esclerosis múltiple recidivante tras un tratamiento modificador de la enfermedad: un ensayo aleatorizado controlado de fase 3. Lancet 2012; 380(9856): 1829-1839.
- Kappos L, et al: Ensayo controlado con placebo de fingolimod oral en la esclerosis múltiple recidivante. N Enl J Med 2010; 362: 387-401.
- Cohen JA, et al: Fingolimod oral o interferón intramuscular para la esclerosis múltiple remitente recidivante. N Enl J Med 2010; 362(5): 402-415.
- Traboulsee A, et al: Revised Recommendations of the Consortium of MS Centers Task Force for a Standardized MRI Protocol and Clinical Guidelines for the Diagnosis and Follow Up of Multiple Sclerosis. Am J Neuroradiol 2016; 37(3): 394-401.
- Berger JR, et al: Leucoencefalopatía multifocal progresiva tras el tratamiento con fingolimod. Neurología 2018; 90(20): 1815-1821.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2019; 17(2): 28-30.