Antes de iniciar la terapia, los pacientes con GIST deben ser discutidos en una junta tumoral interdisciplinar. En caso de riesgo de recaída de intermedio a alto, debe considerarse la terapia adyuvante con imatinib tras la resección. Los pacientes con GIST metastásico se benefician de los inhibidores de la tirosina quinasa y de las intervenciones locales.
El tumor del estroma gastrointestinal (GIST) es una entidad tumoral mesenquimal del tracto gastrointestinal o -mucho más raramente- de los tejidos blandos intraabdominales. Se supone que las llamadas células de Cajal son las células de origen. Estas células musculares especializadas se encuentran en el plexo mesentérico y tienen una función de marcapasos con respecto a la contracción peristáltica. Los GIST pueden aparecer a lo largo de todo el tracto gastrointestinal, pero es más frecuente encontrarlos en el estómago (50%) y el intestino delgado (30-35%), y mucho menos en el colon/recto (5%) o el esófago (<1%). Los GIST que surgen en el epiplón, el mesenterio o retroperitonealmente se denominan E-GIST (extragastrointestinales) y son una rareza.
La incidencia anual del GIST se cifra en la literatura en unos diez casos por millón de habitantes. Si además se incluyen los denominados micro-GIST (tumor GIST <1 cm), que se encuentran de forma autópsica hasta en un 20% de los pacientes mayores de 50 años en la zona del estómago/unión gastroesofágica, entonces es mucho mayor. Sin embargo, los micro-GIST tienen un potencial de malignidad extremadamente bajo y, por lo tanto, representan un subgrupo separado y clínicamente irrelevante.
Diagnóstico y estadificación
La mayoría de los pacientes diagnosticados de GIST son sintomáticos de la enfermedad tumoral. Clásicamente, informan de hemorragias gastrointestinales, dolor abdominal, náuseas, vómitos o irregularidades en las heces. Sin embargo, debido al mayor uso del diagnóstico por imagen en el contexto de otras cuestiones, hasta en un 25% de los casos se detecta un GIST en pacientes completamente asintomáticos.
En última instancia, el diagnóstico del GIST sólo puede hacerse sobre la base de una histología típica. Histológicamente, una biopsia obtenida por endoscopia es claramente preferible a una biopsia percutánea. La positividad para CD117 y DOG1 distingue un GIST de otros tumores mesenquimales o de un carcinoma o melanoma de crecimiento mesenquimal (Fig. 1).
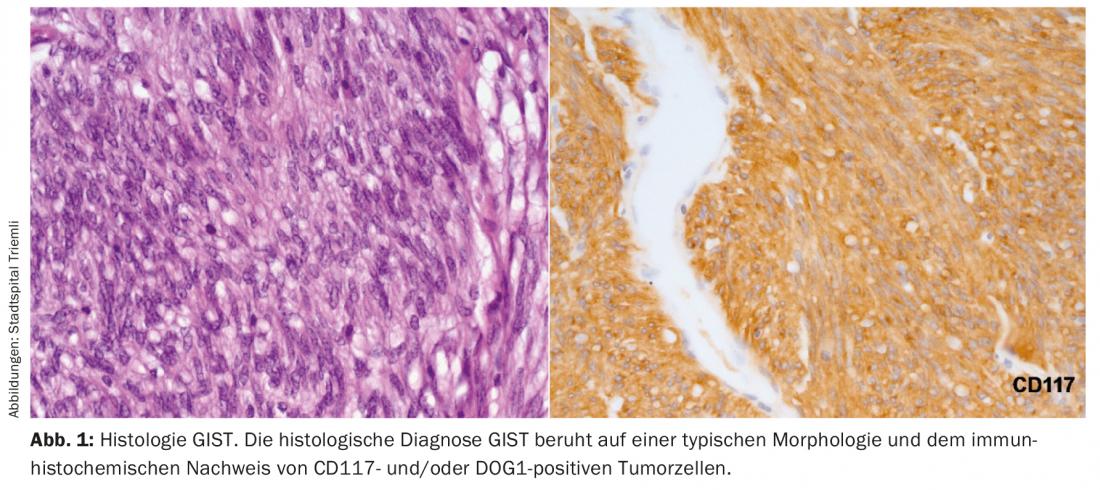
Las metástasis del GIST suelen desarrollarse en el hígado, el epiplón o el peritoneo. Las metástasis fuera del abdomen sólo se observan en la enfermedad avanzada y ya tratada de forma intensiva. Por lo tanto, debe realizarse al menos un TAC de abdomen/pelvis con contraste o una RMN de abdomen como examen de estadificación inicial.
Patología molecular
El 75% de los pacientes con GIST presentan una mutación del gen c-Kit, normalmente en el exón 11 o 9. La segunda alteración molecular más común (10%) es una mutación en el gen PDGFR. Todos estos cambios conducen a una activación continua de las células. Si no puede detectarse ni una mutación c-KIT ni una PDGFR, se habla de un denominado GIST de tipo salvaje, aunque su definición está actualmente en proceso de cambio. Sin embargo, a menudo se encuentran cambios en los genes BRAF, RAS y SDH-A-D. Los GIST de tipo salvaje suelen verse en asociación con la neurofibromatosis, la tríada de Carney o el síndrome de Carney-Stratakis.
GIST localizado no metastásico
Los GIST localizados no metastásicos deben resecarse siempre que sea posible. La resección completa es la única terapia curativa.
Alternativamente, los tumores <2 cm pueden controlarse endosonográficamente y sólo resecarse si el tamaño progresa.
Resección
El objetivo principal de la resección quirúrgica curativa de un GIST es lograr una situación R0 (sin restos tumorales macroscópicos o microscópicos en el margen de la incisión). La resección R0 suele lograrse si se mantiene una distancia de seguridad de 1-2 cm con respecto al tumor. El alcance de la intervención quirúrgica depende en gran medida del tamaño y la localización del GIST. Un GIST de tamaño pequeño o mediano en el cuerpo del estómago puede extirparse a menudo con una simple resección gástrica parcial laparoscópica. Sin embargo, si el GIST se localiza en el duodeno, por ejemplo, es posible que la extensión de la resección deba ampliarse a una duodenopancreatectomía de Whippel. A diferencia de la mayoría de los demás tumores malignos del tracto gastrointestinal (por ejemplo, adenocarcinoma, tumores neuroendocrinos), la resección de un GIST no requiere la disección locorregional de los ganglios linfáticos debido a la rareza de las metástasis ganglionares (prevalencia <1%). Sólo en los raros GIST pediátricos o en adultos jóvenes (<40 años) el riesgo de metástasis en los ganglios linfáticos es significativamente mayor (20-59%), lo que por supuesto puede influir en la táctica quirúrgica. En principio, se opta por una resección laparoscópica si es posible debido a la recuperación más rápida. Sin embargo, en el curso de la resección, la cápsula tumoral no debe romperse en ningún caso, ya que de lo contrario se produciría una siembra peritoneal de células tumorales, lo que daría lugar a una situación tumoral paliativa por regla general. Los GIST grandes, en particular, suelen tener una cápsula muy blanda y frágil que puede romperse rápidamente si se manipulan con descuido (laparoscópicamente). Por lo tanto, las ventajas de la resección laparoscópica deben sopesarse siempre bien frente a los riesgos de rotura del tumor en el curso de una “laparoscopia acrobática de alto nivel”, especialmente en el caso de tumores de gran tamaño.
Terapia adyuvante
A pesar de una resección R0 exitosa, los pacientes pueden desarrollar metástasis con el tiempo. El riesgo de desarrollar metástasis depende principalmente del índice mitótico, el tamaño del tumor y la localización en el tracto gastrointestinal; estos factores se registran en el denominado índice de Miettinen (Tab. 1) [1]. Las tablas de recaída desarrolladas por Heikki Joensuu [2] tienen una graduación más fina y, por lo tanto, reflejan mejor el riesgo individual de recaída. Todos los estudios que investigaron el beneficio de la terapia adyuvante utilizaron el inhibidor de la tirosina cinasa (ITC) imatinib. Los criterios de inclusión, así como la duración de la terapia, variaron de un estudio a otro. Basándose en los datos del ensayo SSGXVIII/AIO [3], que mostraron un beneficio de supervivencia de tres años frente a un año de terapia con imatinib, actualmente se recomienda una duración de la terapia de tres años. Actualmente se está investigando en estudios si tiene sentido o no una mayor duración de la terapia (un total de cinco o seis años). Mientras que en el ensayo SSGXVIII/AIO sólo se incluyeron pacientes con criterios de “alto riesgo” -basados en el consenso modificado de los NIH aplicado en aquel momento-, en la actualidad se ofrece terapia adyuvante a las pacientes con un riesgo de recaída de moderado a alto, según Miettinen. Especialmente en pacientes con un riesgo moderado, es importante comparar en una discusión los beneficios con los efectos secundarios (como mucositis, calambres musculares, náuseas). A diferencia de los estudios, ahora se recomienda un análisis de mutaciones al inicio de la terapia. Si existe una mutación insensible al imatinib, por ejemplo PDGFR D842V, una terapia tan costosa y también gravosa no tiene sentido. Actualmente no está claro si los pacientes con una mutación en el exón 9 también se benefician de una dosis más alta de imatinib (800 mg/d) en un contexto adyuvante, en analogía con los datos del contexto paliativo. Sin embargo, la experiencia ha demostrado que una dosis de 800 mg/d no puede continuarse durante un periodo de tiempo más largo debido a la toxicidad asociada.
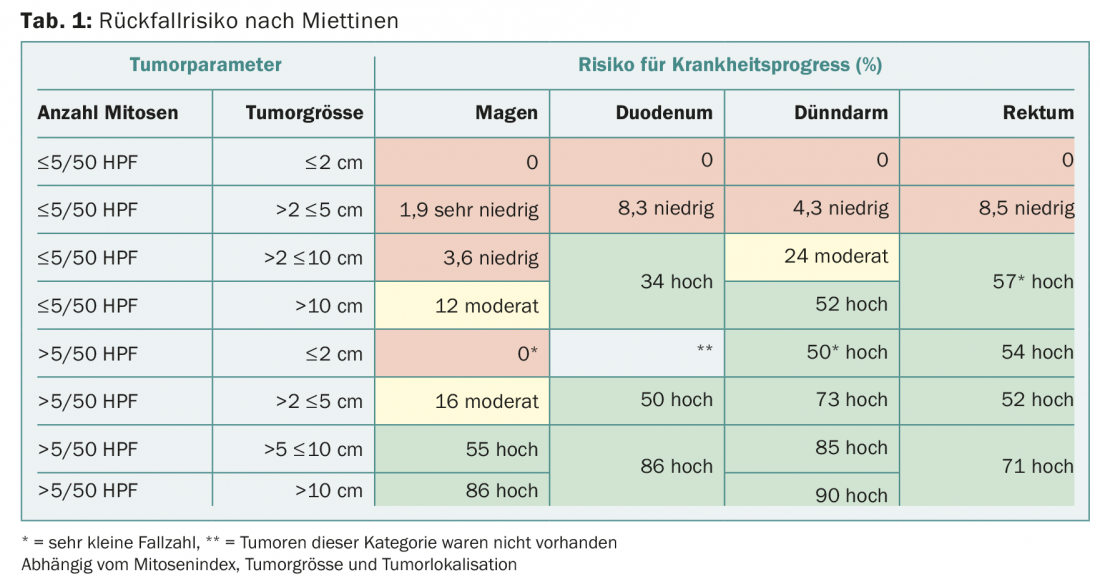
Terapia neoadyuvante
En el caso de los tumores localmente avanzados, la opción de la terapia neoadyuvante debe discutirse siempre en la junta interdisciplinar de tumores, especialmente si es necesaria una cirugía mutiladora para la resección completa. Los requisitos previos para la terapia neoadyuvante son un diagnóstico histológicamente verificado de GIST y la presencia de una mutación sensible al imatinib. Se recomienda una estrecha vigilancia por imágenes para evitar una progresión no deseada. Utilizando la PET, se puede hacer una declaración sobre la respuesta tan pronto como un mes después del inicio de la terapia (Fig. 2).
La duración óptima de la terapia neoadyuvante no está clara, pero la mayoría de la bibliografía establece de seis a nueve meses [4].
Cuidado posterior
Tras la cirugía, así como durante y después de la terapia adyuvante, se recomiendan exámenes clínicos regulares y pruebas de imagen. Por desgracia, no existe un plan de seguimiento basado en pruebas. Durante los dos primeros años después de la cirugía o tras la interrupción de la terapia adyuvante, realizamos imágenes abdominales cada tres a seis meses – en los momentos de menor riesgo de recaída (durante la terapia adyuvante en curso; de tres a cinco años después de la cirugía o tras la interrupción de la terapia con imatinib) sólo cada seis a doce meses. Debido a las imágenes seriadas y a la exposición a la radiación asociada, es preferible una RMN a un TAC, especialmente en pacientes jóvenes.
GIST metastásico no resecable
Tratamiento farmacológico: Gracias al uso de los TKI, el pronóstico de los pacientes con GIST metastásico ha mejorado significativamente, pasando de una media de diez a unos 55 meses. Si existe una mutación sensible al imatinib, el tratamiento de primera línea de elección es el imatinib 400 mg/día. En pacientes con una mutación en el exón 9, se recomienda principalmente una dosis de 800 mg/día basándose en los datos del meta-GIST [5]. En caso de progresión, se dispone de los TKI sunitinib [6] y regorafenib [7], que se han investigado en ensayos de fase III. A menudo, los pacientes se encuentran todavía en un buen estado general después de haber pasado por las tres líneas de terapia establecidas (imatinib, sunitinib, regorafenib), por lo que uno desearía ofrecerles una terapia eficaz. A menos que puedan incluirse en un ensayo, una reexposición con imatinib sin duda tiene sentido, aunque el beneficio de la SLP fue muy limitado en comparación con el placebo en el ensayo RIGHT. Mecánicamente, se supone que los clones sensibles al imatinib que eran resistentes a las terapias TKI anteriores se impusieron. Aunque este efecto sólo se estudió para el imatinib, probablemente pueda extrapolarse a los demás TKI.
Otros TKI como el pazopanib [8] o el ponatinib [9] sólo se compararon en ensayos de fase II con el “mejor tratamiento de apoyo”. Sí dieron lugar a una prolongación significativa, pero desgraciadamente muy limitada, de la SLP. Principalmente, estabilizaron la enfermedad. Lamentablemente, sólo en raras ocasiones se observó una respuesta clara en el sentido de una respuesta parcial o completa. Por ello, los investigadores están depositando sus esperanzas en otras sustancias como el cabozantinib o el inhibidor de los puntos de control nivolumab.
Un enfoque de estudio completamente diferente pero muy interesante consiste en tratar a los pacientes con GIST con citostáticos convencionales como la doxorrubicina o el paclitaxel tras años de terapia con TKI. La esperanza es que el GIST, que solía ser resistente a la quimioterapia, haya cambiado tanto debido a la larga terapia con TKI que ahora sea sensible a la quimioterapia.
Aunque los TKI imatinib, sunitinib y regorafenib son las llamadas “terapias dirigidas”, desgraciadamente con el tiempo se producen toxicidades relativamente considerables. Con sunitinib, el 20% de los pacientes desarrollaron toxicidad de grado III (principalmente fatiga, síndrome mano-pie), con regorafenib incluso hasta el 60% (hipertensión, síndrome mano-pie). Para contrarrestar estos efectos secundarios en una fase temprana, es necesaria una evaluación periódica por parte de un médico o una enfermera. Del mismo modo, los pacientes deben ser conscientes del problema del cumplimiento de la medicación, así como de las interacciones.
Siempre que un paciente con enfermedad GIST esté bajo una terapia sistémica, debe evaluarse el comportamiento de la terapia tanto clínica como radiológicamente a intervalos regulares. Mientras que los colegas radiólogos utilizan los criterios RECIST para la evaluación de la terapia en la gran mayoría de las entidades tumorales, los criterios de Choi deben utilizarse para los pacientes con GIST. Éstas también incluyen la densidad tumoral en la evaluación y, por tanto, reflejan mejor el comportamiento biológico del GIST [10].
Terapia no farmacológica: Si un paciente muestra progresión, es útil una evaluación interdisciplinar. Esto significa que, además de las opciones medicinales, también se utilizan plenamente las opciones quirúrgicas. Especialmente si hay progresión focal y desarrollo de resistencia de metástasis individuales a la terapia farmacológica, también debe discutirse la resección de estas metástasis resistentes a la terapia. La tomografía computarizada FDG-PET es una herramienta diagnóstica útil para localizar la progresión focal. La resección de estas metástasis focalmente resistentes a la terapia puede evitar una nueva escalada farmacológica en algunos pacientes. Por lo demás, la resección quirúrgica de las metástasis sólo está indicada en caso de complicaciones sintomáticas (dolor, obstrucción intestinal o hemorragia gastrointestinal). Como alternativa a la resección quirúrgica paliativa de metástasis individuales, debe considerarse el uso de otros métodos de ablación local como la radioterapia estereotáctica o la radiofrecuencia o radioterapia. Debe considerarse la ablación por microondas.
Mensajes para llevarse a casa
- Los pacientes diagnosticados de GIST deben ser siempre discutidos en una junta tumoral interdisciplinar antes de iniciar la terapia.
- En el caso de los GIST con un riesgo de recurrencia de intermedio a alto, la terapia adyuvante con imatinib debe evaluarse con la paciente tras una resección exitosa.
- Los pacientes con GIST metastásico no sólo se benefician de los inhibidores de la tirosina quinasa imatinib, sunitinib y regorafenib, aprobados en Suiza y cubiertos por el seguro médico, sino también de medidas locales como la cirugía, la ARF o la radioterapia.
Literatura:
- Miettinen M, et al: Seminarios de Patología Diagnóstica 2006; 23: 70-83.
- Joensuu H, et al: Lancet Oncology 2012; 13: 265-274.
- Joensuu H, et al: JAMA 2012; 307(12): 1265-1272.
- Rutkowski P, et al: Ann Surg Oncol 2013; 20: 2937-2943.
- Grupo de metaanálisis de tumores del estroma gastrointestinal: JCO 2010; 28: 1247-1253.
- Demetri G, et al: Lancet 2006; 368: 1329-1338.
- Demetri G, et al: Lancet 2013; 381: 295-302.
- Mir O, et al: Lancet Oncol 2016; 17: 632-641.
- Heinrich M, et al: J Clin Oncol 2015; resumen 10535.
- Benjamin RS, et al: J Clin Oncol 2007; 25(13): 1760-1764.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(3): 24-28











