Belantamab mafodotin (BLENREP) es el primer y único conjugado anticuerpo-fármaco dirigido contra BCMA* que se aprobó en Suiza en junio de 2022, y está disponible en régimen de pago por uso desde noviembre de 2022 para el tratamiento del mieloma múltiple en pacientes adultos muy pretratados que hayan experimentado una progresión de la enfermedad durante su última terapia [1,2]. El tratamiento ambulatorio con monoterapia BLENREP mostró una respuesta profunda y duradera y un perfil de seguridad manejable en el ensayo pivotal DREAMM-2 [3,4].
El mieloma múltiple (MM), que pertenece a los linfomas de células B, constituye alrededor del 10% de todas las neoplasias hematológicas [5]. Las opciones de tratamiento existentes han permitido aumentar la supervivencia global (SG) de los pacientes con MM en los últimos años, pero la aparición de clones resistentes sigue conduciendo con frecuencia al fracaso del tratamiento. Con cada tratamiento posterior, la profundidad y la duración de la respuesta se reducen; una parte de los pacientes se vuelven refractarios a los inhibidores del proteasoma (IP), los inmunomoduladores (IMID) y los anticuerpos monoclonales. Estos pacientes tienen opciones de tratamiento limitadas y, con una mediana de SG de 5,6 meses, un mal pronóstico [6]. Esto refleja la urgente necesidad de nuevas opciones terapéuticas con mecanismos de acción innovadores [6]. En el ensayo pivotal DREAMM-2, el conjugado anticuerpo-fármaco dirigido a BCMA* belantamab mafodotin (BLENREP) mostró una respuesta buena y duradera en pacientes múltiples refractarios muy pretratados, especialmente cuando se midió por la extensión del pretratamiento [3,4,7].
Respuesta profunda y sostenida con BLENREP en el estudio DREAMM-2
En el estudio DREAMM-2 de fase II, multicéntrico, abierto y de dos brazos, 97 pacientes cuya enfermedad era progresiva tras ≥3 líneas de tratamiento recibieron 2,5 mg/kg de BLENREP cada 3 semanas como monoterapia hasta la progresión de la enfermedad o una toxicidad inaceptable [3,4]. La tasa de respuesta global (TRO), que fue evaluada por un comité independiente, fue el criterio de valoración principal y fue del 32% (31/97; IC del 97,5%: 21,7-43%–43,6%) tras una mediana de seguimiento de 13 meses [4]. La mayoría (18/31; 58%) de estos respondedores se beneficiaron de una remisión parcial muy buena (VGPR†: n=11) o de una respuesta aún más profunda (CR‡, sCR‡; n=7). Los criterios de valoración secundarios incluyeron la mediana de la duración de la respuesta (mDOR; 11 meses [IC 95%: 4,2-NE]) y la mediana esperada de la SG (13,7 meses [IC 95%, 9,9 meses-no alcanzada]) en la población global. La respuesta y la supervivencia de los pacientes con citogenética asociada al riesgo o insuficiencia renal fueron comparables a los resultados de la población general [4].
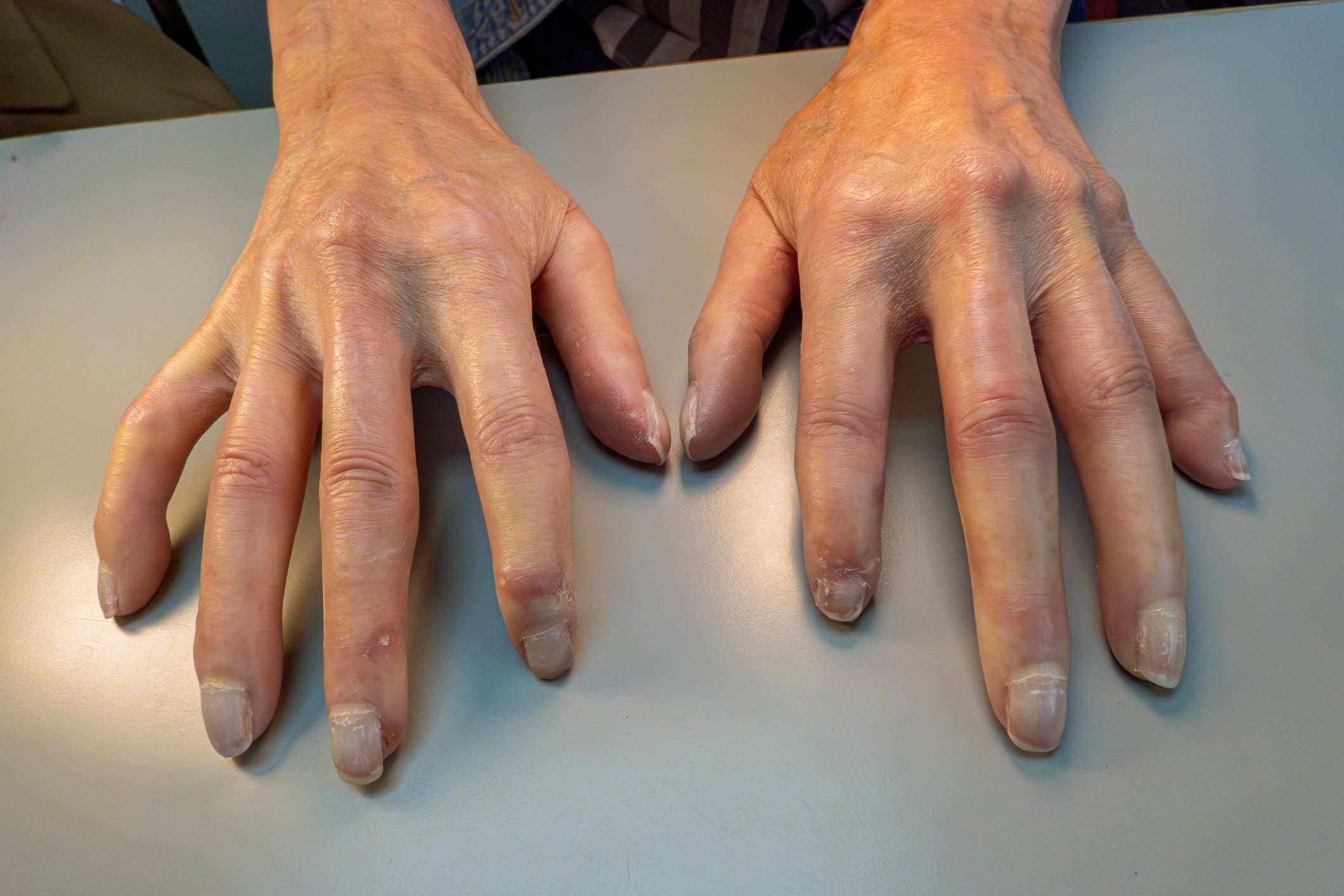
Seguimiento de los cambios corneales
Las reacciones adversas más frecuentes con 2,5 mg/kg de BLENREP fueron queratopatía (72%, gravedad ≥3 en el 46%) y trombocitopenia (38%, gravedad ≥3 en el 22%). Los efectos secundarios corneales provocaron el retraso del tratamiento en el 47% de los pacientes, pero su interrupción definitiva sólo en el 3%. Después de 13 meses, los cambios en la agudeza visual se habían resuelto en el 82% de los pacientes; no se observó ninguna pérdida visual permanente [4]. Para controlar los efectos secundarios, se realiza un examen oftalmológico antes de iniciar el tratamiento con BLENREP y antes de los tres primeros ciclos posteriores. Los pacientes también deben evitar las lentes de contacto y utilizar regularmente sustitutos lagrimales sin conservantes. En cuanto aparezcan efectos secundarios en la córnea, ajuste la dosis de BLENREP o retrase el tratamiento [1]. Aunque en este estudio se utilizaron con frecuencia modificaciones de la dosis (retrasos o reducciones) para controlar los efectos secundarios, éstas tuvieron un impacto mínimo en la respuesta en el BLENREP [4].
Conclusión
BLENREP está aprobado en Suiza desde junio de 2022 y será reembolsado por las cajas de enfermedad desde noviembre de 2022 si se cumple el límite [1,2]. BLENREP está aprobado como monoterapia para el tratamiento del MM en pacientes adultos muy pretratados con al menos cuatro terapias previas que mostraron progresión de la enfermedad durante la última terapia y cuya enfermedad es refractaria al menos a un inhibidor del proteasoma, un inmunomodulador y un anticuerpo monoclonal anti-CD38 [1]. Por tanto, los pacientes con un alto grado de pretratamiento en particular pueden beneficiarse ahora de esta nueva opción de tratamiento eficaz y tolerable.
* BCMA = antígeno de maduración de células B, proteína de superficie que se encuentra exclusivamente en las células del mieloma y en las células plasmáticas.
† VGPR = respuesta parcial muy buena
‡ RC = respuesta completa; sCR=respuesta completa estricta
Literatura:
- Información técnica actual BLENREP®, www.swissmedicinfo.ch.
- www.spezialitätenliste.ch. Visitado el: noviembre de 2022.
- Lonial S et al: Belantamab mafodotin for relapsed or refractory multiple myeloma (DREAMM-2): a two-arm, randomised, open-label, phase 2 study. The Lancet Oncology 2020; 21(2): 207-221.
- Lonial S et al: Longer term outcomes with single-agent belantamab mafodotin in patients with relapsed or refractory multiple myeloma: 13-month follow-up from the pivotal DREAMM-2 study. Cáncer 2021; 127(22): 4198-4212.
- Moreau P et al: Mieloma múltiple: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Ann Oncol 2017; 28(suppl_4): iv52-iv61.
- Gandhi UH et al: Resultados de pacientes con mieloma múltiple refractarios a la terapia con anticuerpos monoclonales dirigidos a CD38. Leucemia 2019; 33(9): 2266-2275.
- Trudel S et al: Targeting B-cell maturation antigen with GSK2857916 antibody-drug conjugate in relapsed or refractory multiple myeloma (BMA117159): a dose escalation and expansion phase 1 trial. Lancet Oncol 2018; 19(12): 1641-1653.
Informe público responsable y financiado por
GlaxoSmithKline AG
Talstrasse 3, 3053 Münchenbuchsee.
Contacto: +41 31 862 21 11
Las marcas registradas pertenecen a sus respectivos propietarios. ©2022 Grupo de empresas GSK o su licenciante.
Breve información técnica BLENREP®:
Blenrep (polvo para concentrado para solución para perfusión) W: Belantamab mafodotin. I: Monoterapia para el tratamiento del mieloma múltiple en pacientes adultos que ya han recibido al menos 4 líneas de terapia y cuya enfermedad es refractaria al menos a un inhibidor del proteasoma, un inmunomodulador y un anticuerpo monoclonal anti-CD38 y que mostraron progresión de la enfermedad durante la última terapia. No se ha estudiado la eficacia y la seguridad en pacientes con terapia celular CART previa dirigida por BCMA. D: 2,5 mg/kg de peso corporal en infusión intravenosa cada 3 semanas. Consulte el SmPC para conocer los ajustes de dosis recomendados debido a efectos adversos. KI: Hipersensibilidad a un ingrediente. W/V: Se han observado efectos adversos en la córnea. Deben realizarse exámenes oftalmológicos antes del inicio del tratamiento, antes de los 3 ciclos de tratamiento siguientes y durante el curso posterior del tratamiento si está clínicamente indicado. Se recomienda el uso de un sustituto lagrimal sin conservantes. Se han notificado casos de trombocitopenia. Debe solicitarse un hemograma antes de iniciar el tratamiento y, si está clínicamente indicado, durante el mismo. Se han observado reacciones a la infusión y casos de neumonitis. Para conocer las medidas recomendadas para el grado 2 o superior, consulte el SmPC. IA: No se han realizado estudios formales. S/S: Las mujeres en edad fértil deben utilizar un método anticonceptivo eficaz desde el inicio de la terapia hasta 4 meses, y los hombres con parejas en edad fértil deben utilizar un método anticonceptivo eficaz desde el inicio de la terapia hasta 6 meses después de la última dosis. Embarazo y lactancia: Sin datos. Blenrep no debe utilizarse durante el embarazo a menos que el tratamiento con Blenrep sea necesario debido al estado clínico de la mujer. Se debe aconsejar a las mujeres que desteten antes de iniciar la terapia con Blenrep y que no den el pecho hasta 3 meses después de la última dosis. UW: Muy frecuentes: neumonía, infecciones del tracto respiratorio superior, trombocitopenia, anemia, neutropenia, queratopatía, eventos de visión borrosa, eventos de ojo seco, fotofobia, náuseas, diarrea, vómitos, fiebre, fatiga, aumento de aspartato aminotransferasa, aumento de gamma-glutamil transferasa, reacciones relacionadas con la infusión. Frecuentes: linfopenia, leucopenia, irritación ocular, aumento de la creatina fosfoquinasa. Ocasionales: queratitis, albuminuria. Desconocida: Neumonitis. P: vial de 100 mg. AK: A. Fecha de información: junio de 2022. GlaxoSmithKline AG, 3053 Münchenbuchsee. Encontrará información detallada en www.swissmedicinfo.ch. Por favor, notifique las reacciones adversas a los medicamentos en pv.swiss@gsk.com. Los profesionales pueden solicitar las referencias mencionadas a GlaxoSmithKline AG. Este medicamento está sujeto a un seguimiento adicional. Para más información, consulte el folleto de Blenrep en www.swissmedicinfo.ch.
PM-CH-BLM-ADVR-220027–11/2022