Los cambios en la terapia de primera línea del cáncer de pulmón no microcítico con mutación del EGFR son inminentes. Con el ensayo FLAURA, el osimertinib se presenta con confianza por primera vez como una opción de tratamiento para los pacientes sin tratamiento previo.
Apenas pasa un congreso de oncología sin que se obtengan resultados de peso en el campo del cáncer de pulmón no microcítico (CPNM). Por lo tanto, no es de extrañar que los estudios sobre el CPNM también constituyeran una parte fundamental de las presentaciones del congreso de la ESMO de este año. Esta vez se refería al tratamiento de primera línea de pacientes avanzados con mutaciones del EGFR.
Breve reseña
En 2016, InFo ONKOLOGIE & HÄMATOLOGIE informó como de costumbre desde la Conferencia Europea sobre Cáncer de Pulmón en Ginebra. En ese momento, dos resúmenes de última hora habían demostrado la eficacia del osimertinib, un potente inhibidor selectivo de la tirosina quinasa (anti-EGFR) de tercera generación, en la población mencionada. Se trataba de resultados de estudios parcialmente agrupados de las fases I y II. Las investigaciones en cuestión se denominaron AURA P1, AURA extensión y AURA 2. Concluyeron unánimemente que el osimertinib a la dosis de 80 mg/día en pacientes con CPNM avanzado y la mutación EGFR T790M que habían progresado con una terapia EGFR TKI previa proporcionó una tasa de respuesta elevada durante un periodo relativamente largo con una supervivencia sin progresión alentadora y un perfil de efectos secundarios manejable. ¿Por qué es importante? Ahora bien, cuando se detecta una mutación conductora del EGFR, lo que ocurre en aproximadamente el 15% de todos los casos de CPNM en el mundo occidental y en un buen tercio en el mundo asiático, se dispone desde hace tiempo de inhibidores de la tirosina cinasa (ITC) específicos y dirigidos con buenos resultados. Sin embargo, estos TKIs conducen al desarrollo de resistencia y a la progresión de la enfermedad – la mutación T790M del gatekeeper es la causa de la mayoría de todas las resistencias. El osimertinib como inhibidor del EGFR con mutaciones sensibilizadoras (EGFRm) y de la mutación T790M de resistencia a los TKI llena este vacío y, por tanto, se incluyó con gratitud en el régimen terapéutico. En consecuencia, el osimertinib también ha sido aprobado en Suiza en el entorno de segunda línea desde mediados del año pasado.
Primera línea como objetivo
Sin embargo, incluso entonces se hizo evidente que el osimertinib también se abriría paso en el mercado de primera línea. Otra presentación en el ELCC 2016 con datos positivos de 60 pacientes sin tratamiento así lo sugería. El osimertinib retrasa la resistencia. Evidentemente, el tumor tiene que buscar nuevos mecanismos de resistencia además de la mutación EGFR T790M. Entonces, ¿qué ocurre si se bloquea esta “vía de escape” central del tumor desde el principio?
La claridad final debía aportarla un ensayo de fase III con más de 500 pacientes que comparara el osimertinib con el erlotinib y el gefitinib (“tratamiento estándar”). Los resultados se esperaban en aproximadamente un año y medio: en ESMO 2017 llegó el momento. Esto por adelantado: la presentación fue convincente. Es probable que el osimertinib esté pronto disponible en el entorno de primera línea.
FLAURA – la historia de éxito continúa
El ensayo de fase III en cuestión tiene el sonoro nombre de FLAURA. En el estudio participaron 556 adultos de Asia, Europa y Norteamérica con CPNM avanzado con mutaciones activadoras del EGFR-TK, incluida la deleción en el exón 19 y la mutación puntual L858R en el exón 21. Se aleatorizaron en primera línea para recibir el “tratamiento estándar”, que es Gefitinib 250 mg/día o erlotinib 150 mg/día, u osimertinib 80 mg/d. El cruce a osimertinib fue posible en progresión y resistencia a T790M. Las características basales de los pacientes, como el estado de la mutación, el sexo, las metástasis en el SNC y la etnia (asiática, no asiática) se distribuyeron uniformemente entre los brazos.
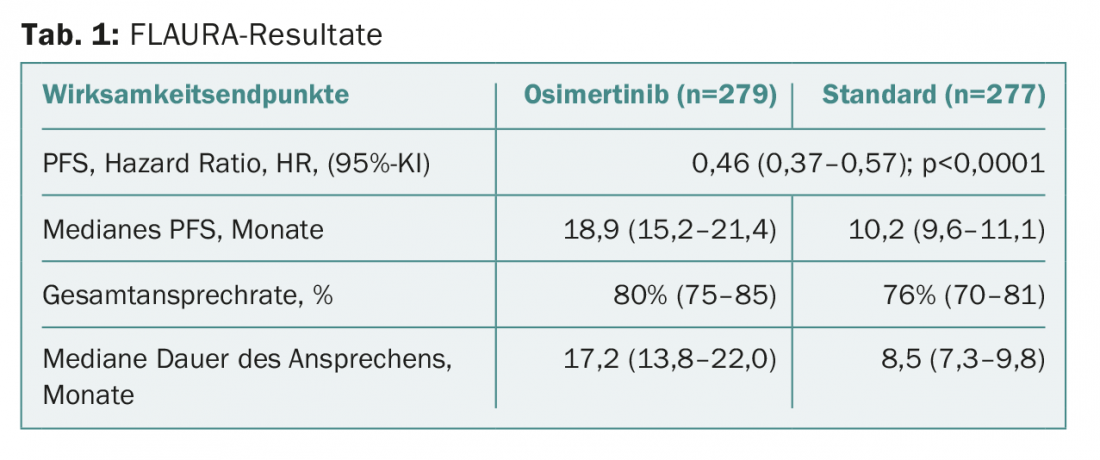
El criterio de valoración primario, la supervivencia sin progresión, se amplió a 18,9 meses con la sustancia de ensayo, frente a los 10,2 meses con la terapia estándar. Esto corresponde a una reducción del riesgo clínica y estadísticamente significativa en más de la mitad. Los valores se muestran en la tabla 1 . El beneficio se observó en todos los subgrupos predefinidos (incluidos los pacientes con/sin metástasis cerebrales al inicio del estudio). Actualmente sigue pendiente el correspondiente análisis final sobre la supervivencia global. El análisis provisional aún no había revelado ningún valor estadísticamente significativo. En esta fase inicial, los datos aún están “inmaduros”. Por tanto, aún no es posible hacer una afirmación concluyente al respecto. La duración de la respuesta se duplicó con osimertinib.
Los acontecimientos adversos más frecuentes con osimertinib fueron -como ya se sabía por estudios anteriores- la diarrea (58%, en un 2% al menos de grado 3) o la piel seca (32%). En general, los acontecimientos adversos de cualquier causa fueron igual de frecuentes en los dos brazos. Los casos graves se produjeron con mayor frecuencia bajo la terapia estándar (lo que incidentalmente también se aplicó a la correspondiente tasa de interrupción de la terapia: 13% frente a 18%). En general, el osimertinib obtiene por tanto mejores resultados en términos de seguridad.
¿Están todos de acuerdo?
Los autores deducen de los datos un perfil superior de riesgo-beneficio para el osimertinib en el contexto de primera línea. El perfil de seguridad fue claramente mejor a pesar de la mayor duración global del tratamiento con la sustancia de ensayo (16,2 meses). El hecho de que el beneficio en la SLP con/sin metástasis cerebrales fuera casi el mismo (HR 0,47 y 0,46) sugiere que el osimertinib es activo tanto en el cerebro como sistémicamente. Esto es especialmente importante en el caso de los tumores con mutación del EGFR, ya que a menudo cursan con metástasis cerebrales. Los resultados de la actividad cerebral se ven respaldados por el hallazgo de que el 6% en el grupo de osimertinib pero el 15% en el grupo estándar desarrollaron progresión del SNC. También cabe destacar que las curvas de SLP divergieron significativamente muy pronto y siguieron diferenciándose claramente durante el curso. La evolución de la supervivencia global también parece prometedora. Así que parece un cambio de paradigma.

¿Fue igual de positiva la respuesta entre los expertos y los visitantes de la conferencia? En su mayor parte, sí. La relevancia de la primera línea fue claramente concedida a FLAURA. Se realizaron comparaciones con la situación en tumores con mutación ALK y el estudio correspondiente sobre alectinib – publicado recientemente en NEJM [1]. También en este caso, la cuestión era si el uso de primera línea era superior a la secuenciación de las sustancias activas. En concreto, esto significa que se consigue una SLP más larga con el segundo agente original en primera línea de lo que sería posible con la secuenciación. Sin embargo, mientras que la situación de ALK es muy clara, la de FLAURA es algo más compleja. Esto se debe a que sólo aproximadamente la mitad de la población del estudio FLAURA habría necesitado y se habría beneficiado del osimertinib en segunda línea tras la terapia de primera línea con los agentes establecidos (ya que habrían desarrollado resistencia a través de T790M). Teniendo en cuenta que el estudio también incluye un gran número de pacientes que nunca habrían desarrollado dicha resistencia, sino un tipo diferente de resistencia, no cabría esperar una mediana de SLP de 19 meses. Estos periodos tan largos sólo suelen conseguirse con pacientes aptos para la secuenciación con osimertinib (esto no es estadísticamente cierto para aproximadamente el 50% de la población FLAURA). Para todos los demás, cabe suponer períodos más cortos, ya que a menudo sólo pueden pasar a la quimioterapia después de la terapia de primera línea. Teniendo esto en cuenta, 19 meses de supervivencia libre de progresión es impresionante y de hecho argumenta a favor del uso de primera línea en esta población. En particular, dado que nunca se sabe con certeza si es posible cambiar a osimertinib o a otra terapia específica de segunda línea -ya que al principio de la terapia inicial sigue sin estar claro si los pacientes desarrollarán resistencias como la T790M y, por tanto, se beneficiarán de los agentes específicos-, los 19 meses con osimertinib que pueden conseguirse por adelantado pueden facilitar la decisión de utilizarlo en primera línea. Libremente según el principio: “el ganador se lo lleva todo”.
Sin embargo, puede que no sea tan sencillo después de todo. En este contexto, también es importante seguir desarrollando el sistema operativo en FLAURA. Aún no se ha dicho la última palabra para los tumores con mutación del EGFR.
Fuente: Congreso de la Sociedad Europea de Oncología Médica (ESMO) 2017, 8-12 de septiembre de 2017, Madrid.
Literatura:
- Peters S, et al: Alectinib frente a crizotinib en el cáncer de pulmón no microcítico ALK-positivo no tratado. N Engl J Med 2017; 377: 829-838.
- Eggermont AM, et al: Supervivencia prolongada en el melanoma en estadio III con terapia adyuvante de ipilimumab. NEJM 2016; 375: 1845-1855.
- Weber J, et al: Nivolumab adyuvante frente a ipilimumab en melanoma resecado en estadio III o IV. NEJM 2017 10 de septiembre. DOI: 10.1056/NEJMoa1709030 [Epub ahead of Print].
- Long GV, et al: Dabrafenib adyuvante más trametinib en el melanoma con mutación BRAF en estadio III. NEJM 2017 10 de septiembre. DOI: 10.1056/NEJMoa1708539 [Epub ahead of print].
InFo ONCOLOGÍA 2017; 5(5): 35-37











