La realización de citometría de flujo a partir de muestras de LCR de alta calidad permitió identificar firmas de células inmunitarias específicas en diferentes enfermedades neurológicas. De este modo, se podría mejorar la diferenciación de diversas enfermedades neurológicas, por ejemplo, las neuropatías inmunitarias y las enfermedades autoinmunitarias del sistema nervioso central, y adquirir conocimientos sobre las posibles poblaciones celulares implicadas en las distintas enfermedades.
En el Departamento de Neurología con Instituto de Neurología Traslacional del Hospital Universitario de Münster, se realizó citometría de flujo a partir de muestras de LCR de alta calidad a una escala nunca antes alcanzada y se estableció una base de datos única y exhaustiva que permitió la identificación de firmas de células inmunitarias específicas en diferentes enfermedades neurológicas. Esto ha mejorado la diferenciación de varias enfermedades neurológicas, por ejemplo, las neuropatías inmunitarias y las enfermedades autoinmunitarias del sistema nervioso central, y ha permitido conocer las posibles poblaciones celulares implicadas en las distintas enfermedades. El siguiente artículo permite hacerse una idea de los trabajos científicos basados en la citometría de flujo a partir del líquido cefalorraquídeo y ofrece una breve visión general de ciertas composiciones de células inmunitarias en importantes enfermedades neurológicas.
El LCR como ventana diagnóstica al sistema nervioso central
El líquido cefalorraquídeo (LCR para abreviar) es un fluido transparente que circula por el sistema nervioso central (SNC) y rodea el cerebro y la médula espinal. En este contexto, el LCR no sólo proporciona protección mecánica, sino que probablemente también suministra nutrientes a las células del sistema nervioso central [1], sirve como medio de transporte para las células inmunitarias [2] y media en el transporte de antígenos entre el SNC y los compartimentos periféricos, como la sangre [3]. La fracción no celular del LCR se produce como un ultrafiltrado a partir del suero en el plexo coroideo de los ventrículos cerebrales, por lo que los solutos pasan del suero al LCR en función de su tamaño. El drenaje del LCR (reabsorción en la circulación) tiene lugar a través de los sistemas venoso y linfático [3,4]. Las células del LCR son los leucocitos, que se denominan leucocitos del LCR o células del LCR. La concentración de células en el LCR es unas mil veces menor que en la sangre periférica. En condiciones fisiológicas, el LCR contiene ≤4 leucocitos de LCR/µl (o <5/leucocitos de LCR/µl). El perfil celular en el LCR es linfocítico y monocítico y se caracteriza por un predominio de linfocitos T CD4+. En comparación con la sangre periférica, las células de memoria y los linfocitos T reguladores y las células asesinas naturales (NK) aumentan en el LCR, mientras que los linfocitos B se reducen y las células plasmáticas no están presentes en condiciones fisiológicas [5,6]. Esto sugiere que la composición celular del LCR forma un compartimento propio, sujeto a una regulación y un control estrictos y que debe regularse independientemente de la sangre periférica. Dado que el LCR rodea el sistema nervioso central, es el compartimento más cercano al SNC accesible en la práctica clínica para el análisis diagnóstico mediante punción lumbar. Es bien sabido que el LCR puede proporcionar información sobre los mecanismos celulares de las enfermedades del SNC. El inmunofenotipado de las células del LCR -como presentamos en este artículo- puede ayudar a obtener nuevos conocimientos sobre la fisiopatología, hacer más precisos los análisis diagnósticos y evaluar mejor el pronóstico individual. En el futuro, esto podría ayudar a desarrollar nuevos enfoques terapéuticos para diversas enfermedades del sistema nervioso [7,8].
Citometría de flujo de células de LCR a una escala sin precedentes
La citometría de flujo es un método para la detección cuantitativa y la caracterización molecular de las células. Orientado a las propiedades celulares, este procedimiento permite la clasificación en diferentes clases celulares (por ejemplo, linfocitos, monocitos). En la citometría de flujo, las células de una suspensión se registran en un denominado citómetro de flujo. Cada célula individual atraviesa un rayo láser, a partir de cuyo “perfil de respuesta” es posible detectar el tamaño celular, la granularidad celular y la expresión de marcadores celulares de cada célula individual. Las combinaciones específicas de marcadores determinan de qué población celular se trata (Tab. 1) [5,14].
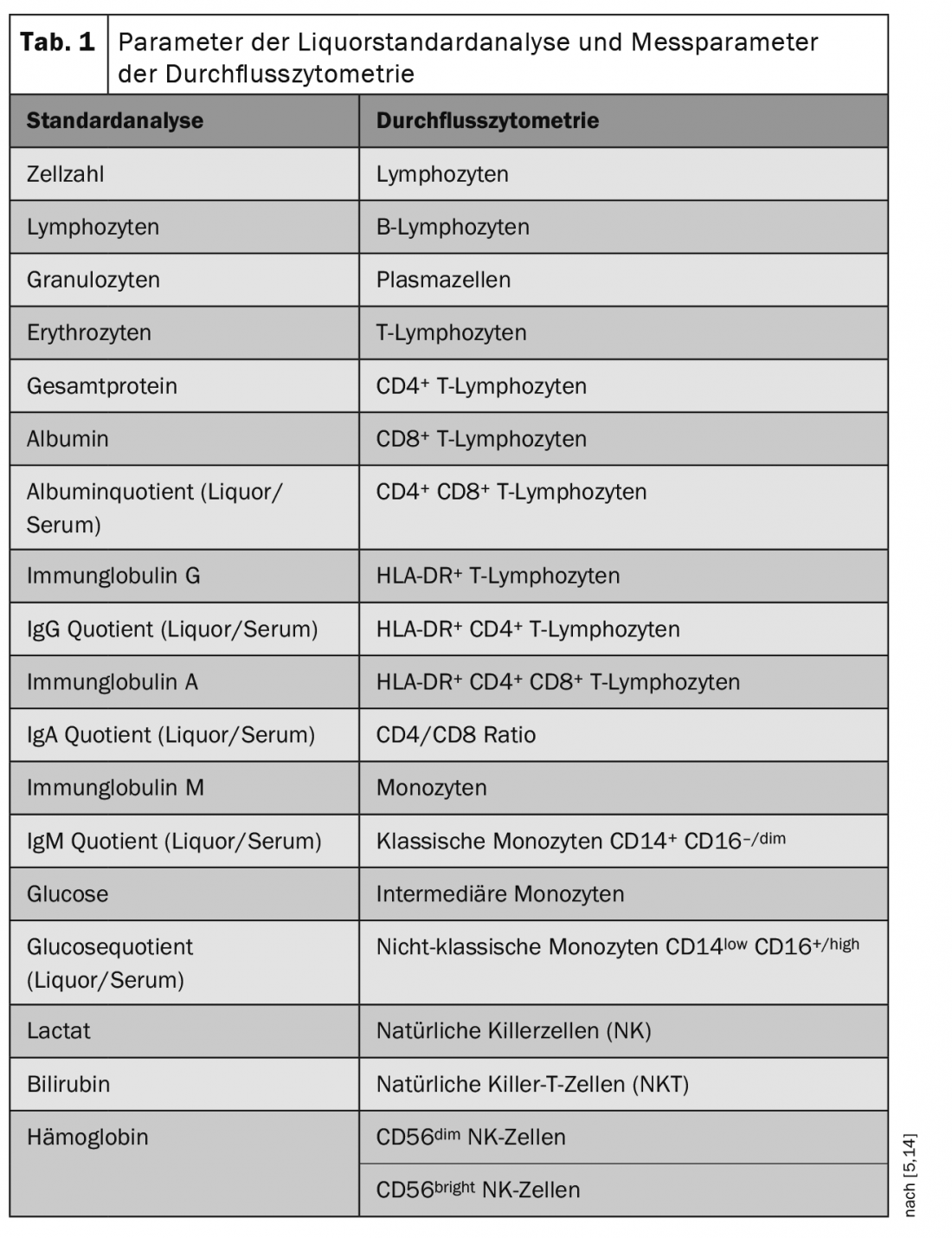
En el laboratorio de LCR del Departamento de Neurología con el Instituto de Neurología Traslacional del Hospital Universitario de Münster se han llevado a cabo en los últimos años exámenes citométricos de flujo muy amplios a partir de sangre y, en particular, también de muestras de LCR de alta calidad de pacientes con diversas enfermedades neurológicas. Cada año se analizaron unas mil muestras de LCR mediante citometría de flujo estandarizada y los conjuntos de datos se recogieron en un biobanco. Estos datos han alcanzado así una escala sin precedentes y están a disposición de numerosas redes de investigación tanto a nivel nacional como internacional.
En el primer trabajo científico resultante, se compararon las células inmunitarias en el líquido cefalorraquídeo y la sangre de pacientes con enfermedades autoinmunes del sistema nervioso central y periférico [5,9]. El análisis citométrico de flujo también se ha utilizado en pacientes con enfermedades neurodegenerativas como la demencia de Alzheimer y la demencia frontotemporal [7,10]. En colaboración con el Departamento de Psiquiatría del Hospital Universitario de Münster, se examinaron los leucocitos de muestras de sangre y líquido cefalorraquídeo de pacientes con trastornos psicóticos primarios y se compararon con los perfiles inmunológicos de las enfermedades neurológicas.
La base de datos del Departamento de Neurología con el Instituto de Neurología Traslacional del Hospital Universitario de Münster seguirá ampliándose con nuevos conjuntos de datos en el futuro y servirá como fuente de información para realizar análisis más profundos y diagnósticos diferenciales específicos de diversas enfermedades.
Neuropatías
Las neuropatías -enfermedades del sistema nervioso periférico- son muy comunes y pueden afectar a las fibras nerviosas motoras, sensoriales y autonómicas. Clínicamente, las neuropatías se diferencian en función de su patrón de distribución, curso clínico y génesis. Según la localización de los nervios afectados, se distingue entre mononeuropatías y polineuropatías (PNP). Existe un amplio espectro de posibles causas de las neuropatías, incluidas las enfermedades metabólicas, tóxicas, hereditarias, infecciosas, autoinmunes, vasculíticas, paraproteinémicas y malignas. La causa más común de polineuropatía en el mundo occidental es la diabetes mellitus, seguida de la génesis etilotóxica. Hasta un 10% de las neuropatías están causadas por procesos autoinmunes, por lo que también se denominan neuropatías inmunitarias [11].
El diagnóstico se basa principalmente en la anamnesis, así como en la exploración física y neurológica. Se presta especial atención a las infecciones previas, por ejemplo la gastroenteritis y las infecciones del tracto respiratorio superior, las enfermedades preexistentes y los síntomas de otros sistemas orgánicos, por ejemplo los síntomas autonómicos. La primera prueba de laboratorio es una prueba diagnóstica estándar. Con la ayuda del diagnóstico ampliado de ciertos anticuerpos gangliósidos (GM1, GM2, GQ1b, etc.), se puede apoyar el diagnóstico de una neuropatía inmunitaria autoinmune en caso de sospecha clínica. Los parámetros inflamatorios, la inmunoelectroforesis, los anticuerpos reumáticos (ANA, AN-CA) o los anticuerpos antineuronales (anti-Hu, anti-CV2/CRMP5, anti-anfifisina, anti-Ma2) pueden ser indicativos de una enfermedad sistémica o maligna como causa de las polineuropatías inflamatorias. Para excluir las infecciones víricas o bacterianas, puede añadirse un historial médico completo y un diagnóstico serológico de patógenos víricos (EBV, CMV, HSV, VZV, FSME, HBV, VIH, polio) o bacterianos (Borrelia, Treponema pallidum). Las mediciones electrofisiológicas pueden detectar con mayor precisión los patrones de distribución y daño y permitir la clasificación en diferentes subtipos. La electromiografía puede utilizarse para detectar otros patrones de daño miogénico como la denervación, la atrofia muscular y la actividad espontánea. Las técnicas de imagen como la ecografía y la resonancia magnética pueden visualizar patrones de daño y ayudar en el diagnóstico de exclusión de otras causas de neuropatías, por ejemplo, tumores neuronales como los schwannomas.
Neuropatías inmunitarias
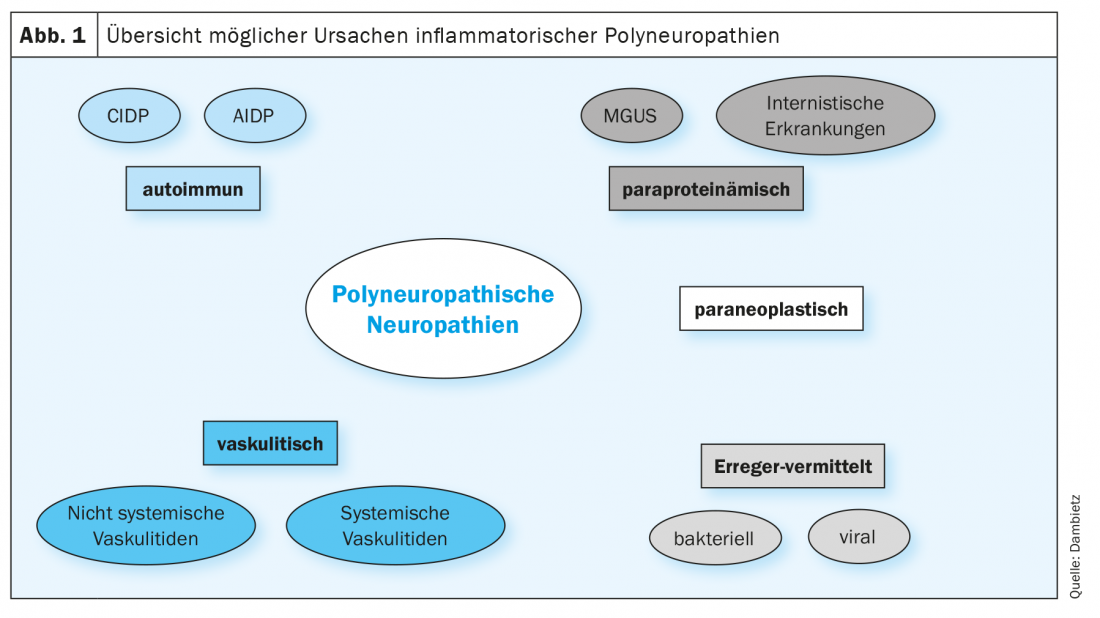
Las neuropatías inmunitarias son especialmente relevantes porque pueden tratarse si se diagnostican a tiempo y se inicia la terapia de forma adecuada. Principalmente, las neuropatías inmunitarias se dividen en un tipo de curso agudo (≤cuatro semanas), subagudo (de cuatro a ocho) o crónico (≥ocho semanas). La polirradiculoneuropatía desmielinizante inflamatoria aguda (AIDP) se denomina síndrome de Guillain-Barré (SGB) y es la forma más común de las neuropatías inmunitarias agudas, mientras que la polineuropatía desmielinizante inflamatoria crónica (CIDP) es el prototipo de las neuropatías inmunitarias crónicas. El diagnóstico diferencial de las polineuropatías inflamatorias sigue siendo un gran reto hoy en día. Además de las neuropatías autoinmunes, deben considerarse otras causas para el diagnóstico diferencial (Fig. 1).
Diferenciación de las neuropatías inmunitarias mediante perfiles de células inmunitarias
La clasificación en neuropatías inmunitarias agudas y crónicas es en parte artificial y existen muchos solapamientos y transiciones fluidas entre ambas formas. Así, la PDIC muestra un inicio agudo similar al SGB hasta en un 10% de los casos. Por el contrario, se ha descrito un curso subagudo que dura más de cuatro semanas en casos clasificados inicialmente como SGB [12]. Hasta el momento, no existen parámetros pronósticos que permitan predecir un curso agudo frente a uno crónico en el momento de la primera manifestación clínica. Dado que las opciones terapéuticas y la respuesta a las distintas terapias inmunomoduladoras difieren en el SGB y la PDIC, la diferenciación temprana de las entidades es importante y podría tener un impacto positivo en el curso y el pronóstico de las enfermedades.
En las mediciones estándar del líquido cefalorraquídeo en las neuropatías inflamatorias, puede detectarse una denominada “diseminación citoalbuminosa” con un aumento de las proteínas totales en el líquido cefalorraquídeo con un recuento celular normal y, a menudo, un trastorno de la barrera hematoencefálica.
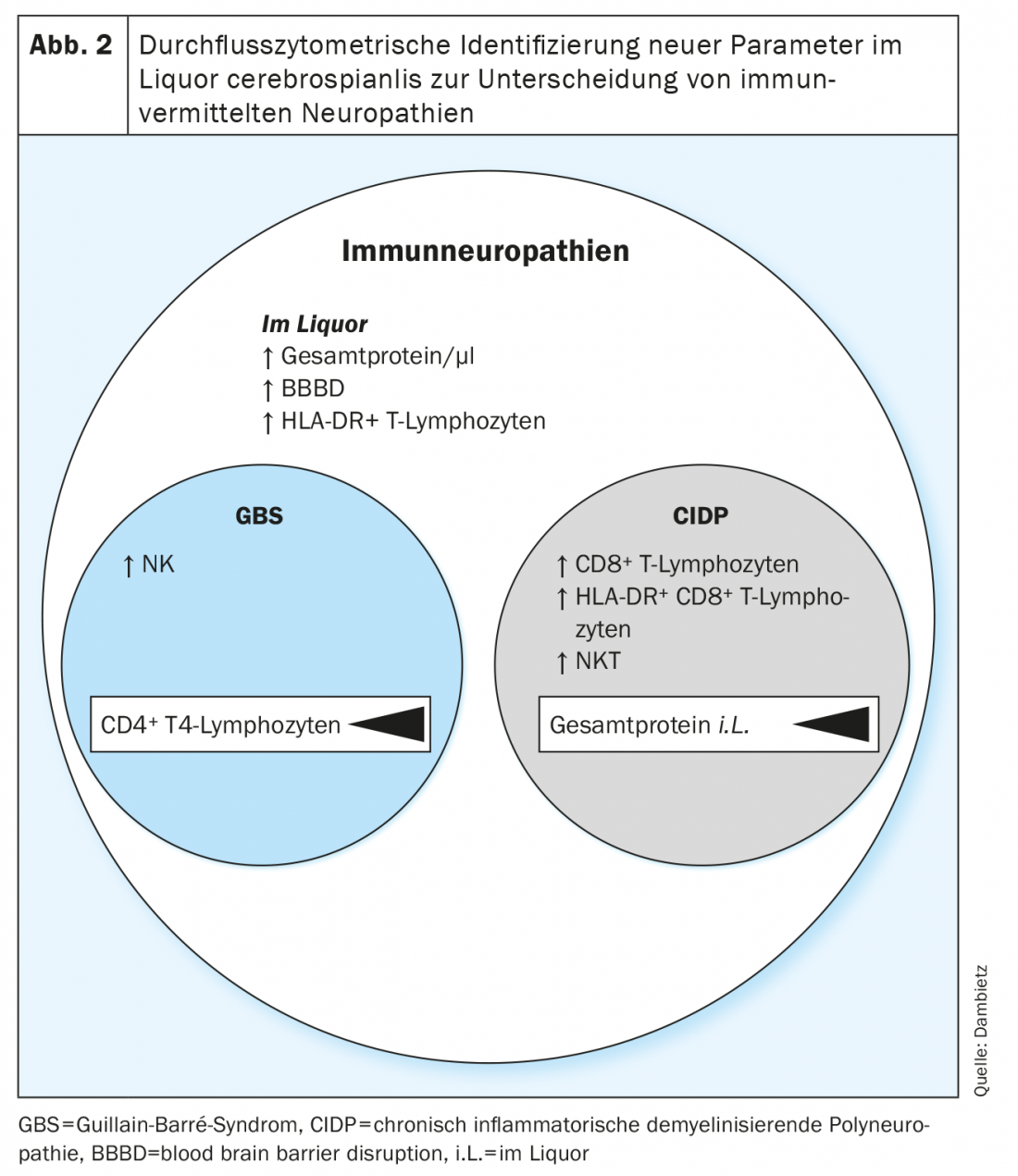
Ahora, por primera vez, mediante citometría de flujo, se han analizado retrospectivamente y comparado las composiciones de células inmunitarias en el LCR de pacientes con SGB y PDIC [13]. Los perfiles heterogéneos indicaban la implicación de diferentes poblaciones celulares en la fisiopatología de las neuropatías inmunitarias agudas frente a las crónicas.
En la citometría de flujo, se registró un mayor número de linfocitos T activados y no activados (HLA-DR+ frente a HLA-DR-) en el LCR de los pacientes con neuropatías inflamatorias. Sin embargo, la activación de los linfocitos T, así como el aumento de las proteínas en el LCR y la alteración de la barrera hematoencefálica, son parámetros inespecíficos de las neuropatías y sólo sirven para distinguir entre el SGB y la PDIC, ya que una activación de los linfocitos T se encuentra con frecuencia tanto en las formas agudas como crónicas de las neuropatías y también puede detectarse en otras enfermedades neurológicas. [14,15].
Más concretamente, se detectó una mayor proporción de células asesinas naturales (NK) en el LCR del síndrome de Guillain-Barré, mientras que en la polineuropatía desmielinizante inflamatoria crónica aumentó el número de células asesinas T naturales (NKT) y de células CD8.+ Los linfocitos T aumentaron (Fig. 2). En una comparación directa del síndrome de Guillain-Barré y la polineuropatía desmielinizante inflamatoria crónica, la detección de células T asesinas naturales seguidas de monocitos clásicos e intermedios se definió como el parámetro con mayor confianza para diferenciar las dos entidades neuropáticas. El inmunoprofiling con las diferentes proporciones de células NK, NKT y T CD8+ revela patrones de células inmunitarias en el LCR específicos de la enfermedad y del subtipo y proporciona una indicación de la implicación de distintos tipos de células citotóxicas en la fisiopatología de las neuropatías inmunitarias agudas frente a las crónicas. Además, con la ayuda de los perfiles celulares individuales, se podría realizar una evaluación prospectiva entre el curso agudo y crónico en el momento de la primera manifestación clínica, lo que facilitaría la elección de la terapia.
El tratamiento de elección para el síndrome de Guillain-Barré es la plasmaféresis. Además, también se dispone de inmunoglobulinas intravenosas como opción terapéutica equivalente. Hoy en día, debido a una deficiencia ubicua de inmunoglobulinas, suelen utilizarse sólo de forma secundaria en la práctica clínica diaria y se aplican en particular para la intensificación de la terapia tras la plasmaféresis con una mejora insuficiente de los síntomas clínicos. Mientras que los corticosteroides no mostraron ningún efecto en el SGB [16], se demostró una buena eficacia en la polineuropatía desmielinizante inflamatoria crónica, por lo que se utilizan como estándar en el tratamiento de la CIDP [17–19].
Los pacientes con SGB y PDIC que no habían recibido terapia no mostraron diferencias significativas en sus perfiles de células inmunitarias en comparación con los pacientes que ya recibían terapia. En última instancia, esto significa que la diferenciación por citometría de flujo de las neuropatías inflamatorias también puede tener lugar durante la terapia y que los perfiles de células inmunitarias subtipo-específicas en el LCR no se ven distorsionados por el uso de inmunoglobulinas o corticosteroides, por ejemplo.
Para destacar la relevancia clínica de las composiciones de células inmunitarias específicas de cada subtipo, se detectaron parámetros que reflejan la manifestación clínica de las neruopatías. La gravedad de las enfermedades se basó en la puntuación de discapacidad de Hughes y en la escala de Rankin modificada (mRS). En el síndrome de Guillain-Barré, existía una correlación entre el número de linfocitos T CD4+ y monocitos no clásicos y la gravedad clínica de la enfermedad. En la PDIC, el nivel de proteína total en el LCR se correlacionó con la gravedad de la enfermedad. La citometría de flujo del LCR ha establecido un nuevo enfoque diagnóstico para identificar los cambios específicos de la enfermedad y del subtipo en las neuropatías inflamatorias autoinmunes, facilitando la diferenciación de la PDIC del SGB. En el futuro, esto podría ser la base para la evaluación del pronóstico y el desarrollo de nuevas terapias, y el análisis inmunocelular podría ampliarse a otras variantes neuropáticas.
Inmunofenotipos en el espectro de las enfermedades neurológicas
A partir del aumento de la información mediante el uso de la citometría de flujo en diferentes compartimentos (sangre y LCR), la recopilación de datos se amplió a un espectro más amplio de enfermedades neurológicas. En un estudio transversal retrospectivo, se investigó la composición de las células inmunitarias en pacientes con enfermedades autoinmunes, neurodegenerativas y vasculares. Al igual que las neuropatías inmunitarias, las enfermedades autoinmunitarias del sistema nervioso central representan un grupo heterogéneo de patologías neuroinflamatorias que aún hoy requieren una clasificación más específica y un diagnóstico diferencial más preciso y cuyos patomecanismos subyacentes aún no se han descifrado por completo.
Los parámetros individuales se detectaron mediante citometría de flujo y los rasgos que mejor diferencian las enfermedades neuroinflamatorias de las patologías neurodegenerativas y vasculares se extrajeron mediante análisis multidimensionales [5].
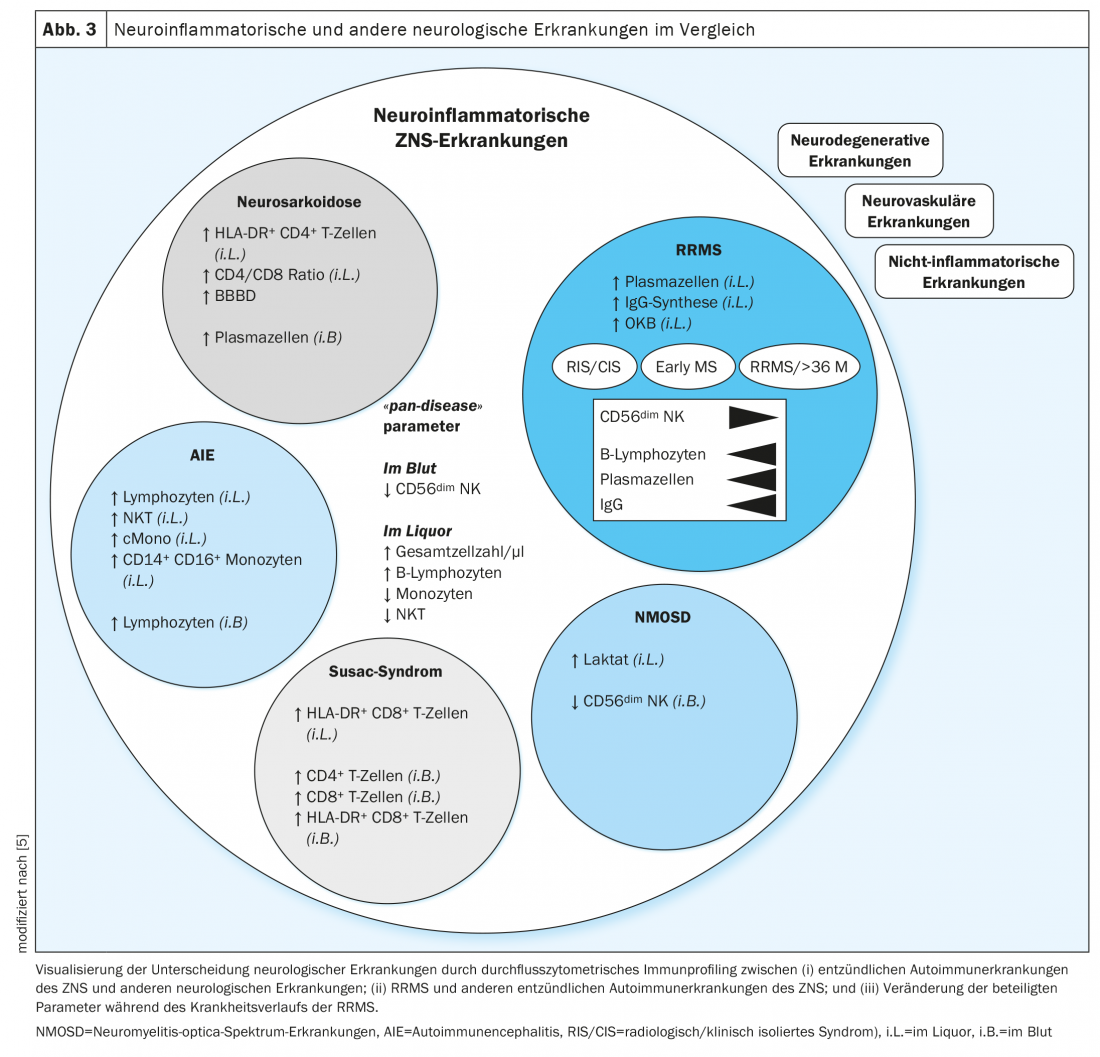
Los perfiles de células inmunitarias de las enfermedades neuroinflamatorias autoinmunes mostraron similitudes entre sí y diferencias con respecto a las enfermedades neurodegenerativas, vasculares y no inflamatorias (Fig. 3). En los perfiles de células inmunitarias de todas las enfermedades neuroinflamatorias, el recuento de células y la proporción de linfocitos B en el LCR aumentaron, mientras que los monocitos, las células asesinas naturales y las células T asesinas naturales disminuyeron. Además, se descubrió que un número reducido de células NK CD56dim en la sangre era indicativo de la presencia de una enfermedad inflamatoria del SNC. Estas características se definieron como parámetros “panenfermos” para las patologías autoinmunes del sistema nervioso central y, por tanto, indicaban cambios a través de las enfermedades (Fig. 3 ). En la esclerosis múltiple, se conoce desde hace muchos años un aumento del número de células en el LCR y una expansión significativa de las células del linaje de células B [20,21]. Curiosamente, estos parámetros eran modificables por las inmunoterapias y podrían utilizarse en el futuro como biomarcadores de respuesta a las terapias inmunomoduladoras y mejorar la evaluación pronóstica y la gestión de la terapia.
Composición de las células inmunitarias en las enfermedades neuroinflamatorias autoinmunes
Las firmas de células inmunitarias específicas de la enfermedad en el LCR también se han estudiado en varias otras enfermedades neurológicas.
En un estudio retroperspectivo, se compararon las composiciones de las células inmunitarias en la esclerosis múltiple remitente-recurrente (EMRR) y la neurosarcoidosis. La sarcoidosis es una enfermedad multisistémica autoinmune que se manifiesta con granulomas epitelioides en diversos órganos, donde provoca reacciones inflamatorias locales por infiltración de macrófagos [22]. En aproximadamente el 25% de los pacientes, el sistema nervioso central también se ve afectado [23]. Esto se manifiesta a menudo con síntomas neurológicos que pueden ser similares a los de una recaída de la EM. El diagnóstico de la sarcoidosis incluye un análisis de sangre con determinación de parámetros inflamatorios, inmunoglobulina G, ECA, receptor soluble de IL-2 (sIL-2R) y neopterina, así como una prueba de la función pulmonar, una broncoscopia con lavado broncoalveolar y biopsia transbronquial, una radiografía de tórax y, en función de la manifestación clínica, también más pruebas de imagen y exámenes interdisciplinarios [24,25]. En cuanto a la diferenciación de otras enfermedades inflamatorias, los parámetros químicos de laboratorio (ACE, sIL-2R) han demostrado ser inespecíficos e insuficientemente sensibles [26,27]. La distinción entre neurosarcoidosis y esclerosis múltiple tampoco está siempre clara en las imágenes, ya que las lesiones de la EM (lesiones de la sustancia blanca) y los cambios granulomatosos de la neurosarcoidosis suelen parecerse en las imágenes de resonancia magnética [28]. El análisis estándar “simple” del LCR también muestra desviaciones similares, como una leve pleocitosis [29]. El diagnóstico definitivo de la neurosarcoidosis sólo puede hacerse entonces, a veces, mediante biopsia de lesiones sospechosas de granuloma en el sistema nervioso central [30]. Sin embargo, una biopsia de este tipo es un procedimiento invasivo y arriesgado y sólo debe realizarse tras una cuidadosa evaluación de riesgos y beneficios. Para evitar una medida tan invasiva, es esencial establecer nuevas herramientas de diagnóstico. Bajo este aspecto se evaluó retrospectivamente la citometría de flujo del LCR y la sangre de pacientes con neurosarcoidosis y esclerosis múltiple.
En la citometría de flujo, la neurosarcoidosis se distinguió sorprendentemente bien de la esclerosis múltiple por una mayor proporción de células plasmáticas, monocitos intermedios y no clásicos en la sangre, mientras que el número de linfocitos T en la sangre se redujo en la neurosarcoidosis. El LCR mostró parámetros parcialmente coincidentes en ambas enfermedades, por lo que la proporción de linfocitos T CD4 positivos aumentó específicamente en la neurosarcoidosis. La diferenciación de las dos enfermedades se optimizó mediante la integración multidimensional de las composiciones celulares inmunológicas del LCR y la sangre (Fig. 3). El predominio de linfocitos T CD4 positivos activados y una relación CD4/CD8 aumentada en el LCR, así como una mayor proporción de células plasmáticas en la sangre se definieron como características de la neurosarcoidosis [14]. La detección de células plasmáticas en el líquido cefalorraquídeo, así como de la síntesis intratecal de IgG y de bandas oligoclonales, fue pionera en la esclerosis múltiple.
Las composiciones celulares inmunitarias individuales en el LCR permiten así diferenciar mejor estas dos enfermedades inflamatorias del sistema nervioso central y pueden permitir prescindir de las confirmaciones diagnósticas biópticas en la práctica clínica diaria y simplificar la elección de la terapia (inmunosupresores clásicos frente a terapias moduladoras de la EM).
Además, se centró la atención en la diferenciación de distintas enfermedades autoinmunes del sistema nervioso central y se compararon los perfiles de las células inmunitarias en la esclerosis múltiple, los trastornos del espectro de la neuromielitis óptica (NMOSD), la encefalitis autoinmune (AIE) y el síndrome de Susac. La ENMOS se caracteriza por una neuritis óptica recurrente y una mielitis con lesiones inflamatorias de larga duración [31]. La encefalitis autoinmune puede manifestarse clínicamente con cefalea, fiebre, disminución de la vigilancia, crisis epilépticas, pero también con déficits cognitivos. En la encefalitis por receptores NMDA (NMDARE) suelen aparecer déficits cognitivos, trastornos mnésicos y síntomas psicóticos [32, 33]. El síndrome de Susac es una endoteliopatía de los pequeños vasos sanguíneos del SNC mediada por células T CD8+ y se caracteriza clínicamente por una tríada de encefalopatía, pérdida auditiva y pérdida visual [34,35].
Mientras que estas enfermedades muestran cambios similares entre sí en los análisis estándar del LCR [36], la citometría de flujo reveló cambios subtipo-específicos en la composición de las células inmunitarias.
Además de la anteriormente conocida síntesis intratecal de IgG, también se ha identificado la síntesis intratecal de IgA e IgM como rasgos característicos de la EMRR. En las enfermedades del espectro de la neuromielitis óptica, fueron especialmente evidentes un número reducido de células NK CD56bright en la sangre y un aumento de la concentración de lactato en el líquido cefalorraquídeo. El síndrome de Susac se caracterizó por la detección de linfocitos T CD4+ y CD8+ en la sangre y una mayor proporción de linfocitos T CD8+ activados (HLA-DR+) en el líquido cefalorraquídeo y la sangre. Lo característico de la encefalitis autoinmune era la detección de un aumento del recuento de linfocitos en el LCR y la sangre, así como un aumento del número de células T asesinas naturales, monocitos clásicos y monocitos CD14+ CD16+ en el LCR.
Por tanto, con la ayuda del análisis citométrico de flujo de células inmunitarias del líquido cefalorraquídeo, la EMRR puede diferenciarse de las demás entidades con un alto grado de confianza. En un análisis multidimensional, las células plasmáticas en el LCR y la síntesis intratecal de IgG se definieron como los mejores parámetros para diferenciar la EMRR de otras enfermedades autoinmunes del SNC.
Se examinaron con más detalle los perfiles de las células inmunitarias de pacientes con esclerosis múltiple remitente-recurrente en distintas fases de la enfermedad. Independientemente del estadio de la enfermedad, los parámetros “panenfermos” se alteraron en la misma medida. Por el contrario, con la progresión de la enfermedad, se produjo una mayor reducción de CD56dim células NK en la sangre y un aumento de los linfocitos B intratecales, de las células plasmáticas y de la síntesis intratecal de IgG. (Fig. 3). Con la ayuda de parámetros específicos de las células inmunitarias que se correlacionan con la gravedad y la progresión de la enfermedad, podrían definirse nuevos marcadores mediante un seguimiento continuo que faciliten la evaluación de la actividad de la enfermedad y permitan una modulación terapéutica temprana para influir positivamente en el curso de la enfermedad. Datos adicionales procedentes de estudios longitudinales a lo largo de varias décadas podrían identificar parámetros que faciliten la detección de la transición de la EM remitente-recurrente a la EM secundaria progresiva. Por lo tanto, siguen siendo necesarios estudios prospectivos de confirmación.
El análisis preciso de los perfiles variables de las células inmunitarias en diferentes entidades patológicas debería ayudar en el futuro a obtener nuevos conocimientos sobre los patomecanismos comunes y distintos en las enfermedades individuales, pero la identificación de otros parámetros discriminatorios requiere cohortes más amplias, especialmente de pacientes con enfermedades raras como la NMOSD o el síndrome de Susac. En el futuro, la citometría de flujo no se limitará al campo de la neurología, sino que se extenderá a otras disciplinas médicas.
Análisis de células inmunitarias en el campo interdisciplinar
Numerosas enfermedades neuroinflamatorias también pueden manifestarse con síntomas psiquiátricos, por ejemplo las encefalitis autoinmunes como la encefalitis por receptores NMDA (NMDARE). Los diagnósticos erróneos que clasifican la AIE como un trastorno primario del grupo de los trastornos psiquiátricos se producen una y otra vez. Las consecuencias pueden ser graves. Incluso en la actualidad, el diagnóstico diferencial entre las enfermedades psiquiátricas y las autoinmunes neuroinflamatorias constituye un reto en la rutina clínica de la neurología y la psiquiatría. Además, el espectro de los trastornos psiquiátricos también incluye numerosas entidades cuya patogénesis aún no se comprende del todo [37]. En los últimos años también se ha hablado de mecanismos inmunológicos y autoinmunes, que también pueden contribuir al desarrollo de trastornos psiquiátricos [38–41]. Por este motivo, analizamos los datos de citometría de flujo en el contexto de los trastornos psiquiátricos. En el diagnóstico de las enfermedades psiquiátricas, el análisis del líquido cefalorraquídeo se ha utilizado hasta ahora principalmente para excluir enfermedades orgánicas.
En un estudio retrospectivo, se recopilaron datos sobre la composición de las células inmunitarias en enfermedades del espectro de la psicosis primaria (incluida la esquizofrenia, los trastornos delirantes, los trastornos psicóticos agudos y transitorios y los trastornos esquizoafectivos) y se compararon con las firmas de las células inmunitarias de las enfermedades neuroinflamatorias, en particular la NMDARE, un subtipo común de AIE.
Con ayuda de la citometría de flujo, se detectaron parámetros y se crearon puntuaciones multidimensionales, que no sólo sirven para el diagnóstico de exclusión, sino que también apoyan y facilitan el diagnóstico de los trastornos psicóticos primarios. Además, la composición de células inmunitarias específicas aporta pruebas de la implicación de determinadas subpoblaciones en la génesis y los mecanismos patológicos de las enfermedades psiquiátricas. Investigaciones anteriores han mostrado evidencias de un aumento del recuento de leucocitos en la sangre de pacientes con trastornos psicóticos [42]. Los análisis estándar del LCR han mostrado un aumento de las proteínas del LCR en las psicosis primarias y, a menudo, la presencia de un trastorno de la barrera hematoencefálica. Sin embargo, no existen parámetros específicos de laboratorio y de licor-química y hasta ahora no ha sido posible una diferenciación fiable de las enfermedades neurológicas mediante análisis estándar de sangre y licor.
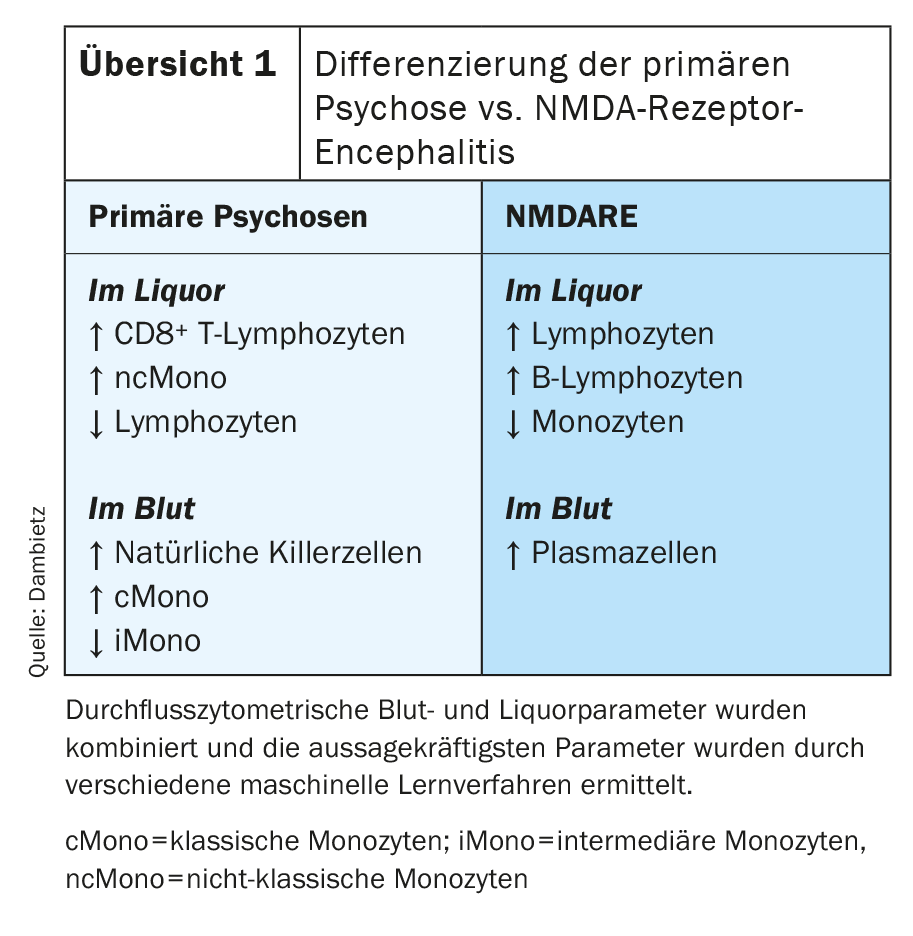
La citometría de flujo mostró cambios compartimentales específicos en el LCR y la sangre en pacientes con psicosis primarias [43]. La composición específica de las células inmunitarias en el LCR en los trastornos psicóticos primarios se caracterizó por un aumento de los linfocitos T CD8 positivos y de los monocitos, especialmente los monocitos no clásicos. Por otro lado, se redujo el número de linfocitos en el líquido cefalorraquídeo (resumen 1) . La sangre mostró un mayor número de células asesinas naturales y monocitos. Concretamente, aumentó el número de monocitos clásicos, mientras que disminuyó la proporción de monocitos intermedios en la sangre. La encefalitis por receptores NMDA (NMDARE) suele ir acompañada de síntomas psicóticos y puede ser difícil de distinguir clínicamente de las psicosis primarias. A pesar de la posibilidad de determinar los anticuerpos específicos contra el receptor de NMDA, es posible que se produzcan diagnósticos erróneos, ya que también existen variantes de encefalitis autoinmune con anticuerpos negativos [44]. Por esta razón, se compararon las dos enfermedades en particular. El perfil de células inmunitarias por citometría de flujo ha demostrado que el NMADRE puede diferenciarse bien de los trastornos psicóticos primarios por una mayor proporción de linfocitos, células B y monocitos en el LCR y la detección de células plasmáticas en la sangre (Visión general 1). Además, la citometría de flujo detectó una mayor proporción de células asesinas naturales en la sangre de los pacientes con síntomas psicóticos positivos.
Los trastornos psicóticos primarios son un grupo heterogéneo cuya compleja fisiopatología sigue sin comprenderse y sin explorarse en detalle en muchos aspectos. Investigaciones anteriores indican una desregulación del sistema inmunitario y componentes inflamatorios en el sistema nervioso central en pacientes con trastornos psicóticos primarios. Los resultados de la citrometría de flujo muestran cambios en la composición de las células inmunitarias en el líquido cefalorraquídeo y sugieren que los mecanismos inmunológicos, especialmente la inmunidad innata, junto con una función alterada de la barrera hematoencefálica contribuyen al desarrollo de los trastornos psicóticos primarios. La citometría de flujo ha identificado cambios típicos de la enfermedad en la composición de las células inmunitarias del LCR y la sangre, que sustentan el diagnóstico de psicosis primaria y apoyan la hipótesis inmunológica de la psicosis primaria.
Resumen
Con la ayuda de la citometría de flujo a partir del líquido cefalorraquídeo, se estableció la posibilidad de realizar nuevos análisis de las células inmunitarias específicas de la enfermedad y de los subtipos. Los exámenes citométricos de flujo del LCR han permitido una clasificación específica de las enfermedades neuroinflamatorias del sistema nervioso central y periférico. La composición de las células inmunitarias en el LCR de pacientes con SGB frente a pacientes con PDIC permite distinguir las dos entidades con mayor confianza. Además, en el momento del diagnóstico inicial de la neuropatía inflamatoria puede realizarse una evaluación temprana del curso de la enfermedad (aguda-monofásica frente a crónica-recurrente).
Además, las enfermedades inflamatorias autoinmunes del sistema nervioso central muestran cambios individuales en las subpoblaciones celulares tanto en la sangre como en el líquido cefalorraquídeo. Estas variaciones específicas de la enfermedad deberían mejorar la clasificación en las entidades individuales en el futuro y facilitar así el diagnóstico diferencial. Especialmente en el caso de hallazgos poco claros en otros exámenes, por ejemplo en imagen o en el caso de cambios químicos de laboratorio inespecíficos, el análisis citométrico de flujo a partir del líquido cefalorraquídeo puede ser revolucionario. Por ejemplo, al detectar lesiones inespecíficas en la resonancia magnética, como lesiones isquémicas frente a lesiones de la sustancia blanca (en la EM, la NMOSD o el síndrome de Susac), o granulomas en el sistema nervioso central frente a lesiones de EM, el diagnóstico puede complementarse con el análisis de células inmunitarias.
Además, un diagnóstico precoz puede allanar el camino para la toma de decisiones terapéuticas, como el uso de fármacos inmunomoduladores, y la influencia en el curso de la enfermedad puede optimizarse mediante una elección determinada de la terapia. El objetivo de los futuros análisis citométricos de flujo del LCR podría ser la detección de variables celulares inmunitarias que reflejen los efectos terapéuticos y permitan una mejor evaluación de la progresión de la enfermedad.
Además, el reconocimiento de firmas de células inmunitarias específicas de cada enfermedad señala el camino hacia la implicación de determinadas poblaciones celulares en el desarrollo de enfermedades neurológicas y en los mecanismos autoinmunes del sistema nervioso central y periférico. De este modo, constituye la base de análisis más profundos de los procesos fisiopatológicos.
En resumen, la citometría de flujo a partir del LCR representa una nueva opción diagnóstica para el análisis de perfiles celulares inmunitarios específicos. La citometría de flujo de pacientes con neuropatías inmunitarias, enfermedades neuroinflamatorias autoinmunitarias del SNC o trastornos psicóticos ha mostrado cambios celulares inmunitarios específicos de la enfermedad en compartimentos periféricos e intratecales, lo que sugiere la implicación del sistema inmunitario innato y de mecanismos inmunológicos en la etiología de las enfermedades. En particular, se ha demostrado que no sólo los componentes celulares de la sangre sino también las células inmunitarias específicas del LCR desempeñan un papel decisivo en la fisiopatología de las enfermedades neurológicas.
Con el establecimiento de una base de datos única de citometría de flujo a partir de muestras de líquido cefalorraquídeo de alta calidad, se ha creado la base para futuros proyectos de investigación más profundos en el Departamento de Neurología del Hospital Universitario de Münster.
Mediante la identificación de parámetros singulares y el establecimiento de puntuaciones multifactoriales, en el futuro podrían generarse perfiles de células inmunitarias específicos para cada enfermedad y subclase, que podrían utilizarse como novedosas herramientas de diagnóstico en la práctica clínica diaria y revolucionar tanto el diagnóstico como la terapia de las neuropatías inmunitarias y otras enfermedades.
Mensajes para llevarse a casa
- La citometría de flujo de las células del líquido cefalorraquídeo permite identificar perfiles de células inmunitarias específicos de la enfermedad.
- Ciertas poblaciones de leucocitos se han identificado como marcadores de enfermedades individuales y pueden estar implicadas en los patomecanismos individuales, por ejemplo las células T asesinas naturales para diferenciar las neuropatías inmunitarias agudas de las crónicas. Los monocitos en el líquido cefalorraquídeo podrían distinguir la psicosis primaria de la encefalitis por receptores de NDMA.
- Los análisis prospectivos de células del LCR podrían mejorar la selección y el seguimiento de las terapias en la práctica clínica diaria.
- La citometría de flujo de las células del LCR puede mejorar el diagnóstico de enfermedades con manifestaciones clínicas inespecíficas y síntomas superpuestos, facilitando así las decisiones terapéuticas.
Literatura:
- Iliff JJ, et al: Una vía paravascular facilita el flujo de LCR a través del parénquima cerebral y la eliminación de solutos intersticiales, incluida la beta amiloide. Sci Transl Med 2012; 4(147): 147ra111.
- Schlager C, et al.: Tráfico de células T efectoras entre las leptomeninges y el líquido cefalorraquídeo. Nature 2016; 530(7590): 349-353.
- Engelhardt B, Vajkoczy P, Weller RO: Los impulsores y moldeadores en el privilegio inmunitario del SNC. Nat Immunol 2017; 18(2): 123-131.
- Louveau A, et al.: Características estructurales y funcionales de los vasos linfáticos del sistema nervioso central. Nature 2015; 523(7560): 337-341.
- Gross CC, et al.: Clasificación de las enfermedades neurológicas mediante el análisis multidimensional del LCR. Cerebro, 2021. 144(9): 2625-2634.
- Han S, et al: Inmunofenotipado exhaustivo de las células del líquido cefalorraquídeo en pacientes con enfermedades neuroinmunológicas. J Immunol 2014; 192(6): 2551-2563.
- Pawlowski M, et al.: Relevancia de los niveles elevados de monocitos en el líquido cefalorraquídeo en pacientes con demencia frontotemporal. Neurobiol Aging 2018; 62: 45-52.
- Alvermann S, et al: Inmunofenotipado de las células del líquido cefalorraquídeo en la esclerosis múltiple: en busca de biomarcadores. JAMA Neurol 2014; 71(7): 905-912.
- Gross CC, et al: La alteración de la regulación mediada por NK de la actividad de las células T en la esclerosis múltiple se reconstituye mediante la modulación del receptor de IL-2. Proc Natl Acad Sci USA 2016; 113(21): E2973-2982.
- Lueg G, et al.: Relevancia clínica de la activación específica de células T en la sangre y el líquido cefalorraquídeo de pacientes con enfermedad de Alzheimer leve. Neurobiol Envejecimiento 2015; 36(1): 81-89.
- Wiendl HK, Kieseier B, Meuth S: Preguntas y respuestas sobre neuroinmunología 2015: 191-215.
- van Doorn PA: Diagnóstico, tratamiento y pronóstico del síndrome de Guillain-Barre (SGB). Press Med 2013; 42(6 Pt 2): e193-201.
- Heming M, et al: Los perfiles celulares inmunitarios del líquido cefalorraquídeo aportan conocimientos patogenéticos sobre las neuropatías inflamatorias. Front Immunol 2019; 10: 515.
- Heming M, et al: Los perfiles leucocitarios en sangre y LCR distinguen la neurosarcoidosis de la esclerosis múltiple. J Neuroimmunol 2020; 341: 577171.
- Li S, et al: La IL-17 y la IL-22 en el líquido cefalorraquídeo y el plasma están elevadas en el síndrome de Guillain-Barré. Mediadores Inflamm 2012; 2012: 260473.
- Ensayo doble ciego de metilprednisolona intravenosa en el síndrome de Guillain-Barré. Guillain-Barre Syndrome Steroid Trial GrouLancet, 1993. 341(8845): 586-590.
- Kieseier BC, et al: Neuropatías inmunomediadas. Nat Rev Dis Primers 2018; 4(1): 31.
- Nobile-Orazio E, Gallia F: Actualización sobre el tratamiento de la polirradiculoneuropatía desmielinizante inflamatoria crónica. Curr Opin Neurol 2015; 28(5): 480-485.
- Nobile-Orazio E, et al: Inmunoglobulina intravenosa frente a metilprednisolona intravenosa para la polirradiculoneuropatía desmielinizante inflamatoria crónica: un ensayo controlado aleatorio. Lancet Neurol 2012; 11(6): 493-502.
- Kraus J, et al: Linfocitos CD45RA+ ICAM-3+ en líquido cefalorraquídeo y sangre como marcadores de la actividad de la enfermedad en pacientes con esclerosis múltiple. Acta Neurol Scand 2000; 102(5): 326-332.
- Cepok S, et al: Los patrones de patología del líquido cefalorraquídeo se correlacionan con la progresión de la enfermedad en la esclerosis múltiple. Cerebro 2001; 124(Pt 11): 2169-2176.
- Chen ES, Moller DR: Sarcoidosis: avances científicos y retos clínicos. Nat Rev Reumatol 2011; 7(8): 457-467.
- Iannuzzi MC, Rybicki BA, Teirstein AS: Sarcoidosis. N Engl J Med 2007; 357(21): 2153-2165.
- Bradshaw MJ, et al: Neurosarcoidosis: fisiopatología, diagnóstico y tratamiento. Neurol Neuroimmunol Neuroinflamm, 2021. 8(6).
- Seve P, et al: Sarcoidosis: Una visión clínica desde los síntomas hasta el diagnóstico, Células 2021; 10(4).
- Bharwani KD, et al: Niveles plasmáticos elevados de sIL-2R en el síndrome de dolor regional complejo: ¿un papel patogénico de los linfocitos T? Mediadores Inflamm 2017: 2764261.
- Cai B, et al.: Microinflamación caracterizada por la alteración del equilibrio Treg/Teff con aumento de sIL-2R en pacientes con diabetes tipo 2. Exp Clin Endocrinol Diabetes 2013; 121(4): 214-219.
- Spencer TS, et al: Manifestaciones clínicas y por resonancia magnética de la neurosarcoidosis. Semin Arthritis Rheum 2005; 34(4): 649-661.
- Pawate S, Moses H, Sriram S: Presentaciones y resultados de la neurosarcoidosis: un estudio de 54 casos. QJM 2009; 102(7): 449-460.
- Wegener S, et al: Neurosarcoidosis clínicamente aislada: una vía diagnóstica recomendada. Eur Neurol 2015; 73(1-2): 71-77.
- Jarius S, Wildemann B, Paul F: Neuromielitis óptica: características clínicas, inmunopatogenia y tratamiento. Clin Exp Immunol 2014; 176(2): 149-164.
- Dalmau J, Graus F: Encefalitis mediada por anticuerpos. N Engl J Med 2018; 378(9): 840-851.
- Dalmau J, et al: Una actualización sobre la encefalitis por receptores anti-NMDA para neurólogos y psiquiatras: mecanismos y modelos. Lancet Neurol 2019; 18(11): 1045-1057.
- Vishnevskia-Dai V, et al: Síndrome de Susac: características clínicas, clasificación clínica y pronóstico a largo plazo. Medicina (Baltimore), 2016; 95(43): e5223.
- Gross CC, et al: La endoteliopatía mediada por células T CD8(+) es un mecanismo abordable de neuroinflamación en el síndrome de Susac. Nat Commun 2019; 10(1): 5779.
- Toledano M, Weinshenker BG, Solomon AJ: Una aproximación clínica al diagnóstico diferencial de la esclerosis múltiple. Curr Neurol Neurosci Rep 2015; 15(8): 57.
- Fritz B: Sobre el diagnóstico serológico de la esquizofrenia a partir del líquido cefalorraquídeo según el método de Lehmann-Facius. 1939/12. 165: 462-467.
- van Kesteren CF, et al: Implicación inmunológica en la patogénesis de la esquizofrenia: un metaanálisis sobre estudios cerebrales postmortem. Transl Psychiatry 2017; 7(3): e1075.
- Mazza MG, et al: Cociente neutrófilo-linfocito, cociente monocito-linfocito y cociente plaqueta-linfocito en la psicosis no afectiva: Un metaanálisis y una revisión sistemática. World J Biol Psychiatry 2020; 21(5): 326-338.
- Fernandez-Egea E, et al: Poblaciones de células inmunitarias periféricas asociadas a déficits cognitivos y síntomas negativos de la esquizofrenia resistente al tratamiento. PLoS One 2016; 11(5): e0155631.
- Doorduin J, et al: Neuroinflamación en la psicosis relacionada con la esquizofrenia: un estudio PET. J Nucl Med 2009; 50(11): 1801-1807.
- Steiner J, et al: Células inmunitarias innatas y proteína C reactiva en el primer episodio agudo de psicosis y esquizofrenia: relación con la psicopatología y el tratamiento. Schizophr Bull 2020; 46(2): 363-373.
- Rauber S, et al.: La citometría de flujo del líquido cefalorraquídeo distingue los trastornos del espectro de la psicosis de los diagnósticos diferenciales. Mol Psychiatry 2021; 26(12): 7661-7670.
- Dalmau J, et al: Encefalitis por receptores anti-NMDA: serie de casos y análisis de los efectos de los anticuerpos. Lancet Neurol 2008; 7(12): 1091-1098.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2022; 20(3): 6-14