En el transcurso del congreso ASCO de este año, celebrado en Chicago a principios de junio, se presentaron nuevos resultados del ensayo de fase Ib sobre la combinación de la inhibición de PD1 y CTLA4. Son extremadamente prometedores. En el contexto adyuvante, el ipilimumab solo cumplió el criterio de valoración primario del supervivencia libre de recidiva.
Los nuevos datos del Estudio-004, un ensayo de fase I que investiga la seguridad, la actividad antitumoral y la farmacocinética de la combinación de la inhibición de PD1 (nivolumab) y CTLA4 (ipilimumab), ofrecen esperanzas a los pacientes con melanoma avanzado. Fueron presentados en el congreso de la ASCO de este año por el doctor Mario Sznol, de Yale: “Actualmente se están llevando a cabo otros dos estudios que prueban esta combinación en fases posteriores. Nuestros resultados justifican definitivamente tales esfuerzos de investigación”.
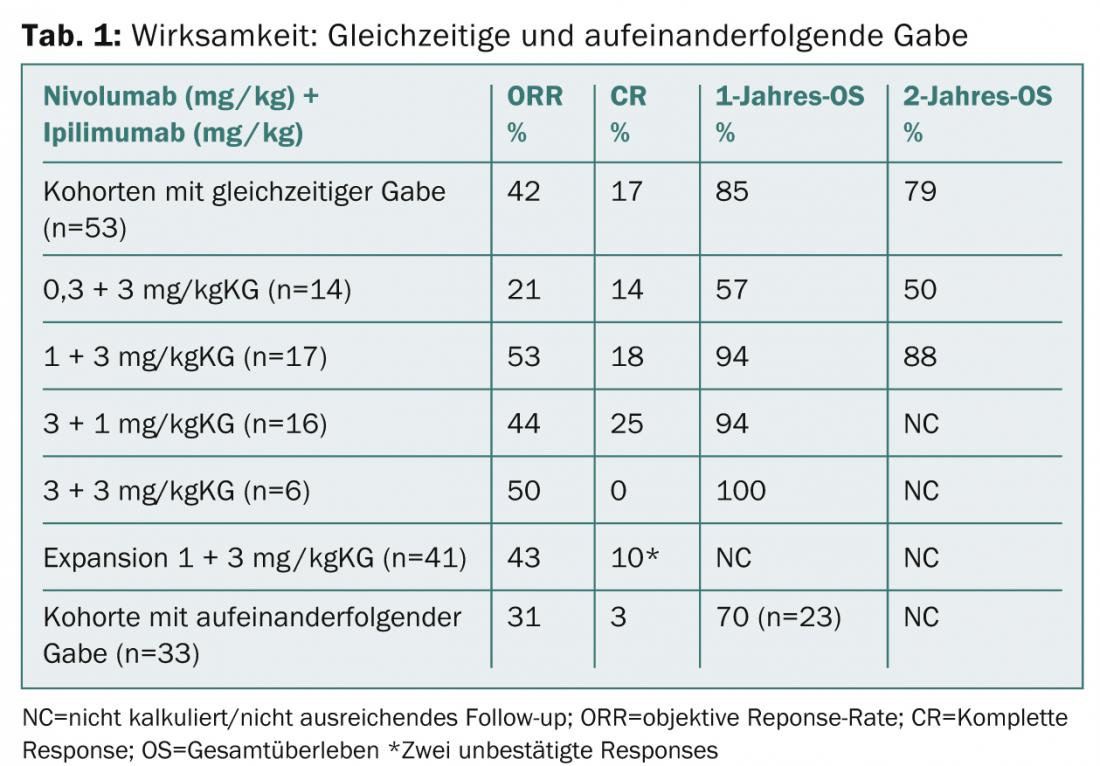
Las sustancias activas se administraron de forma simultánea o consecutiva (n=127). Se permitió que los pacientes hubieran tomado hasta tres terapias sistémicas antes de participar.
El grupo concurrente (nivolumab 1 mg/kgKG más ipilimumab 3 mg/kgKG [n=17]) logró una tasa de supervivencia global a 1 año del 94, y una tasa de supervivencia global a 2 años del 88%. En la cohorte ampliada, 41 pacientes recibieron el régimen anterior cada tres semanas durante cuatro dosis y después nivolumab solo a la dosis de 3 mg/kgKG cada quince días hasta la progresión. También se sigue investigando con estas dosis en los ensayos de fase II y III en curso (CheckMate-069 y -067).
La respuesta se observó independientemente del estado de la mutación BRAF o de la liberación de PD-L1.
No se encontraron nuevos problemas de seguridad en el seguimiento ampliado. Se produjeron acontecimientos adversos de grado 3-4 asociados al tratamiento en el 62% de los pacientes de las cohortes de administración conjunta. Los principales resultados de la actualización del estudio se presentan en la Tabla 1.
Ipilimumab en el contexto adyuvante
Un ensayo aleatorizado doble ciego de fase III también demostró que el ipilimumab a una dosis de 10 mg/kgKG mejora significativamente la supervivencia libre de recidiva (SSR, tiempo hasta la recidiva o la muerte) en comparación con el placebo, incluso en un estadio más temprano del melanoma. Los participantes fueron pacientes con melanoma (estadio III) y alto riesgo de recidiva tras una resección quirúrgica completa (entorno adyuvante). Éste es ya el tercer ensayo de fase III con resultados positivos para el ipilimumab en el tratamiento del melanoma.
“Aunque en el estadio III la probabilidad de recidiva es muy alta, existen muy pocas opciones de tratamiento que ayuden a reducir el riesgo de metástasis tras la cirugía”, afirmó el Dr. Alexander Eggermont, de Villejuif, que presentó los resultados en la ASCO.
El estudio observó una reducción del 25% en el riesgo de recurrencia o mortalidad (HR=0,75; IC 95%=0,64-0,90; p=0,0013). Al cabo de tres años, el 46,5% de los pacientes con ipilimumab y el 34,8% del grupo placebo estaban libres de recaídas. La mediana de la SSR fue de 26,1 resp. 17,1 meses.
Los efectos secundarios fueron en gran medida comparables a los del ipilimumab en el tratamiento del melanoma avanzado. En su mayoría estaban relacionados con la inmunidad y eran bien tratables dentro de los protocolos de gestión de este agente. Se observó una mayor incidencia de endocrinopatías. El 48,8% interrumpió el tratamiento con ipilimumab debido a efectos secundarios (frente al 1,7% con placebo). Cinco muertes estuvieron relacionadas con el verum.
Según el Prof. Eggermont, los resultados son relevantes, por un lado, porque el ipilimumab es el primer inhibidor de los puntos de control inmunitarios que muestra una mejora en este tipo de tratamiento y, por otro, porque el beneficio pudo observarse en todos los subgrupos, incluidos los de mayor riesgo de recaída. Por lo tanto, es razonable suponer que el ipilimumab podría utilizarse ampliamente en diferentes líneas terapéuticas y estadios de la enfermedad en el futuro. Actualmente se están llevando a cabo otros estudios que investigan la sustancia activa en el contexto adyuvante. Mientras tanto, el ipilimumab está aprobado a una dosis de 3 mg/kgKG para el tratamiento del melanoma avanzado (no resecable o metastásico) en adultos que hayan recibido una terapia previa.
Fuente: 50
th
Reunión anual de la Sociedad Americana de Oncología Clínica (ASCO), del 30 de mayo al 3 de junio de 2014, Chicago
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(5): 20-21
ESPECIAL CONGRESO 2014; 30-32










