Su heterogeneidad ha llevado a considerar el asma como un término paraguas más que como una enfermedad por derecho propio. Abarca varios aspectos y características que pueden solaparse, lo que dificulta el tratamiento del asma y exige un fenotipado preciso. Pero tenga cuidado: una vez que se ha diagnosticado un fenotipo, éste no queda necesariamente grabado en piedra: puede cambiar a lo largo de la vida.
Hoy en día, se hace una distinción básica basada en el grado de inflamación de tipo 2 y se diferencia entre asma T2-alto y T2-bajo. El Prof. Dr. Fabio L.M. Ricciardolo, del Departamento de Asma Grave y Enfermedades Pulmonares Raras del Hospital Universitario San Luigi Gonzaga de Turín, y sus colegas [1] escriben que hay varios fenotipos subordinados a cada una de estas dos formas.
La clasificación de los fenotipos de asma en T2-alta y T2-baja se basa actualmente en la predisposición atópica y en al menos uno de los biomarcadores inmunoglobulina E (IgE) sérica elevada, niveles elevados de óxido nítrico exhalado fraccionado (FeNO) y eosinofilia en sangre (B-EOS) y/o esputo (S-EOS).
Asma T2-alta
Los fenotipos T2-altos tienen una respuesta inmune-inflamatoria común impulsada por los linfocitos Th2 (inmunidad adaptativa) y las ILC (células linfoides innatas) del grupo 2 (ILC2, inmunidad innata). Las señas de identidad de la inflamación T2 son las citocinas T2 como la IL-5, IL-4, IL-13, IL-9, la prostaglandina D2 (PGD2) y los eosinófilos, cuya elevada expresión puede detectarse en las vías respiratorias (lumen o pared bronquial) y en la sangre periférica de los pacientes. De hecho, el término asma eosinofílica es sinónimo de asma T2-alta, incluye tanto fenotipos alérgicos como no alérgicos y afecta a cerca del 50% de los pacientes con asma grave.
El asma alérgica se desarrolla tras la exposición a diversos aeroalérgenos que provocan la activación de las células dendríticas (CD). Las DC de la capa subepitelial actúan como células presentadoras de antígenos y pueden reconocer y procesar los alérgenos. En cuanto se activan, se produce la llamada fase temprana y luego tardía de la reacción alérgica.
Además de la inflamación de las vías respiratorias, el asma T2-alto se acompaña de cambios estructurales en las vías respiratorias (remodelación). Estos cambios incluyen la metaplasia de las células caliciformes, que conduce a una mayor producción de moco y a la consiguiente formación de tapones mucosos. Un estudio reciente demostró que las vías respiratorias de los pacientes con asma grave e inflamación T2 tienen una mayor presencia de tapones de moco, y que los eosinófilos desempeñan un papel clave en la formación de tapones.
Asma alérgica de aparición temprana
Los desencadenantes y síntomas típicos del asma infantil son los alérgenos y otros estímulos ambientales como las infecciones víricas, los contaminantes, los agentes oxidantes y el humo del tabaco. Provocan una cascada inmunitaria e inflamatoria, responsable de la broncoconstricción aguda. Este asma de aparición precoz (AAP) suele caracterizarse por la atopia con presencia de IgE alérgeno-específica circulante y se caracteriza por la llamada “marcha atópica”, que es una progresión de la dermatitis atópica a la rinitis alérgica y el asma.
El EOA puede durar toda la vida. Los estudios que analizan los factores determinantes de esta persistencia señalan el tabaquismo materno durante el embarazo, las infecciones de las vías respiratorias superiores e inferiores, la atopia, las sibilancias causadas por infecciones por rinovirus y la eosinofilia sanguínea en la primera infancia como factores de riesgo de una menor función pulmonar, asma y asma grave en la infancia en edad escolar, la adolescencia y la juventud.
Asma no alérgica de aparición tardía
El asma no alérgica comienza en la edad adulta y puede definirse como asma de aparición tardía (AAT). Al igual que el asma alérgica, la LOA también se caracteriza por una marcada firma inmunitaria e inflamatoria T2 y se caracteriza por la ausencia de atopia y de la señalización IgE resultante.
La LOA puede manifestarse en diferentes grados de gravedad, y la forma grave conlleva una peor función pulmonar, una obstrucción más grave de las vías respiratorias y un aumento de la eosinofilia a pesar del tratamiento con dosis elevadas de corticosteroides inhalados (CSI), escriben los autores. Se han encontrado concentraciones elevadas de ILC2 en las vías respiratorias y la sangre periférica de pacientes con asma grave no alérgica caracterizada por eosinofilia incontrolada en el esputo y resistencia a los esteroides, lo que indica un mecanismo en el que posiblemente esté implicada la IL-33.
Asma analgésico
La enfermedad respiratoria exacerbada por la aspirina (EREA) se produce en estrecha asociación con síntomas respiratorios que se desarrollan rápidamente tras la toma de analgésicos como el ácido acetilsalicílico o un inhibidor no esteroide de la ciclooxigenasa-1 (COX-1). Las reacciones a los AINE, el asma y los pólipos nasales son características del síndrome (tríada de Samter). Tanto en adultos como en niños, el asma alérgica o la rinitis alérgica pueden manifestarse antes que la hipersensibilidad a los analgésicos, pero la AERD no se considera una enfermedad alérgica ya que no produce anticuerpos IgE específicos. Alrededor del 8-26% de los pacientes con RSC y pólipos nasales padecen al mismo tiempo ERRA, mientras que la prevalencia es de aproximadamente el 7% en todos los pacientes asmáticos y el doble en los pacientes con asma grave.
T2-asma baja
El asma T2-bajo incluye todas las formas de asma sin los rasgos característicos del asma T2-alto. Basándose en el perfil inflamatorio de las vías respiratorias, se distingue entre asma neutrofílica (neutrofilia del esputo con baja eosinofilia), mixta (alta neutrofilia y eosinofilia del esputo) y paucigranulocítica (baja neutrofilia y eosinofilia del esputo). El asma de bajo T2 puede variar en gravedad, y los fenotipos mixto y neutrofílico tienden a presentar una mayor gravedad y tasas de exacerbación. En la actualidad no existen moléculas validadas como biomarcadores, aunque los estudios con muestras de sangre/vías respiratorias de pacientes asmáticos muestran resultados alentadores, según el profesor Ricciardolo y sus colegas.
Entre las causas de la inflamación neutrofílica de las vías respiratorias se encuentran las infecciones bacterianas y víricas, siendo estas últimas la causa de las exacerbaciones del asma. Se observó una mayor frecuencia de exacerbaciones y una mayor incidencia de RSC e infecciones víricas en los pacientes con inflamación neutrofílica.
En los pacientes asmáticos expuestos a dosis elevadas de CSI y/o a un tratamiento prolongado con corticosteroides orales (CSO), el uso de corticosteroides puede conducir a un fenotipo no eosinofílico. Sin embargo, los estudios han descubierto que los pacientes con un fenotipo molecular, incluidos los pacientes con asma eosinofílica grave, tenían más probabilidades de tomar CSO que los pacientes con un fenotipo molecular neutrófilo. Además, varios estudios de biopsia bronquial mostraron un estado de neutrófilos reducido o estable tras el tratamiento con corticosteroides.
Asma del fumador
El humo del tabaco puede desencadenar procesos patogenéticos y dar lugar a un fenotipo asociado a una serie de características: deterioro acelerado de la función pulmonar, mal control del asma, exacerbaciones más frecuentes, menor calidad de vida, mayores tasas de hospitalización y un mayor riesgo de comorbilidades como el cáncer. Se ha informado de que el asma en los fumadores está asociada a una inflamación T2 baja.
La resistencia a los esteroides asociada al tabaquismo y la exclusión de los fumadores con asma de la mayoría de los ensayos clínicos plantean un reto importante en el tratamiento de este fenotipo.
Asma inducida por la obesidad
El asma inducida por la obesidad suele presentar una forma grave en la que los pacientes suelen ser resistentes a los esteroides. Los cambios en las características clínicas y funcionales, como la hiperreactividad de las vías respiratorias (IAV), pueden mejorar con la pérdida de peso. La obesidad es una condición patológica caracterizada por una inflamación sistémica en la que participan los macrófagos. Se cree que los macrófagos son los responsables de la inflamación del tejido adiposo, que conduce a la liberación de TNF-α, leptina e IL-6 en el torrente sanguíneo. El 62% de los pacientes asmáticos obesos presentan niveles plasmáticos bajos de IL-6. Un estudio demostró que los niveles elevados de IL-6 se asociaban con asma grave y trastornos metabólicos tanto en pacientes obesos como no obesos.
Asma en personas mayores
El asma relacionada con la edad se presenta cuando la enfermedad aparece por primera vez después de los 65 años. Estos pacientes tienen una tasa de morbilidad y mortalidad más elevada. Hay muchas razones para ello, como las comorbilidades, el conocimiento inadecuado de los síntomas del asma, el posible deterioro cognitivo y los efectos adversos de la polifarmacoterapia. Los procesos de envejecimiento que modifican la estructura y la fisiología de los pulmones también influyen en el asma y en su desarrollo. Los cambios relacionados con la edad incluyen un estrechamiento de las vías respiratorias periféricas, dilatación alveolar, aumento de la rigidez de la pared torácica, disminución de la fuerza de los músculos respiratorios y reducción de la función pulmonar. La fisiopatología exacta de este fenotipo no está clara, lo que dificulta mucho su tratamiento, escriben los autores. Se necesitan más estudios para aclarar la posible conexión con la resistencia a los corticosteroides en pacientes asmáticos de edad avanzada.
Asma posmenopáusica
Una mayor proporción de varones se ven afectados por el asma en la infancia. Esto cambia en la edad adulta, donde la proporción de mujeres es mayor. Además de los factores genéticos, este desarrollo también se atribuye a las hormonas: Las altas concentraciones de estrógenos y progesterona pueden modular la expresión y la actividad de las células inmunitarias, las citoquinas inflamatorias y los glucocorticoides, lo que conduce a la inducción de una reacción Th2 con eosinófilos y un aumento del FeNO en la fase premenstrual. Es probable que esto contribuya a la gravedad y el empeoramiento de los síntomas del asma, las exacerbaciones y la hospitalización durante la menstruación, la perimenopausia y el embarazo.
Los estudios sobre el asma menopáusica han demostrado un mayor riesgo de asma en las mujeres delgadas que toman terapia hormonal sustitutiva, así como una reducción de la función pulmonar y un aumento de los síntomas del asma en las mujeres posmenopáusicas en comparación con las pacientes premenopáusicas. Es necesario seguir investigando los mecanismos internos del asma posmenopáusica.
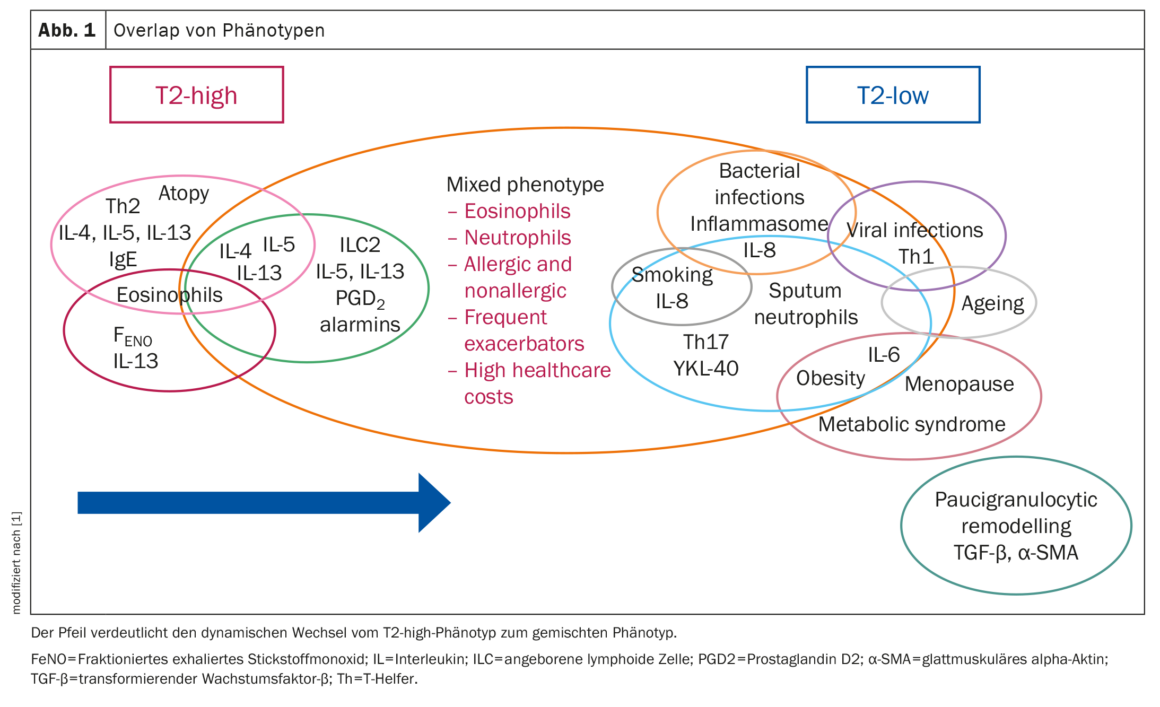
Superposición de los fenotipos
Identificar el fenotipo del asma es crucial para el tratamiento de la enfermedad, explican el Prof. Ricciardolo et al. Sin embargo, múltiples vías de señalización molecular pueden estar entrelazadas y solaparse entre diferentes fenotipos, lo que puede dar lugar a resultados clínicos inesperados. Varios estudios han aportado pruebas de una interacción entre vías que antes se consideraban mutuamente excluyentes (Fig. 1).
En un estudio, se observó solapamiento en >70% de los pacientes, con combinaciones de fenotipos relacionados con la inflamación T2, no relacionados con T2 y mixtos T2/no relacionados con T2, siendo el último grupo el que tuvo los peores resultados clínicos. Se detectaron solapamientos del fenotipo T2 en varias combinaciones de subtipos alérgico, eosinofílico y T2-alto. El fenotipo alérgico fue el fenotipo único más común, pero también el que con más frecuencia se presentó simultáneamente con otros fenotipos. La EOA y las alergias persistentes se asociaron con el mayor riesgo de desarrollar EPOC, mientras que la LOA y las alergias se asociaron con un mayor riesgo de multimorbilidad, incluida la diabetes, la obesidad y las enfermedades cardiovasculares.
El asma y las comorbilidades relacionadas pueden tener mecanismos moleculares comunes, exposiciones comunes o predisposiciones genéticas comunes, según la hipótesis de los autores. Así pues, las comorbilidades (EPOC, ERGE, enfermedad cardiovascular), que suelen asociarse a una firma de inflamación T2 baja, también pueden desarrollarse en pacientes con un estado T2 inicialmente alto.
Los cambios y la posible evolución a un fenotipo diferente pueden dar lugar a un mal control clínico, insensibilidad a los esteroides y empeoramiento de la gravedad. Por tanto, los investigadores concluyen que, al definir el fenotipo del asma basándose en los biomarcadores actuales, los médicos deben ser más cautos y buscar también solapamientos entre los distintos fenotipos, especialmente en los pacientes asmáticos insensibles a los esteroides y difíciles de tratar.
Literatura:
- Ricciardolo FLM, Guida G, Bertolini F, et al: Superposición de fenotipos en la historia natural del asma. European Respiratory Review 2023; 32: 220201; doi: 10.1183/16000617.0201-2022.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2024; 6(1): 36-38