El microbioma cutáneo es el término utilizado para describir la totalidad de todos los microorganismos de nuestra piel. El microbioma de la piel sana se caracteriza por una gran diversidad de especies diferentes de bacterias, hongos y virus. La composición del microbioma cutáneo difiere significativamente entre las distintas regiones de la piel de una persona. El microbioma cutáneo desempeña probablemente un papel importante en el desarrollo y la progresión de las enfermedades inflamatorias de la piel, como la dermatitis atópica.
El cuerpo humano sano es un ecosistema poblado por diversos microorganismos. Las estimaciones actuales sugieren que estamos formados por aproximadamente el mismo número de células bacterianas que de células humanas. El conjunto de estos microorganismos en nuestro cuerpo se denomina microbioma. En función del sistema orgánico observado, se distingue, por ejemplo, entre el microbioma intestinal y el microbioma vaginal, el microbioma respiratorio o el microbioma cutáneo. En el siguiente artículo, nos gustaría analizar el microbioma de la piel y su importancia para el desarrollo de enfermedades cutáneas. Al fin y al cabo, la piel es nuestro órgano más grande y constituye una importante interfaz con nuestro entorno.
Los nuevos métodos analíticos han permitido investigar el microbioma de la piel
La investigación sobre el microbioma de la piel ha cobrado cada vez más importancia en los últimos años. La investigación del complejo microbioma cutáneo ha sido posible gracias a la amplia disponibilidad de nuevos métodos de análisis biológico molecular. Ante todo, cabe mencionar aquí la secuenciación de nueva generación (NGS). Sólo desde la introducción de la NGS se puede analizar todo el ADN de una muestra de piel y asignarlo taxonómicamente a distintos géneros y especies. Esto permitió presentar por primera vez el panorama real y complejo del microbioma cutáneo. Se trata de una ventaja decisiva frente a métodos convencionales como el cultivo, con el que sólo se pueden cultivar microorganismos seleccionados y, sobre todo, fácilmente cultivables, como la bacteria Staphylococcus aureus e investigarlos. Un grupo de trabajo del Instituto Nacional de Salud de EE.UU. en Bethesda, MD, lideró la introducción de la NGS en la investigación del microbioma cutáneo. Este grupo de trabajo consiguió por primera vez mostrar todo el espectro de bacterias y hongos como en un mapa de la piel. En cuanto al microbioma bacteriano de la piel, se ha demostrado que las regiones seborreicas del cuerpo están dominadas por propionibacterias, mientras que las corinebacterias predominan en las regiones intertriginosas y las proteobacterias en las zonas secas de la piel [1]. Entre los hongos, la levadura Malassezia spp. domina en la mayoría de las localizaciones corporales examinadas, aunque la composición de las especies individuales de Malassezia varía mucho entre las distintas localizaciones corporales [2].
El microbioma de la piel es diverso y específico de cada región
Según los resultados de las investigaciones realizadas hasta la fecha, el microbioma de una piel sana puede definirse según dos principios. En primer lugar, el microbioma de la piel sana se caracteriza por una diversidad particular de especies microbianas diferentes. Por el contrario, se puede medir una diversidad limitada del microbioma cutáneo en enfermedades de la piel como el eccema atópico. Así, durante las recaídas del eccema atópico, S. aureus prolifera en las zonas cutáneas afectadas y desplaza a otras especies bacterianas. Sin embargo, aún no está claro si esta proliferación de S. aureus es la causa o más bien la consecuencia del brote de eccema [3]. Cuando el eccema se cura, la diversidad del microbioma cutáneo vuelve a ser la de una piel sana. Como segundo principio de una piel sana, se ha demostrado que la composición del microbioma cutáneo es típica para cada región de la piel de un individuo. Así, el microbioma de la piel del pliegue del codo está dominado por microorganismos diferentes a los de la mejilla. Curiosamente, estas diferencias entre regiones cutáneas individuales son mucho más pronunciadas que las diferencias de una región cutánea concreta entre dos individuos. En resumen, el microbioma cutáneo de su codo es mucho más similar al microbioma cutáneo de mi codo que al microbioma cutáneo de su propia mejilla. Sólo existen especulaciones sobre los factores que influyen en la composición del microbioma de determinadas zonas de la piel. El pH cutáneo, el contenido lipídico de la piel o la temperatura de la superficie podrían influir. No lo sabemos con exactitud.
El microbioma de la piel es importante para el desarrollo de enfermedades cutáneas
Por lo que sabemos hasta ahora, el microbioma cutáneo es esencial para la homeostasis de nuestra piel. La colonización de nuestra piel con comensales, es decir, microorganismos beneficiosos, parece proteger contra la colonización de la piel con microorganismos patógenos. Esto puede explicarse, al menos en parte, por la producción de péptidos antimicrobianos por parte de bacterias comensales como el Streptococcus epidermidis. Estos péptidos antimicrobianos son eficaces contra bacterias patógenas como el S. aureus e impiden su crecimiento. Se está estudiando intensamente el papel del microbioma cutáneo en el desarrollo y la progresión de las enfermedades inflamatorias de la piel. Como ejemplo, la levadura Malassezia spp. merece una discusión detallada porque no sólo es el hongo más común en la piel sana, sino que también se asocia a diversas enfermedades cutáneas. Desafía así el paradigma clásico del microbioma de microorganismos comensales frente a patógenos.
La levadura Malassezia spp. desempeña un papel en la dermatitis atópica
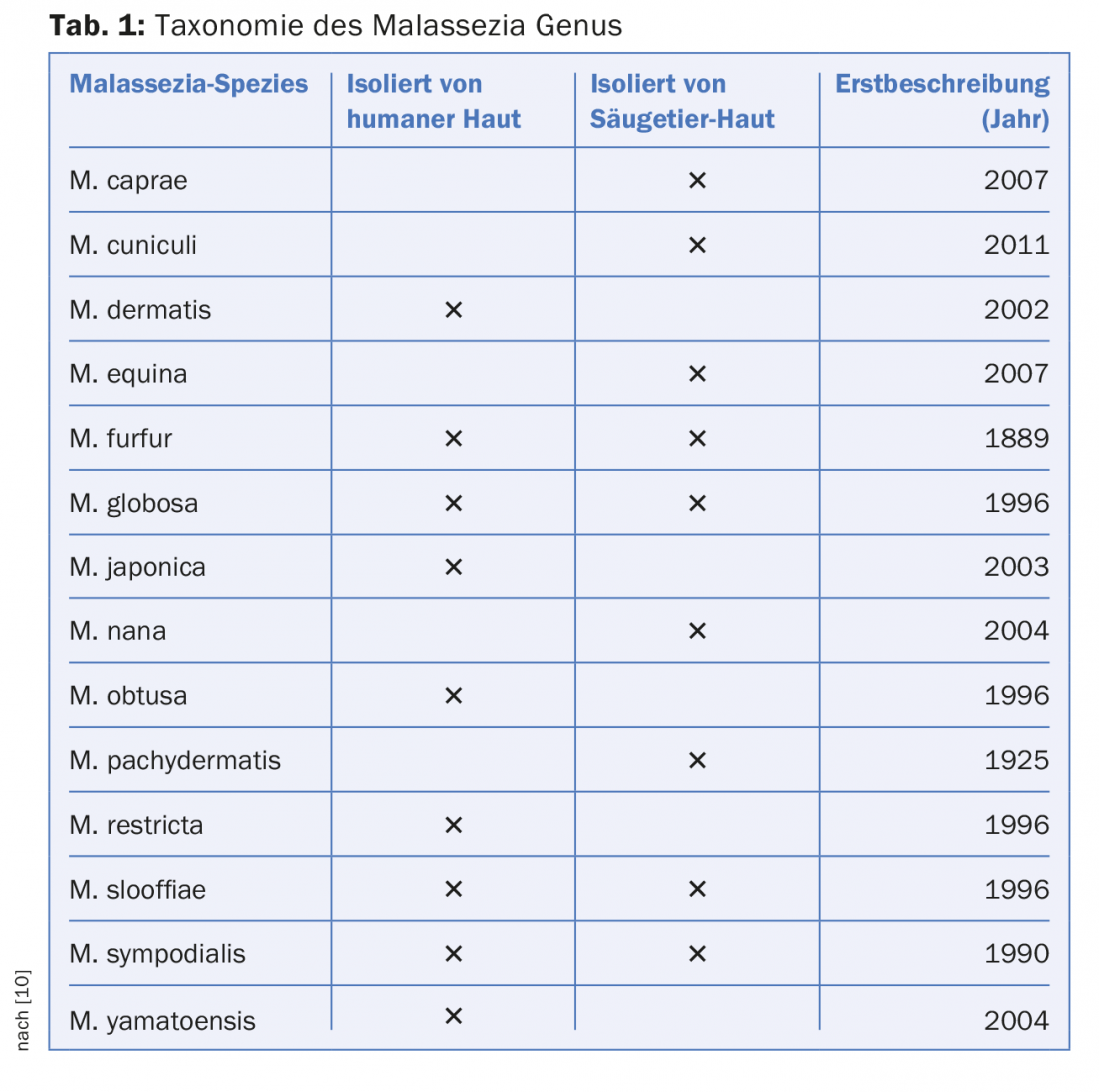
La levadura Malassezia spp. forma parte del microbioma de la piel sana de humanos y mamíferos [4]. El género comprende actualmente 14 especies, nueve de las cuales se encuentran con frecuencia en la piel humana (Tab. 1). Estas especies de Malassezia carecen de enzimas propias para la síntesis de lípidos importantes, razón por la que Malassezia spp. se encuentran en especial densidad en zonas cutáneas seborreicas como la cabeza, el cuello y la parte superior del tronco. Así, aunque Malassezia spp. es un comensal clásico, parece estar asociado a enfermedades cutáneas comunes; por ejemplo, la pitiriasis versicolor, el eccema seborreico y la dermatitis atópica. A continuación, se examinará con más detalle el papel de Malassezia spp. en la dermatitis atópica (DA).
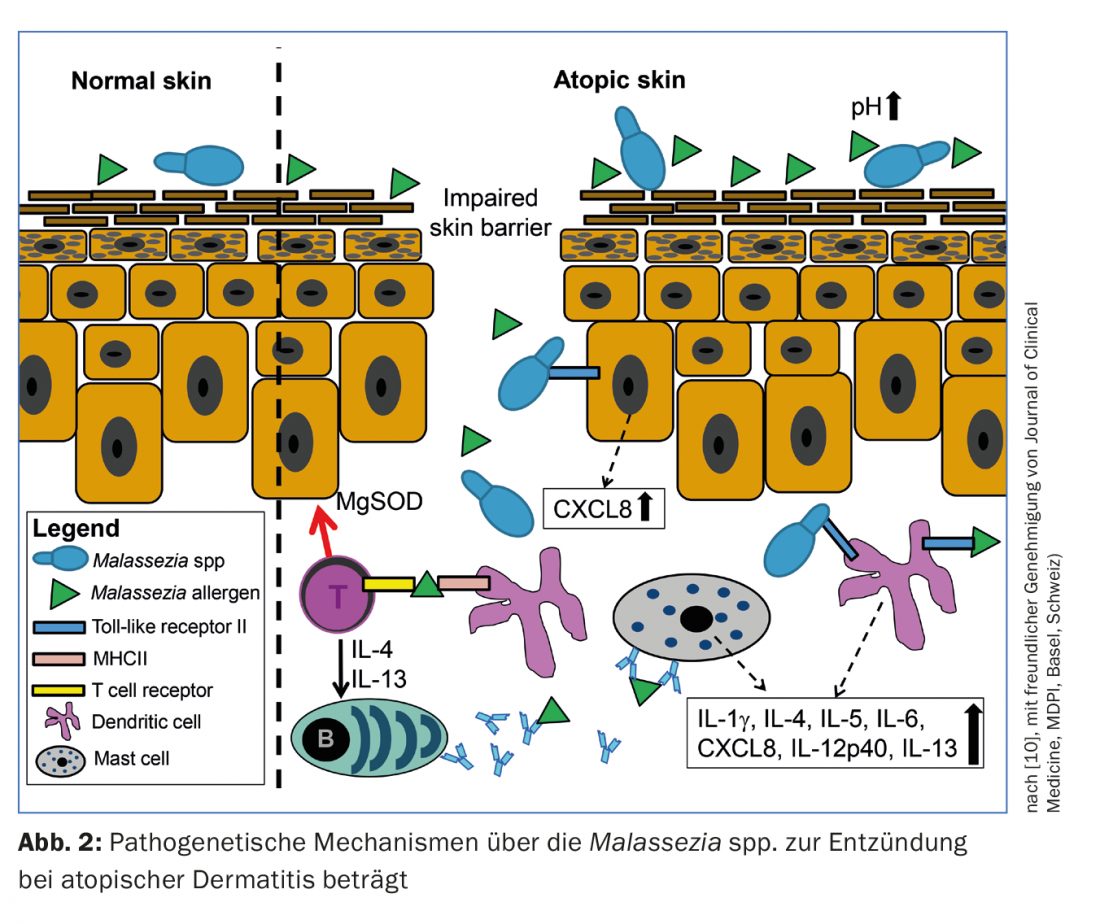
La DA es una enfermedad inflamatoria crónica de la piel caracterizada por un eccema recurrente con picor intenso [5]. La prevalencia de la EA en los países desarrollados se ha triplicado en los últimos 30 años. Afecta al 15-30% de los niños y hasta al 10% de los adultos. A pesar de su importancia epidemiológica y económico-sanitaria, la patogénesis de la EA aún no se conoce por completo. En cualquier caso, la piel de los pacientes con EA se caracteriza por una función de barrera alterada y un sistema inmunitario alterado en comparación con la piel sana [5]. Estos dos factores parecen influir en el microbioma de la piel. De hecho, estudios anteriores han respaldado el papel patogénico de la Malassezia spp., que de otro modo sería comensal, en la EA. Resulta sorprendente que más del 50% de todos los pacientes adultos con EA estén sensibilizados a Malassezia spp. Así que o bien muestran una prueba de punción cutánea positiva o tienen anticuerpos IgE específicos de Malassezia spp. en el suero. En comparación, las pieles sanas no suelen estar sensibilizadas a Malassezia spp. aunque también están colonizadas regularmente por este comensal [6]. Además, el título sérico de anticuerpos IgE específicos de Malassezia spp. se correlaciona con la gravedad del eccema atópico en adultos [7]. Los mecanismos patogenéticos que subyacen a esta sensibilización han sido dilucidados, al menos parcialmente.
La sensibilización se produce a través de las proteínas inmunógenas (o alérgenos) de las levaduras, que penetran a través de la barrera cutánea, que suele estar deteriorada en la EA, hasta las capas más profundas de la piel, como la epidermis inferior y la dermis, donde son reconocidas por las células dendríticas. Este reconocimiento conduce a la activación de los linfocitos T y B y, finalmente, a la producción de anticuerpos IgE específicos de Malassezia spp.
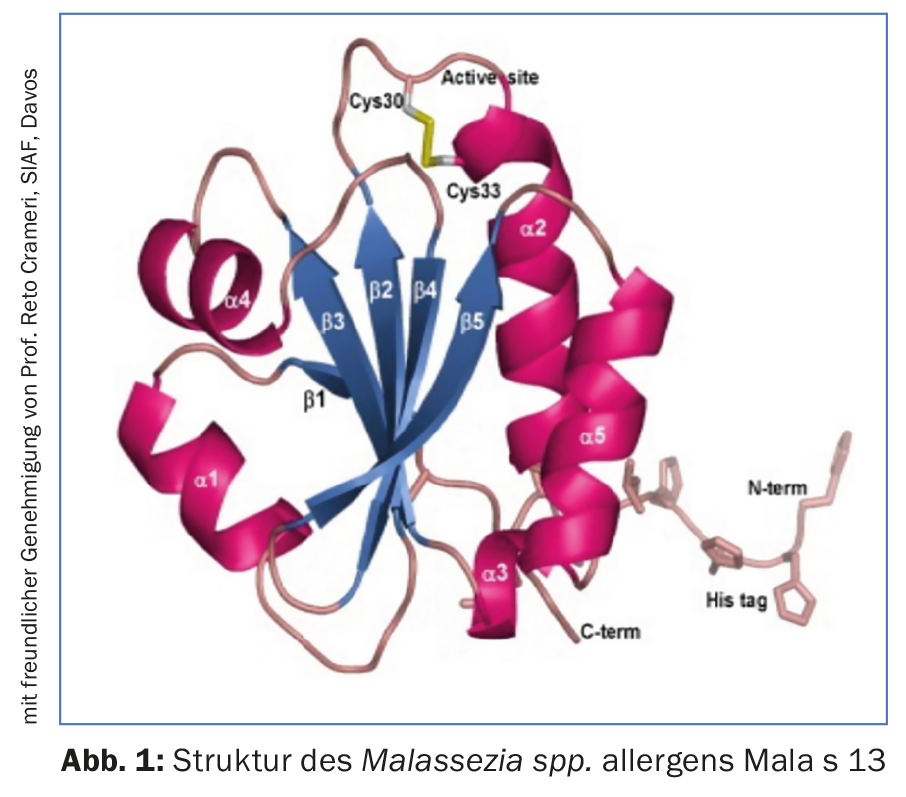
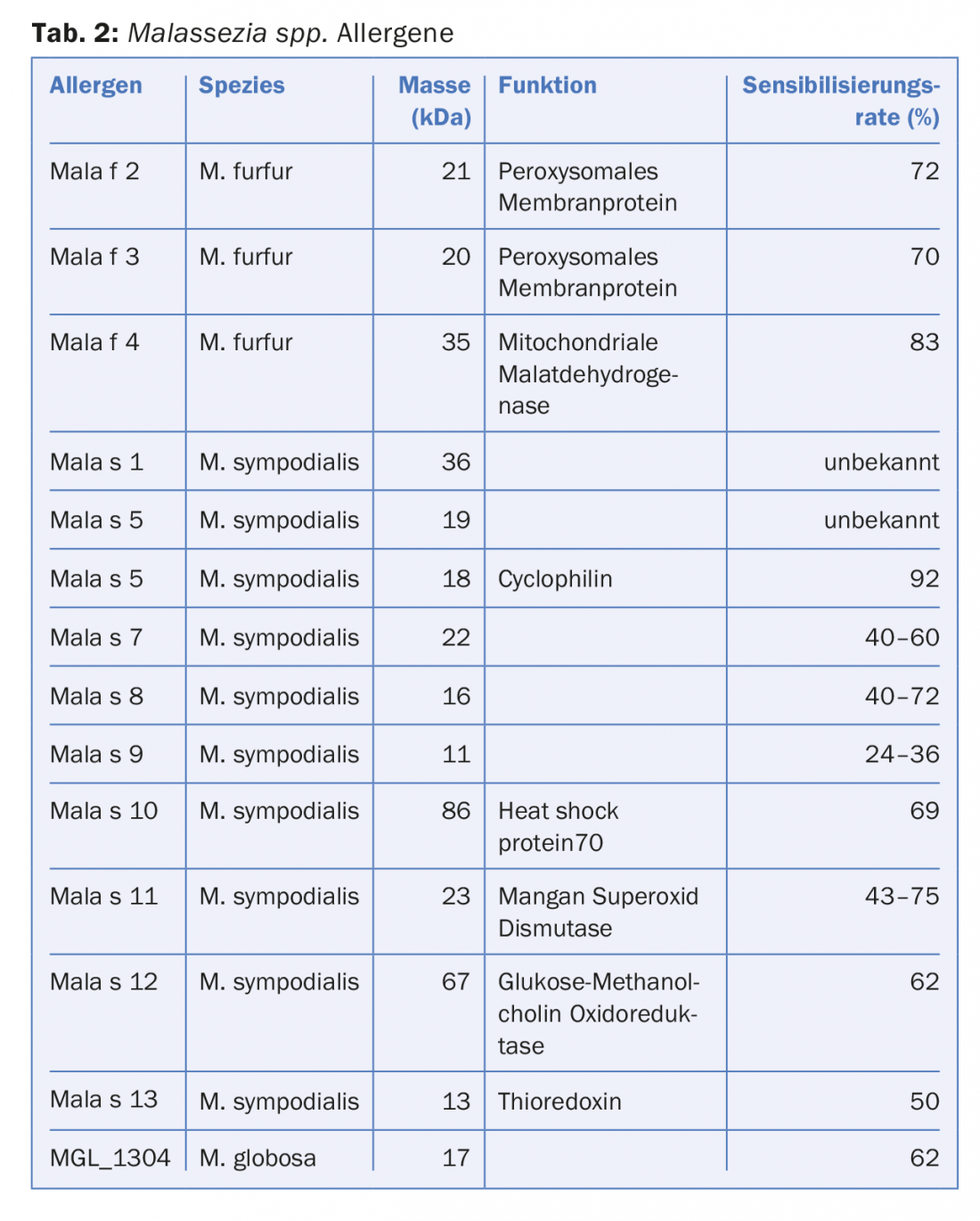
Hasta ahora, 14 alérgenos han sido identificados por Malassezia spp. identificados que inician dicha producción de anticuerpos IgE (Fig. 1, Tab. 2). Hace algún tiempo se pudo demostrar que Malassezia spp. producen y secretan más alérgenos en un entorno de pH casi neutro, como el característico de la piel de los pacientes con EA, que en un pH ácido correspondiente a la piel sana [8]. Sin embargo, algunos alérgenos no sólo provocan la producción de IgE, sino que pueden causar directamente eccemas en la piel. Por ejemplo, el alérgeno Mala s 11, una superóxido dismutasa de manganeso de la especie Malassezia sympodialis, tiene una secuencia de aminoácidos homóloga en un 50% con la superóxido dismutasa de manganeso humana de los queratinocitos de la piel [9]. Por lo tanto, la sensibilización al Mala s 11 puede inducir linfocitos T autoreactivos dirigidos tanto contra la enzima fúngica como contra la enzima humana muy similar en los queratinocitos. Los ensayos clínicos han demostrado que la aplicación de Mala s 11 en la piel de pacientes con EA probablemente provoque eccema a través de este mecanismo mediado por las células T.
Se han descrito otros mecanismos por los que Malassezia spp. contribuye a la formación del eccema, como la activación de los receptores tipo Toll y la posterior liberación de mediadores proinflamatorios por las células dendríticas o los queratinocitos [10]. En la figura 2 se resumen otros posibles mecanismos por los que Malassezia spp. contribuye a la inflamación en la EA.
Importancia para la práctica
La detección de la sensibilización a Malassezia spp. puede ser útil a la hora de considerar una terapia antifúngica para la EA. Existen al menos dos kits de pruebas comerciales y estandarizados para medir los anticuerpos IgE específicos de Malassezia spp: ImmunoCAP® m70 o ImmunoCAP® m227, Thermo Scientific, www.phadia.com). La prueba m227, a diferencia de la m70, se basa en diferentes especies de Malassezia y, por lo tanto, parece tener una mayor sensibilidad. Puede ser apropiado probar la terapia antifúngica sistémica con antifúngicos azólicos en aquellos pacientes con DA que estén sensibilizados a Malassezia spp. Las opciones de terapia sistémica para la EA en particular son muy limitadas, ya que la ciclosporina es el único fármaco aprobado en muchos países para la terapia sistémica de la EA. Además del efecto antifúngico propiamente dicho, los antifúngicos azólicos inhiben la liberación de las interleucinas proinflamatorias IL-4 e IL-5 por los Lzmphocytes. La IL-4 y la IL-5, en particular, desempeñan un papel patogénico importante en la EA.
Literatura:
- Grice EA, et al.: Diversidad topográfica y temporal del microbioma de la piel humana. Science 2009; 324(5931): 1190-1192.
- Findley K, et al.: Diversidad topográfica de las comunidades fúngicas y bacterianas en la piel humana. Nature 2013; 498(7454): 367-370.
- Kong HH, et al: Cambios temporales en el microbioma cutáneo asociados a los brotes de la enfermedad y al tratamiento en niños con dermatitis atópica. Genome Res 2012; 22(5): 850-859.
- Gaitanis G, Magiatis P, Hantschke M, Bassukas ID, Velegraki A: El género Malassezia en las enfermedades cutáneas y sistémicas. Clin Microbiol Rev 2012; 25(1): 106-141.
- Bieber T: Dermatitis atópica. N Engl J Med 2008; 358(14): 1483-1494.
- Casagrande BF, et al: La sensibilización a la levadura Malassezia sympodialis es específica del eccema atópico extrínseco e intrínseco. J Invest Dermatol 2006; 126(11): 2414-2421.
- Glatz M, et al: El nivel de inmunoglobulina E específico de Malassezia spp. es un marcador de la gravedad de la dermatitis atópica en adultos. Acta Derm Venereol 2015b; 95(2): 191-196.
- Selander C, Zargari A, Mollby R, Rasool O, Scheynius A: Un nivel de pH más elevado, correspondiente al de la piel de pacientes con eccema atópico, estimula la liberación de alérgenos de Malassezia sympodialis. Alergia 2006; 61(8): 1002-1008.
- Vilhelmsson M, et al.: Análisis mutacional de los residuos de aminoácidos implicados en la unión de la IgE al alérgeno Mala s 11 de Malassezia sympodialis Mol Immunol 2008; 46(2): 294-303.
- Glatz M, Bosshard PP, Hoetzenecker W, Schmid-Grendelmeier P: El papel de Malassezia spp. en la dermatitis atópica. J Clin Med 2015a; 4(6): 1217-1228.
PRÁCTICA DERMATOLÓGICA 2016; 26(4): 5-8