La patogenia de la hidradenitis supurativa (HS) aún no se ha aclarado del todo; se supone que existen interacciones multifactoriales. Los factores de riesgo y las comorbilidades más importantes son el tabaquismo, la obesidad y el síndrome metabólico. Por lo general, se recomienda un enfoque de tratamiento multimodal. Además de las medidas no farmacológicas y los preparados tópicos, también se utilizan terapias sistémicas, intervenciones quirúrgicas y otras modalidades terapéuticas en función de la gravedad. Además del adalimumab, el secukinumab también está disponible como biológico en Suiza desde 2023.
La hidradenitis supurativa (HS), también conocida como “acné inverso”, es una enfermedad cutánea crónica, recurrente y mutilante del aparato terminal de las glándulas del folículo piloso caracterizada por lesiones nodulares inflamatorias dolorosas con abscesos y formación de fístulas en las zonas corporales portadoras de glándulas apocrinas (Fig. 1) [1,39,49]. Las zonas de predilección son las regiones axilar, inguinal y perianal [1]. Los datos sobre la prevalencia de la HS varían; en Europa Central se estima actualmente en torno al 1% [14]. La HS suele manifestarse por primera vez después de la pubertad y alcanza su punto máximo en torno a los 20-25 años de edad. Dependiendo del estudio, la proporción entre mujeres y hombres se da entre 1:2 y 1:5 [2,3].
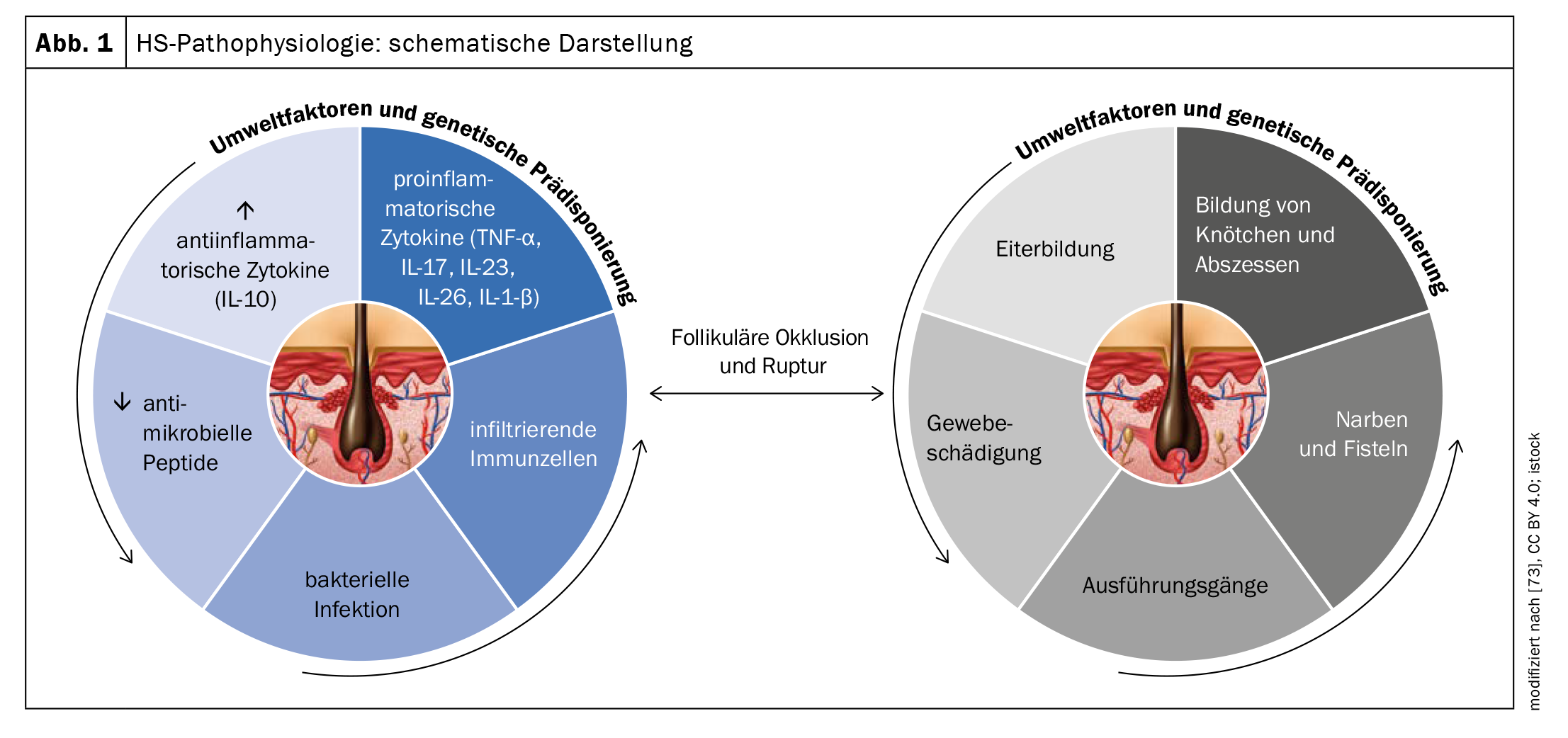
La patogénesis exacta de la HS aún no se conoce del todo, pero se supone que una combinación de factores genéticos, hormonales y ambientales contribuyen a su desarrollo (Fig. 1). El hecho de que el 35-40% tengan antecedentes familiares positivos sugiere una implicación genética. En cuanto al patomecanismo, los análisis de las biopsias indican que la HS se inicia debido a la oclusión del folículo piloso terminal en respuesta a la hiperqueratinización, lo que conduce a la formación de nódulos/quistes y, finalmente, a la ruptura del epitelio folicular [4–8]. Esto da lugar a una inflamación crónica con formación de senos y fístulas y extensas cicatrices dérmicas.
Características clínicas y diagnóstico
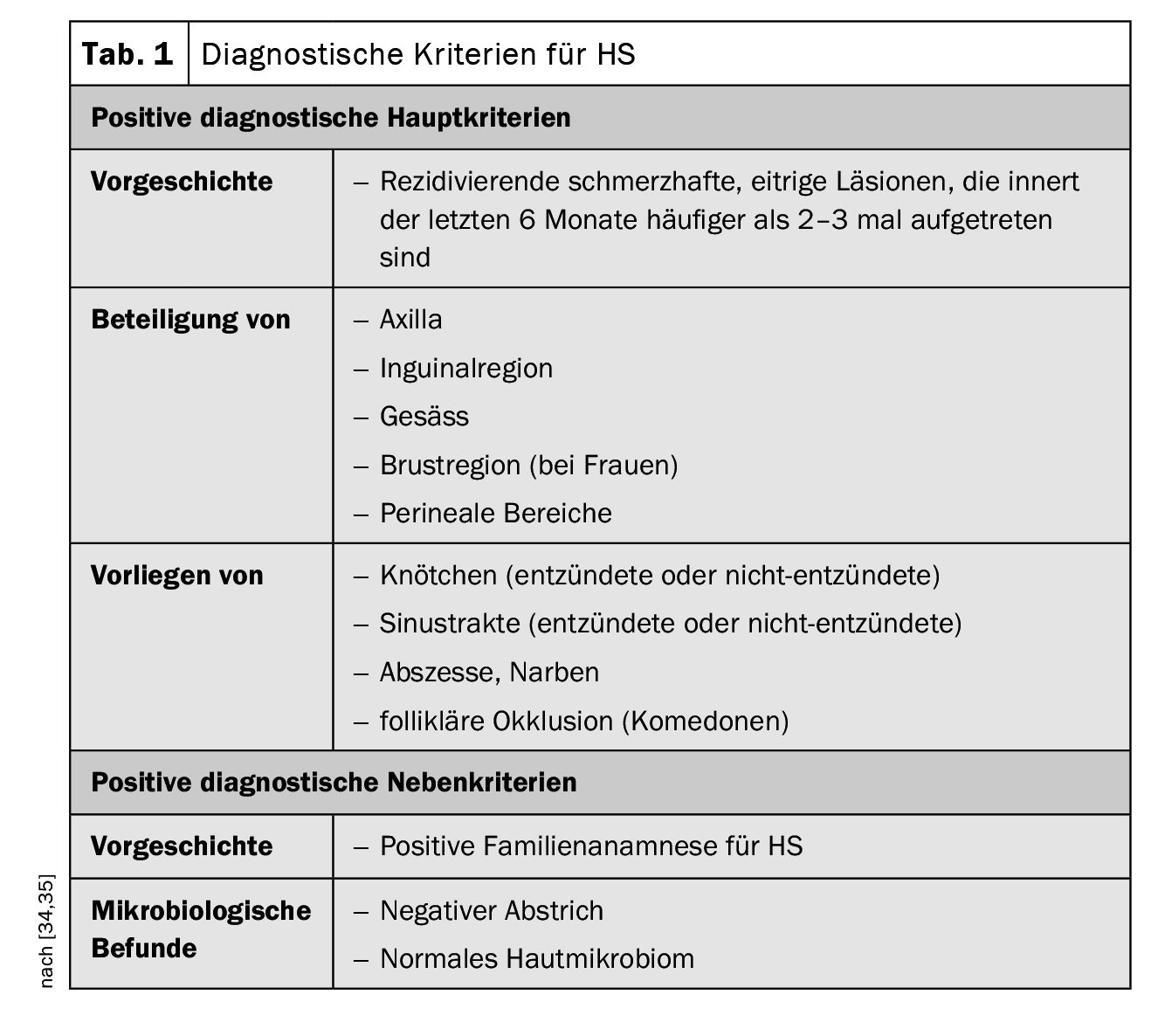
La presentación clínica de la HS se caracteriza por una inflamación recurrente que se ha producido más de dos o tres veces en los seis meses anteriores en forma de nódulos, tractos fistulosos y/o cicatrices, sobre todo en regiones de pliegues corporales [34,45]. La enfermedad se confunde a menudo con abscesos comunes o foliculitis en las primeras fases. En un estudio prospectivo, la latencia media hasta que se diagnosticó correctamente la HS fue de 7,2 a 8,7 años [35]. Si la HS no se diagnostica y trata adecuadamente a tiempo, el proceso inflamatorio puede progresar, provocando con el tiempo la destrucción de los tejidos. [47]. Pero los síntomas también pueden tener graves consecuencias psicosociales. Las infecciones bacterianas, la formación de fístulas y las contracturas pueden restringir la movilidad y son muy estresantes para los pacientes, como demuestran los estudios empíricos sobre calidad de vida (Recuadro) [9]. El examen clínico es fundamental en el diagnóstico de la HS. Las biopsias cutáneas no suelen ser necesarias, pero pueden ser útiles para descartar un diagnóstico diferencial con una causa bacteriana grampositiva (por ejemplo, forúnculos o carbuncos) [34]. Las tres características clínicas principales de la HS son [1,16]:
- Localización anatómica típica (axilas, ingles, nalgas, mamas, perianal, perigenital),
- Lesiones típicas: bultos profundos y dolorosos; abscesos; fístulas drenantes; cicatrices),
- Curso recurrente o crónico
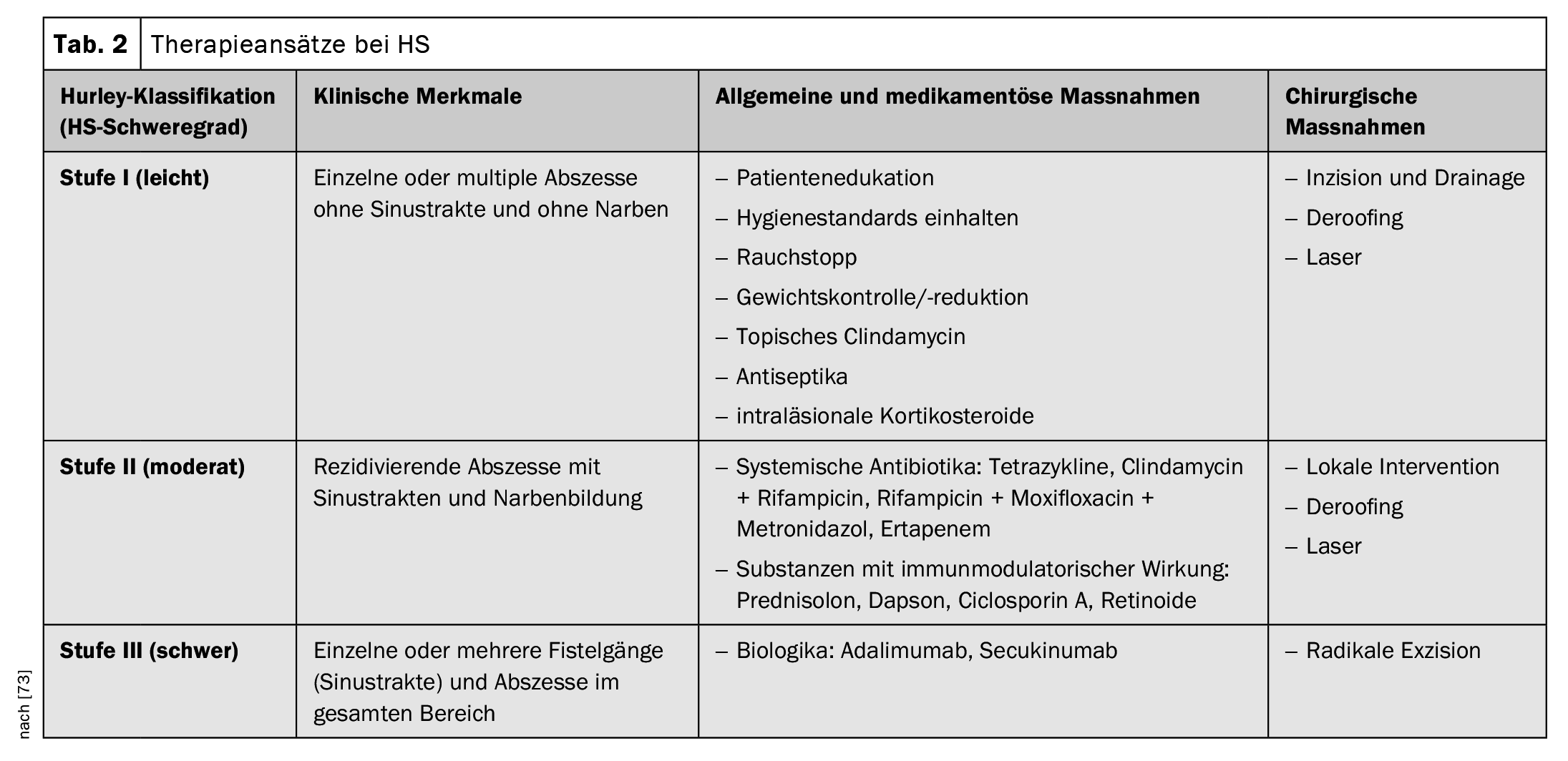
Los criterios diagnósticos postulados en las recomendaciones prácticas suizas publicadas en 2017 se resumen en la tabla 1; se basan en las tres características principales mencionadas [16,34,35]. En la actualidad no existe un consenso internacional sobre las puntuaciones que deben utilizarse para la HS, pero los estadios de Hurley y la puntuación de Sartorius son los más utilizados [17,34,35]. Según la clasificación de Hurley, se distinguen tres grados de gravedad en función de la manifestación clínica [17,46]:
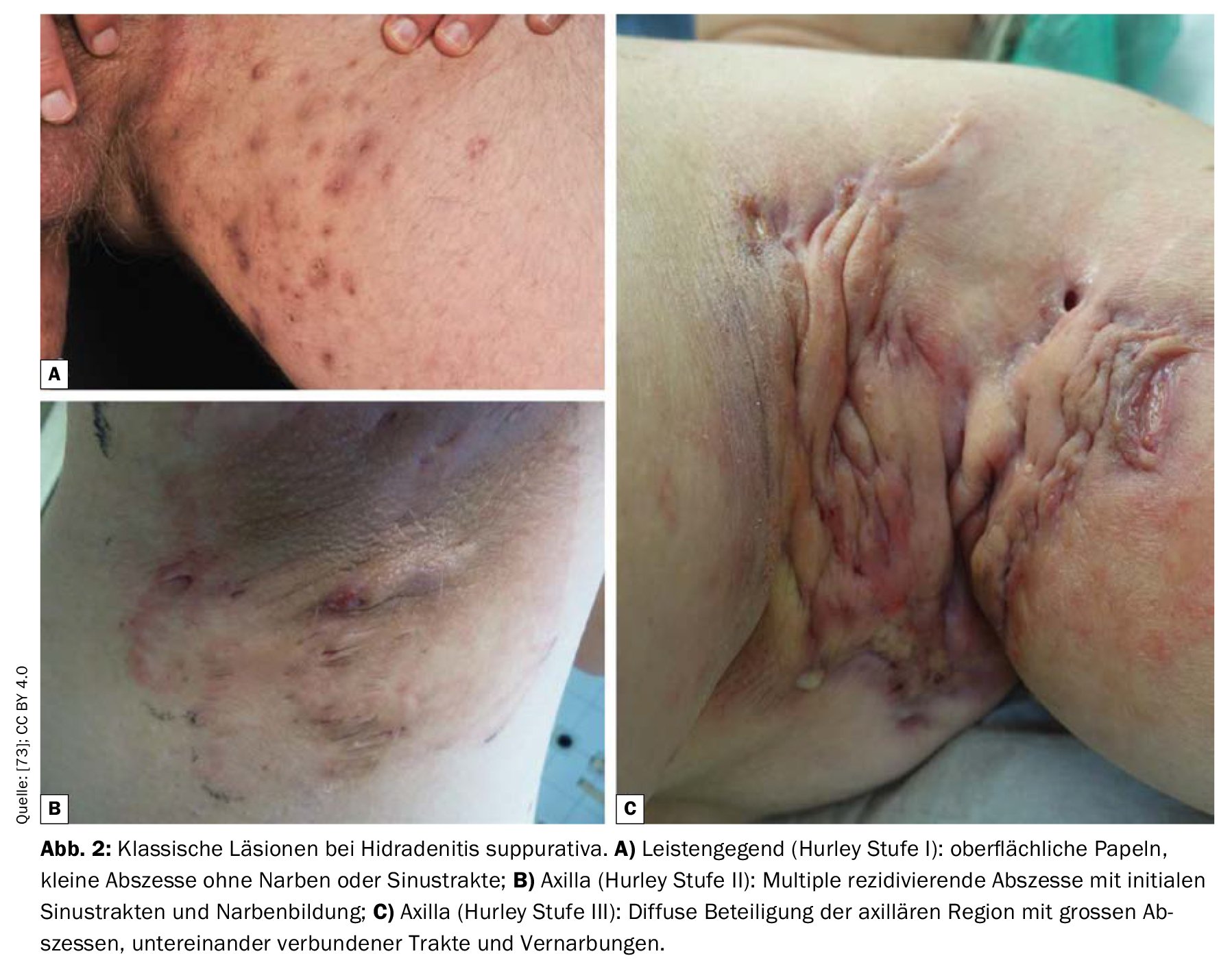
Fase I: Abscesos dolorosos aislados, únicos o múltiples, sin filamentos cicatriciales;
Estadio II: Abscesos dolorosos recurrentes con formación de filamentos y cicatrices, únicos o múltiples, pero no extensos;
Estadio III: Infiltraciones difusas, en forma de placa, inflamatorias y dolorosas, o múltiples filamentos y abscesos interconectados. Existe un riesgo de contracturas articulares como resultado de la restricción de movimiento relacionada con el dolor.
La HS de nivel I es la más común (65%), seguida de la de nivel II (31%) y la de nivel III (4%) [17]. La puntuación Sartorius registra el número de nódulos inflamatorios, abscesos, fístulas y zonas afectadas y asigna puntos. Otro sistema de clasificación es el Sistema Internacional de Puntuación de la Gravedad de la Hidradenitis Supurativa (IHS4). Todas las lesiones inflamadas se evalúan y se suman, por lo que un nódulo inflamado se cuenta una vez, un absceso dos veces y una fístula drenante cuatro veces. El total da lugar a una categorización en tres grados de gravedad (leve, moderada, grave) [50].
| Alta “carga de enfermedad” Los datos empíricos muestran que la calidad de vida, operacionalizada mediante la Índice dermatológico de calidad de vida (DLQI), está significativamente deteriorado en los pacientes, por lo que la magnitud de la carga varía en función de la gravedad de los síntomas: La media del DLQI fue de 5,77 para el nivel I según Hurley, de 13,1 para el nivel II y de 20,4 para el nivel III. Se trata de valores elevados, teniendo en cuenta que en la psoriasis de moderada a grave el DLQI es por término medio de 12-13 [10,11]. El dolor fue percibido como lo más angustioso por el 85% de los pacientes con HS, seguido de la hinchazón/inflamación y la sensibilidad [12]. Las deficiencias pueden dar lugar a una incapacidad laboral, y los malos olores y las manchas en la ropa causados por abscesos purulentos pueden conducir a la estigmatización social . |
Factores de riesgo y comorbilidades asociados a la HS
La gravedad y el curso de la HS se correlacionan con el índice de masa corporal (IMC) y, según varios estudios, un número superior a la media de pacientes con HS son fumadores (70-90%). Revuz et al. encontró una odds ratio ( OR) de 4,42 para los pacientes obesos (IMC >30) y de 12,55 para los fumadores en comparación con los controles sanos [2]. Otro estudio de Miller et al. encontró una OR de 6,38 para la obesidad [20]. El riesgo de que los pacientes con HS desarrollen diabetes mellitus de tipo 2 (OR=5,74) o síndrome metabólico (OR=3,89) aumenta significativamente [20]. En general, la prevalencia de los factores de riesgo cardiovascular aumenta significativamente en las personas con HS en comparación con los individuos sanos .
Con respecto a la progresión de la HS, los cinco factores siguientes se asociaron a un mayor riesgo de progresión del estadio I de Hurley al II o III en un estudio retrospectivo de 846 personas: sexo masculino, duración de la enfermedad, IMC, años-paquete de tabaquismo y localización de la lesión [22]. Otros factores desencadenantes de la HS son la irritación mecánica y ciertas afecciones comórbidas (por ejemplo, el síndrome de ovario poliquístico y la depresión) [23–26]. Algunos estudios informan de un aumento de las tasas de comorbilidad de la HS y otras enfermedades inflamatorias. Además del síndrome de ovario poliquístico, esto también se aplica a la enfermedad inflamatoria intestinal y al pioderma gangraenosum .
Etiopatogenia multifactorial y desregulación del sistema inmunitario
La predisposición genética, los factores relacionados con el estilo de vida (especialmente el tabaquismo y la obesidad), los componentes hormonales y los procesos inmunológicos disfuncionales están implicados tanto en el desarrollo como en el mantenimiento de la enfermedad [51,65]. Más recientemente, se ha postulado la hipótesis de que la interacción de factores endógenos y exógenos provoca la activación del sistema inmunitario innato [49]. Esto provoca una inflamación perifolicular, así como hiperqueratosis e hiperplasia del epitelio folicular, sobre todo en la zona del infundíbulo, lo que conduce al cierre folicular [52]. La dilatación y la rotura del folículo piloso inducen una intensa respuesta inmunitaria inflamatoria asociada al reclutamiento de neutrófilos, macrófagos, células B, células Th1 y Th17 en la piel, lo que da lugar a nódulos inflamatorios o a la formación de abscesos [51].
Las vías de señalización proinflamatorias contribuyen significativamente al desarrollo de la HS. En la piel lesional de los pacientes con HS, el aumento de la producción de un gran número de citocinas proinflamatorias como la interleucina (IL)-1, IL-6, IL-10, IL-12, IL-17, IL-23, IL-32, IL-36 y TNF-α) se ha demostrado como un indicio de desregulación inmunológica [51,53–56]. Ciertas vías parecen ser de especial importancia para la patogénesis de la HS [53]. Varios estudios han demostrado que la secreción de IL-23 e IL-12 conduce a una respuesta inmunitaria dominante Th17 y a la hiperplasia queratinocítica [56,58]. La IL-23 induce células T helper productoras de IL-17, que se infiltran en la dermis en las lesiones de HS [59]. Se sabe que la familia IL-17 está implicada en la patogénesis de varias enfermedades autoinmunes. La IL-17 también desempeña un papel esencial en la defensa del huésped contra las bacterias y los hongos extracelulares, y se ha demostrado que aumenta la expresión de los péptidos/alarminas antimicrobianos de la piel [58]. Por lo tanto, el bloqueo de la IL-17 también parece ser un enfoque terapéutico válido para la HS [58].
A medida que progresa la hidradenitis supurativa, se encuentran en el tejido niveles elevados de TNF, IL-1β, IL-17, caspasa-1 e IL-10, lo que conduce al reclutamiento de neutrófilos, mastocitos y monocitos, que se diferencian en macrófagos y células dendríticas [59–61,65]. Hallazgos recientes también indican que en la HS está implicado un mecanismo autoinflamatorio: la piel con HS, por ejemplo, muestra una mayor formación de redes extracelulares de neutrófilos (NET) [65]. Las respuestas inmunitarias a los antígenos relacionados con los neutrófilos y las NET se han asociado a un aumento de la desregulación inmunitaria y la inflamación [62].
La cicatrización del tejido previamente inflamado puede provocar restricciones de movimiento a largo plazo [58–60]. El desarrollo de cicatrices y de tractos sinusales está asociado al factor de crecimiento transformante (TGF)-β y a la molécula de adhesión ICAM-1 [58]. La sobreinfección bacteriana de las lesiones establecidas puede contribuir al mantenimiento de la inflamación crónica [61]. Las principales especies bacterianas aisladas en las lesiones de HS incluyen cocos grampositivos, entre ellos Staphylococcus aureus y especies de Streptococcus, estafilococos coagulasa negativos, Proteus mirabilis y bacterias anaerobias mixtas [61]. Se detectaron Staphylococcus epidermidis y Corynebacterium spp. así como bacterias atípicas como Proteus mirabilis, Escherichia coli, Enterobacter aerogens y Enterococcus faecalis en muestras microbiológicas de los ganglios linfáticos drenantes en pacientes con HS tras la escisión quirúrgica [64].
Tratamiento multimodal – el anti-IL-17A-Ak como nueva estrategia terapéutica
Las recomendaciones de tratamiento suizas publicadas en 2017 hacen referencia a varias modalidades de enfermedad o puntos de partida para el tratamiento, por lo que las opciones terapéuticas recomendadas se adaptan a la gravedad de la HS (Tabla 2) [34,35]. En cuanto a las opciones de tratamiento farmacológico, la autorización por Swissmedic este año del inhibidor de la IL-17-A secukinumab representa una importante ampliación del espectro terapéutico.
Farmacoterapia: El algoritmo de tratamiento recomendado se basa, en primer lugar, en la escala de gravedad de Hurley (I-III) y, en segundo lugar, en las características específicas de la enfermedad.
- Preparados tópicos: Se recomiendan desinfectantes tópicos (por ejemplo, triclosán, bituminosulfonato de amonio) o antibióticos tópicos (por ejemplo, solución de clindamicina) para prevenir la sobreinfección bacteriana y reducir la inflamación y la maceración [30,34,35]. Los nódulos inflamados pueden tratarse con esteroides intralesionales [34,35].
- Antibióticos sistémicos: Si los agentes tópicos no son suficientes, suelen administrarse antibióticos sistémicos. Se sugiere doxiciclina (50-200 mg diarios, durante 3-6 meses) o rifampicina en combinación con clindamicina (300 mg dos veces al día, durante un máximo de tres meses), puede añadirse gluconato de zinc (3× 30 mg, diarios) como combinación [31,34,35].
- Terapéutica sistémica convencional y biológicos: El secukinumab o el adalimumab pueden prescribirse en la dosis recomendada para la HS activa de moderada a grave que no haya respondido adecuadamente a la terapia antibiótica sistémica [72]. Como alternativa, puede utilizarse acitretina sistémica (0,2-0,5 mg/kg al día), dapsona (50-150 mg al día), metformina, ciclosporina A o esteroides sistémicos [34,35]. La eficacia suele evaluarse en los ensayos clínicos mediante la puntuación de respuesta clínica a la hidradenitis supurativa (HiSCR) [48]. La HiSCR se define como una reducción ≥50% de las lesiones inflamatorias (suma de abscesos y nódulos inflamatorios) y ningún aumento del número de abscesos y fístulas secretoras en comparación con la situación inicial [48].
- Analgésicos: El dolor puede proceder de los bultos inflamados y los abscesos, pero las cicatrices, los queloides, las ulceraciones abiertas, el linfedema, las fisuras anales o la artritis también pueden causar dolor. Además de los preparados tópicos (por ejemplo, lidocaína y agentes antiinflamatorios), en la literatura especializada se mencionan agentes antiinflamatorios no esteroideos sistémicos, anticonvulsivos atípicos (por ejemplo, gabapentina o pregabalina) e inhibidores de la recaptación de serotonina/norepinefrina [70,71]. La duloxetina ha demostrado su eficacia para la depresión comórbida [71].
Medidas quirúrgicas y escisión con láser: La escisión local de lesiones individuales sólo se recomienda en casos localizados y bien circunscritos de Hurley I y II [1]. En todos los demás casos, debe considerarse la posibilidad de realizar unaescisión amplia de la piel con bisturí oláser de CO2, que incluya partes del tejido adiposo de toda la zona afectada [1]. El plan de tratamiento quirúrgico exacto -al igual que la terapia convencional- debe aclararse individualmente y en consulta con el paciente. La fisioterapia está indicada hasta que la herida haya cicatrizado por completo.
Factores del estilo de vida: Para promover la calidad de vida de los pacientes con HS, debe hacerse hincapié en los vínculos entre los factores del estilo de vida y la HS como parte de la educación de los pacientes. Se cree que la nicotina induce hiperplasia epidérmica y congestión folicular [67]. Además, los pacientes con HS ya presentan un riesgo cardiovascular elevado, que se ve agravado por el tabaquismo [68]. Además del tabaquismo, la obesidad también está asociada a la gravedad de la enfermedad. Existe un consenso general en que dejar de fumar y reducir peso son medidas importantes para contrarrestar una exacerbación de la enfermedad [2,66]. Las directrices internacionales afirman explícitamente que la reducción de peso puede tener un efecto positivo sobre la gravedad de la enfermedad en las personas con sobrepeso que padecen HS y que los pacientes deben recibir asesoramiento en este sentido [68]. Además, se recomienda llevar ropa holgada para evitar tensiones mecánicas [68].
Apoyo psicosocial: la HS tiene un impacto negativo en la calidad de vida y puede provocar trastornos depresivos y desintegración social. Existen pruebas empíricas de que los pacientes con HS experimentan un alto nivel de angustia y se aconseja incluir no sólo los síntomas físicos sino también las dimensiones psicológicas de la enfermedad en la gestión de la misma [68,69]. En un estudio publicado en 2019, en el que participaron 110 pacientes con HS (edad media 38±12 años; 61 mujeres, 49 hombres), se encontraron correlaciones significativas entre el Skindex-29 y la puntuación Sartorius (síntomas: p=0,024; emociones: p=0,019; estado funcional: p=0,002) [69]. Además, la EAV para el dolor se correlacionó significativamente con el DLQI (p=0,000) y el IMC se asoció con la puntuación Sartorius (p=0,038) [69].
Mensajes para llevarse a casa
- La hidradenitis supurativa (HS) es una enfermedad inflamatoria crónica de la piel con bultos recurrentes, abscesos y formación de fístulas y cicatrices en regiones del cuerpo con glándulas apocrinas (axila, ingle, región perianal y perineal). Los antecedentes familiares son positivos en cerca del 40% de los casos. Las mujeres se ven afectadas con más frecuencia que los hombres.
- Los factores de riesgo y las comorbilidades más importantes son el tabaquismo, la obesidad y el síndrome metabólico. Sin embargo, las espondiloartropatías y las enfermedades inflamatorias intestinales crónicas (EII) también están representadas con una frecuencia superior a la media en esta población de pacientes.
- La patogénesis aún no se ha aclarado del todo; se supone que existen interacciones multifactoriales. Entre otras cosas, se detectó una fuerte expresión de citoquinas proinflamatorias en las lesiones cutáneas de los pacientes con HS. Este es un punto de partida para nuevas opciones de terapia sistémica como los biológicos.
- Generalmente se aboga por un enfoque de tratamiento multimodal. Además de los factores relacionados con el estilo de vida y los preparados tópicos, se utilizan terapias sistémicas, intervenciones quirúrgicas y otros métodos en función de la gravedad. Además del adalimumab, el secukinumab también está disponible como biológico en Suiza desde 2023. El tratamiento del dolor y la inclusión de aspectos psicosociales son medidas de acompañamiento importantes.
Literatura:
- Zouboulis CC, et al: Directriz S1 para el tratamiento de la hidradenitis supurativa/acné inverso (número CIE-10 L73.2) (en alemán). JDDG 2012;10(suppl 5): S1-S31.
- Revuz JE, et al: Prevalencia y factores asociados a la hidradenitis supurativa: resultados de dos estudios de casos y controles. JAAD 2008;59: 596-601.
- Jemec GB, Heidenheim M, Nielsen NH: La prevalencia de la hidradenitis supurativa y sus posibles lesiones precursoras. JAAD 1996;35: 191-194.
- Woodruff CM, Charlie AM, Leslie KS: Hidradenitis supurativa: guía para el médico en ejercicio. Mayo Clin Proc 2015; 90: 1679-1693.
- Hunger RE, et al: El receptor tipo Toll 2 está altamente expresado en las lesiones del acné inverso y se colocaliza con el receptor de lectina tipo C. BJD 2008; 158: 691-697.
- Jemec GB, Hansen U: Histología de la hidradenitis supurativa. JAAD 1996; 34: 994-999.
- Schlapbach C, et al: Expresión de la vía IL-23/Th17 en lesiones de hidradenitis supurativa. JAAD 2011; 65: 790-798.
- von Laffert M, et al: Hidradenitis supurativa (acné inverso): eventos inflamatorios tempranos en los folículos terminales y en la epidermis interfolicular. Exp Dermatol 2010;19: 533-537.
- Margesson LJ, Danby FW: Hidradenitis supurativa. Buenas prácticas e investigación. Clin Obstet Gynaecol 2014; 28: 1013-1027.
- Alavi A: Hidradenitis supurativa: desmitificación de una enfermedad crónica y debilitante. JAAD 2015; 73(5 suppl 1): S1-S2.
- Revicki D, et al: Impacto del tratamiento con adalimumab en la calidad de vida relacionada con la salud y otros resultados comunicados por los pacientes: resultados de un ensayo controlado aleatorizado de 16 semanas de duración en pacientes con psoriasis en placas de moderada a grave. BJD 2008;158: 549-557.
- Kimball A, et al: Experiencias de pacientes con hidradenitis supurativa: un estudio cualitativo de síntomas e impactos. JAAD 2013; 68: AB57.
- Kimball AB, et al: Adalimumab para el tratamiento de la hidradenitis supurativa de moderada a grave: un ensayo aleatorizado paralelo. Ann Intern Med 2012;157: 846-855.
- Jemec GB: Práctica clínica. Hidradenitis supurativa. NEJM 2012;366: 158-164.
- Saunte DM, et al: El retraso diagnóstico en la hidradenitis supurativa es un problema mundial. BJD 2015;173: 1546-1549.
- Zouboulis CC, et al: Hidradenitis supurativa/acné inversa: criterios de diagnóstico, evaluación de la gravedad, clasificación y evaluación de la enfermedad. Dermatología 2015;231: 184-190.
- Revuz J: Hidradenitis supurativa. JEADV 2009; 23: 985-998.
- Sartorius K, et al: Puntuación objetiva de la hidradenitis supurativa que refleja el papel del tabaquismo y la obesidad. BJD 2009; 161: 831-839.
- Sartorius K, et al: Sugerencias para uniformar las variables de resultado al informar sobre los efectos del tratamiento en la hidradenitis supurativa. BJD 2003; 149: 211-213.
- Miller IM, et al: Asociación del síndrome metabólico y la hidradenitis supurativa. JAMA Dermatol 2014;150: 1273-1280.
- Tzellos T, et al: Factores de riesgo de enfermedad cardiovascular en pacientes con hidradenitis supurativa: revisión sistemática y metaanálisis de estudios observacionales. BJD 2015; 173: 1142-1155.
- Schrader AM, et al: Hidradenitis supurativa: un estudio retrospectivo de 846 pacientes holandeses para identificar factores asociados a la gravedad de la enfermedad. JAAD 2014; 71: 460-467.
- Boer J, Nazary M, Riis PT: El papel de la tensión mecánica en la hidradenitis supurativa. Dermatol Clin 2016; 34: 37-43.
- Nazary M, et al: Patogénesis y farmacoterapia de la hidradenitis supurativa. Eur J Pharmacol 2011; 672: 1-8.
- van der Zee HH, et al: La asociación entre la hidradenitis supurativa y la enfermedad de Crohn: en busca del eslabón patogénico perdido. J Invest Dermatol 2016;136: 1747-1748.
- Shavit E, et al: Comorbilidades psiquiátricas en 3.207 pacientes con hidradenitis supurativa. JEADV 2015;29: 371-376.
- van der Zee HH, et al: Hidradenitis supurativa y enfermedad inflamatoria intestinal: ¿están asociadas? Resultados de un estudio piloto. BJD 2010; 162: 195-197.
- Hsiao JL, et al: Hidradenitis supurativa y pioderma gangrenoso concomitante: serie de casos y revisión bibliográfica. Arch Dermatol 2010; 146: 1265-1270.
- Kraft JN, Searles GE: Hidradenitis supurativa en 64 pacientes femeninas: estudio retrospectivo que compara los antibióticos orales y la terapia antiandrógena. J Cutan Med Surg 2007; 11: 125-131.
- Jemec GB, Wendelboe P: Clindamicina tópica frente a tetraciclina sistémica en el tratamiento de la hidradenitis supurativa. JAAD 1998; 39: 971-974.
- Gener G, et al: Terapia combinada con clindamicina y rifampicina para la hidradenitis supurativa: una serie de 116 pacientes consecutivos. Dermatología 2009;219: 148-154.
- Kimball AB, et al: Dos ensayos de fase 3 de adalimumab para la hidradenitis supurativa. NEJM 2016;375: 422-434.
- Boer J, Nazary M: Resultados a largo plazo del tratamiento con acitretina para la hidradenitis supurativa. ¿El acné inverso también es un término equivocado? BJD 2011; 164: 170-175.
- Hunger RE, et al: Recomendaciones prácticas suizas para el tratamiento de la hidradenitis supurativa (acné inverso). Compass Dermatol 2019; 7 (1): 8-13.
- Hunger RE, et al: Recomendaciones prácticas suizas para el tratamiento de la hidradenitis supurativa/acné inverso. Dermatología, 2017, 233 (2-3).
- van der Zee HH, et al: El tratamiento con adalimumab (anti-TNF-α) de la hidradenitis supurativa mejora la inflamación cutánea: un estudio in situ y ex vivo. BJD 2012; 166: 298-305.
- Wolk K, et al: La deficiencia de IL-22 contribuye a una enfermedad inflamatoria crónica: mecanismos patogenéticos en el acné inverso. J Immunol 2011, 186: 1228-1239.
- Högenauer C, et al.: Gestión interdisciplinar de las enfermedades inmunomediadas: una perspectiva austriaca. Revista de enfermedades gastroenterológicas y hepatológicas 2019; 17: 108-124.
- Fimmel S, Zouboulis CC: Comorbilidades de la hidradenitis supurativa (acné inverso). Dermatoendocrinol 2010; 2(1): 9-16.
- Sabat R, et al: Mayor prevalencia del síndrome metabólico en pacientes con acné inverso. PloS One 2012; 7(2):e31810.
- Gold DA, et al: La prevalencia del síndrome metabólico en pacientes con hidradenitis supurativa. JAAD 2014; 70(4): 699-703.
- Deckers IE, et al: La enfermedad inflamatoria intestinal se asocia a la hidradenitis supurativa: resultados de un estudio transversal multicéntrico. JAAD 2017; 76(1): 49-53.
- Shlyankevich J, et al: La hidradenitis supurativa es una enfermedad sistémica con una importante carga de comorbilidad: un análisis de casos y controles verificado mediante gráficos. JAAD 2014; 71(6): 1144-1150.
- Richette P, et al: Hidradenitis supurativa asociada a espondiloartritis: resultados de un estudio prospectivo nacional multicéntrico. J Rheumatol 2014; 41(3): 490-494.
- Esmann S, Jemec GB: Impacto psicosocial de la hidradenitis supurativa: un estudio cualitativo. Acta Derm Venereol 2011; 91: 328-332.
- Hurley HJ: Hiperhidrosis axilar, bromhidrosis apocrina, hidradenitis supurativa y pénfigo benigno familiar: abordaje quirúrgico. En: Roenigk RK, Roenigk HH, Jr, eds. Cirugía dermatológica: principios y práctica. 2ª ed. Nueva York: Marcel Dekker 1996: 623-645.
- Kokolakis G, et al: El retraso en el diagnóstico de la hidradenitis supurativa y su efecto sobre los pacientes y el sistema sanitario. Dermatología 2020; 236(5): 421-430.
- Kimball AB, et al: Evaluación de la validez, capacidad de respuesta y significación de la respuesta clínica a la hidradenitis supurativa (HiSCR) como criterio de valoración clínica para el tratamiento de la hidradenitis supurativa. Br J Dermatol 2014; 171(6): 1434-1442.
- Kurzen H, et al: ¿Qué causa la hidradenitis supurativa? Exp Dermatol 2008; 17(5): 455-456; discusión 457-472.
- Zouboulis CC, et al; Grupo de investigadores de la Fundación Europea de Hidradenitis Supurativa. Desarrollo y validación del Sistema Internacional de Puntuación de la Gravedad de la Hidradenitis Supurativa (IHS4), un novedoso sistema de puntuación dinámico para evaluar la gravedad de la HS. Br J Dermatol 2017; 177(5): 1401-1409.
- Vossen A, van der Zee HH, Prens EP: Hidradenitis supurativa: Una revisión sistemática que integra las vías inflamatorias en un modelo patogénico cohesivo. Front Immunol 2018; 9: 2965.
- Von Laffert M, et al: Hidradenitis supurativa/acné inverso: Hiperplasia epitelial bilocada con secuelas muy diferentes. BJD 2011; 164: 367-371.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Act Dermatol 2019; 45: 277-287.
- Melnik BC, et al: Desequilibrio células T helper 17/células T reguladoras en la hidradenitis supurativa/acné inverso: El vínculo con la disección del folículo piloso obesidad tabaquismo y comorbilidades autoinmunes. BJD 2018; 179: 260-272.
- Van der Zee HH, et al: Niveles elevados de factor de necrosis tumoral (TNF)-α interleucina (IL)-1β e IL-10 en la piel con hidradenitis supurativa: Una justificación para actuar sobre el TNF-α y la IL-1β. BJD 2011; 164: 1292-1298.
- Zouboulis CC, et al: ¿Qué causa la hidradenitis supurativa? 15 años después. Exp Dermatol 2020; 29: 1154-1170.
- Sabat R, et al: Hidradenitis supurativa. Nat Rev Dis Prim 2020; 6: 18.
- Thomi R, et al: Asociación de la hidradenitis supurativa con los fenotipos T Helper 1/T Helper 17: Un Análisis de Mapa Semántico. JAMA Dermatol 2018; 154: 592.
- Wieland CW, et al: Marcador mieloide S100A8/A9 y marcador linfocitario, receptor soluble de interleucina 2: ¿Biomarcadores de la actividad de la enfermedad hidradenitis supurativa? Br J Dermatol 2013; 168: 1252-1258.
- 60 Saunte DML, Jemec GBE: Hidradenitis supurativa: avances en diagnóstico y tratamiento. JAMA 2017; 318: 2019-2032.
- Gierek M, et al: Hidradenitis supurativa: Estudio bacteriológico en el tratamiento quirúrgico. Postep. Dermatol Alergol 2022; 39: 1101-1105.
- Jastrząb B, et al: Prevalencia de la periodontitis y evaluación de la microbiota oral en pacientes con hidradenitis supurativa: un estudio descriptivo transversal. J Clin Med 2022; 11: 7065.
- Ganzetti G, et al: Enfermedad periodontal: ¿una manifestación oral de la psoriasis o un hallazgo ocasional? Drug Dev. Res. 2014, 75, S46-S49.
- 64 Vaienti S, et al: Afectación de los ganglios linfáticos en la hidradenitis supurativa axilar: un estudio clínico, ultrasonográfico y bacteriológico realizado durante la cirugía radical. J Clin Med 2021; 10: 1433.
- 65 Molinelli E, et al: Nueva visión del patomecanismo molecular y los tratamientos inmunomoduladores de la hidradenitis supurativa. Int J Mol Sci 2023; 24(9): 8428. www. mdpi.com/1422-0067/24/9/8428,(última consulta: 16/10/2023)
- Brajac I, et al: Smjernice za Dijagnostiku i Liječenje Gnojnog Hidradnitisa (Hidradenitis Suppurativa) Liječ Vjesn 2017; 139: 247-253.
- Hana A, et al: Importancia funcional de la acetilcolina no neuronal en los epitelios cutáneos. Life Sci 2007; 80: 2214-2220.
- Ingram JR, et al. : Directrices de la Asociación Británica de Dermatólogos para el tratamiento de la hidradenitis supurativa (acné inverso) 2018. Revista Británica de Dermatología 2019; 180 (5): 1009-1017.
- Frings VG, et al. Evaluación de la carga psicológica de los pacientes con hidradenitis supurativa. Eur J Dermatol 2019; 29: 294-301.
- Ballard K, Shuman VL: Hidradenitis supurativa. [Updated 2023 Apr 17]. En: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 ene.
- Fernandez JM, et al: Modalidades de tratamiento del dolor en la hidradenitis supurativa: una encuesta a pacientes. J Dermatolog Treat 2022; 33(3): 1742-1745.
- Swissmedic: Información sobre medicamentos, www.swissmedicinfo.ch,(último acceso 16.10.2023)
- Scala E, et al: Hidradenitis supurativa: dónde estamos y hacia dónde vamos. Cells 2021, 10, 2094. www.mdpi.com/2073-4409/10/8/2094#,(última consulta: 16 de octubre de 2023).
Foto de portada: Dr. Thomas Brinkmeyer, wikimedia. Hurley etapa II
PRÁCTICA DERMATOLÓGICA 2023; 33(5): 6-11