La hidradenitis supurativa (HS) tiene una etiopatogenia multifactorial y se asocia a un elevado deterioro de la calidad de vida. Los hallazgos empíricos de una mayor expresión de citoquinas inflamatorias sugieren una génesis inmunológica de esta enfermedad cutánea inflamatoria recurrente. La gama de tratamientos farmacológicos disponibles hasta ahora es limitada. Paralelamente a la investigación de las bases inmunopatológicas, se están probando diversas sustancias activas en ensayos clínicos.
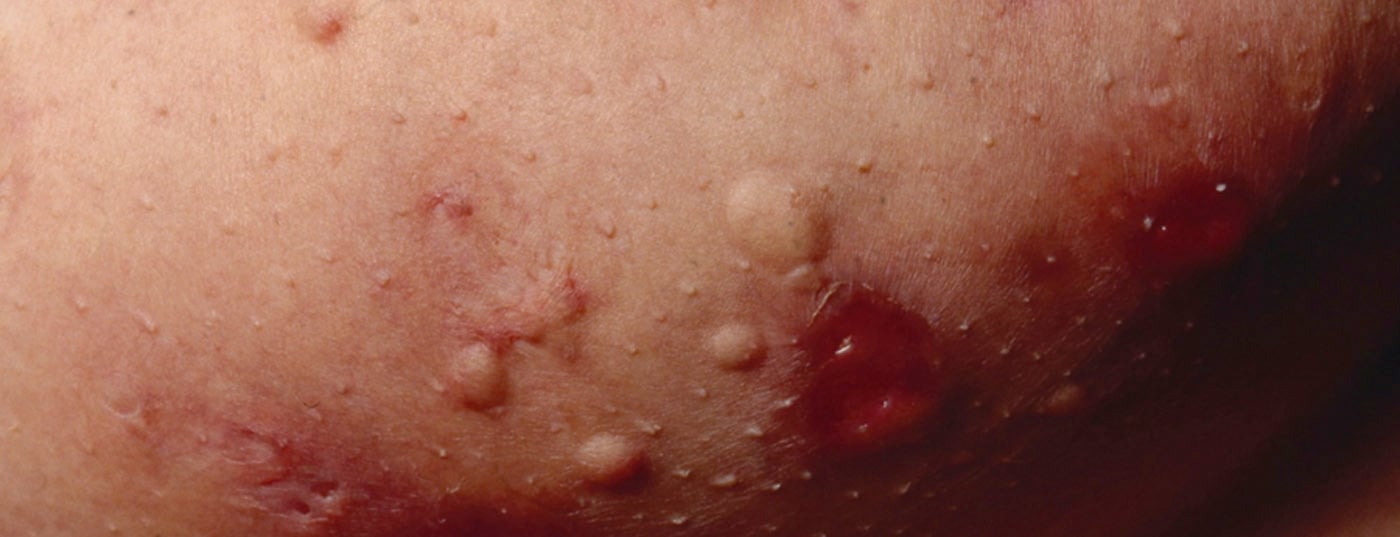
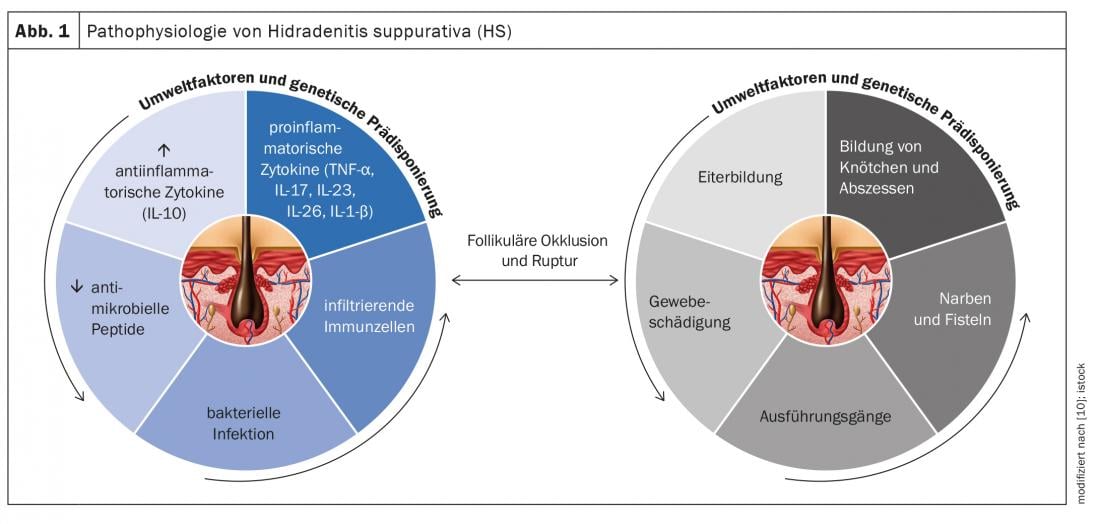
La hidradenitis supurativa (HS) -también llamada “acné inverso”- es una enfermedad inflamatoria crónica de los folículos pilosos que provoca fístulas crónicas, abscesos y cicatrices en las regiones axilar, inguinal y perianal [1]. Se supone una patogénesis multifactorial, aunque aún quedan muchas cuestiones abiertas [2]. Según los conocimientos actuales, la HS comienza con la oclusión y dilatación en el folículo piloso, lo que conduce a la rotura y a una reacción inflamatoria, que da lugar a una inflamación crónica con tractos fistulosos [3,4]. Numerosas citoquinas están implicadas en la reacción inflamatoria multifactorial. Además de los factores genéticos predisponentes, el tabaquismo y la obesidad contribuyen al desarrollo de la enfermedad (Fig. 1) [11]. Según la manifestación clínica, se distinguen diferentes grados de gravedad. Además de la clasificación según Hurley [5], Zouboulis et al. En 2017 se publicó el Sistema Internacional de Puntuación de la Gravedad de la Hidradenitis Supurativa (puntuación IHS4), una herramienta validada que puede utilizarse en la práctica clínica diaria para evaluar la gravedad de la HS(Tab. 1) [6,9].
Necesidad de más opciones de tratamiento farmacológico
Las opciones de tratamiento para la HS son limitadas. Existen diferentes enfoques para controlar la inflamación y reducir la gravedad de las manifestaciones. Las cremas y soluciones antisépticas y antibióticas, así como los antibióticos en comprimidos, pueden reducir los gérmenes de la piel y contribuir así a mejorar la calidad de vida del paciente. El fármaco biológico adalimumab (Humira®), un bloqueante del factor de necrosis tumoral (TNF)-α, está aprobado en Suiza desde 2016 para el tratamiento de la HS en estadio intermedio y avanzado [7]. Además, se utilizan diversas terapias farmacológicas fuera de lo indicado. Otras opciones de tratamiento incluyen procedimientos médicos con láser y la escisión quirúrgica de las fístulas con o sin cobertura plástica del defecto.

Fisiopatología de la HS: los hallazgos inmunopatológicos de un vistazo
Con el fin de ampliar la gama de tratamientos medicinales, la investigación de las bases fisiopatológicas de la HS se ha convertido cada vez más en el centro de la atención científica en los últimos años. El papel de varias citoquinas proinflamatorias se analiza a nivel molecular [2]. A continuación se presentan los resultados de un análisis secundario publicado en el International Journal of Molecular Sciences en 2020 con una integración de los hallazgos inmunopatológicos en pacientes con HS [2]:
TNF-α e IFN-γ: Los niveles de TNF-α regulados al alza muestran una correlación positiva con la gravedad de la HS. El TNF-α aumenta la proporción de Th17:Treg*, lo que da lugar a una producción excesiva de células Th17 y, en consecuencia, de las citocinas IL-17 e IL-22. El TNF-α induce la expresión de las quimiocinas CXCL8, CXCL11, CCL20 y CCL2 en los queratinocitos. Estos son responsables del reclutamiento de neutrófilos, células T y monocitos en la piel. En conjunto, estas señales conducen a una infiltración masiva de células inmunitarias en el tejido dañado. Por lo tanto, las lesiones de HS se caracterizan por granulocitos, células T, células B y monocitos, que se diferencian en macrófagos y células dendríticas. La IL-23 y la IL-12 apoyan a las células Th17 y Th1 en la producción de las citocinas IL17 e IFN-γ.
*Treg=células T reguladoras
IL-1: Los hallazgos empíricos demuestran que los procesos mediados por la IL-1 están regulados al alza en la HS y contribuyen a la infiltración celular y al daño tisular. La familia de la citocina IL-1 incluye 7 citocinas con actividad proinflamatoria, entre las que se encuentran la IL-1α, la IL-1β, la IL-18, la IL-33, la IL-36α, la IL-36β y la IL-36γ. La IL-1α es fuertemente proinflamatoria e induce una cascada de mediadores inflamatorios como el TNF y la IL-18. Varios hallazgos empíricos indican que los queratinocitos producen niveles elevados de IL-1. Se cree que existe un mecanismo de retroalimentación positiva entre la IL-1 y la IL-17. La IL-36 está implicada en la activación de los inflamasomas, así como en la señalización proinflamatoria mediante la activación del factor nuclear-kB (NF-κB) y de la proteína quinasa activada por mitógenos (MAPK). Se detectaron niveles elevados de IL-36α, IL-36β e IL-36γ en el suero y la piel lesional de los pacientes con HS.
IL-6: Las pruebas sobre las asociaciones entre la IL-6 y la HS son controvertidas. Mientras que algunos estudios han mostrado un aumento de la expresión de ARNm de IL-6 en las lesiones de pacientes con HS en comparación con la piel no lesional, otros estudios han mostrado una disminución de los niveles de IL-6 en las lesiones de HS en comparación con la piel no lesional. La IL-6 es una citocina pleotrópica que desempeña un papel clave en toda una serie de procesos inmunitarios. En combinación con el TGF-β, la IL-1β y la IL-23, la IL-6 desencadena el desarrollo de células Th17 e inhibe el desarrollo de células T reguladoras inducidas por el TGF-β.
IL-10: Se ha observado que en la HS no sólo hay niveles elevados de citocinas proinflamatorias, sino que también el mediador antiinflamatorio IL-10 está sobreexpresado en la piel lesional de los pacientes con HS. Una posible explicación es que la regulación al alza de la IL-10 inmunosupresora sea una respuesta compensatoria a los procesos inflamatorios y a la propagación de microbios comensales en la piel. Esto suprime los niveles de IL-22 e IL-17 en la piel lesional. Para saber más sobre el papel de esta citocina antiinflamatoria en la patogénesis de la HS, se necesitan más estudios.
IL-17/IL-23: En la dermis papilar y reticular de las lesiones de HS, hay un gran número de células Th17, que pueden estar implicadas en la inflamación neutrofílica excesiva y el drenaje purulento. Se observó una sobreexpresión de IL-17 en la piel lesional, perilesional y no lesional de pacientes con HS, lo que indica una inflamación subclínica que precede a la formación de lesiones activas. También se detectó un aumento de los niveles de IL-17 en el suero de los pacientes con HS. En los queratinocitos, la IL-17 induce la expresión de varias proteínas (LL37/catelicidina, S100A7, S100A8 y S100A9), que están aumentadas en la piel lesional y el suero de los pacientes con HS, pero no en la piel perilesional. Estas proteínas están implicadas en la proliferación de los queratinocitos y en la expresión de citocinas y quimiocinas proinflamatorias. En conjunto, los hallazgos sugieren que el eje IL-23/IL-17 está implicado de forma significativa en la patogénesis de la HS.

Paralelamente a la investigación de los patomecanismos a nivel molecular, se está investigando en ensayos clínicos la eficacia de nuevas terapias antiinflamatorias [8]. Esto incluye también una serie de casos que fue presentada en la conferencia del DDG de este año por la Dra. med. Caroline Hilbring, médico asistente del Instituto de Investigación de Servicios Sanitarios en Dermatología y Profesiones de Enfermería del Hospital Universitario de Hamburgo (D) (recuadro ) [9].
Congreso: Conferencia DDG 2021
Literatura:
- Iesalnieks I, Dornseifer U: Acné inverso (hidradenitis supurativa). Cirujano 2020; 91: 293-300.
- Del Duca E, et al. Vías de las citocinas y terapias diana en investigación en la hidradenitis supurativa. Int J Mol Sci 2020; 21: 8436; doi:10.3390/ijms21228436
- Vossen ARJV, van der Zee HH, Prens EP: Hidradenitis supurativa: una revisión sistemática que integra las vías inflamatorias en un modelo patogénico cohesivo. Front Immunol 2018; 9: 2965.
- Van der Zee H: Biológicos en el tratamiento de la hidradenitis supurativa. Hessel van der Zee, MD, PhD. EADVVirtual Highlights, 2020.
- https://2020.eadvhighlights.com (última consulta: 14.09.2021)
- Revuz J: Hidradenitis supurativa. J Eur Acad Dermatol Venereol 2009; 23: 985-998.
- Zouboulis C, et al: Desarrollo y validación del sistema internacional de puntuación de la gravedad de la hidradenitis supurativa (IHS4), un novedoso sistema de puntuación dinámico para evaluar la gravedad de la HS. Br J Dermatol 2017; 177: 1401-1409.
- Información sobre medicamentos, www.swissmedicinfo.ch, (último acceso 14.09.2021)
- Schuch A, Absmaier-Kijak M, Volz T: Acné inverso/Hidradenitis supurativa – De la patogenia a la terapia. Dermatología actual 2019; 45(06): 277-287.
- Hilbring C, Kirsten N, Augustin M: Serie de casos de 10 pacientes con acné inverso: uso de Ixe-kizumab en caso de pérdida secundaria del efecto del adalimumab. FV01/08, reunión del DDG, 15.04.2021.
- Scala E, et al.: Hidradenitis supurativa: dónde estamos y hacia dónde vamos. Células 2021; 10(8), 2094; https://doi.org/10.3390/cells10082094
- Wolk K, Join-Lambert, O, Sabat, R: Etiología y patogenia de la hidradenitis supurativa. Br J Dermatol 2020; 183(6): 999-1010.
PRÁCTICA DERMATOLÓGICA 2021; 31(6): 39-40