Los cambios en la dieta y el ejercicio resultan a menudo insuficientes como medidas contra la obesidad mórbida. Hasta ahora, la cirugía bariátrica ha sido la única medida dirigida a muchos pacientes obesos. Esto ha cambiado entretanto. Con los miméticos de la incretina puede lograrse una reducción sustancial del peso con una mejora paralela de la calidad de vida. Mientras que los GLP-1-RA imitan a la hormona incretina péptido similar al glucagón (GLP)-1, los agonistas duales GIP/GLP-1 también activan los receptores del péptido insulinotrópico dependiente de la glucosa (GIP).
La obesidad es una enfermedad compleja y multifactorial que aumenta el riesgo de enfermedades secundarias como la diabetes de tipo 2, las enfermedades cardiovasculares, el daño renal y el cáncer [1–3]. Tanto la obesidad como la diabetes están causadas e influidas por diversos determinantes genéticos y factores medioambientales [4]. La obesidad surge como resultado de un balance energético positivo; sin embargo, las causas del desequilibrio entre la energía suministrada y la consumida son heterogéneas y complejas.
Los análogos de la incretina como “cambio de juego”: perder peso sin pasar hambre
El péptido similar al glucagón-1 (GLP-1) y el péptido insulinotrópico dependiente de la glucosa (GIP) son incretinas. Estas sustancias imitan a las hormonas del propio organismo del tracto gastrointestinal, que le hacen sentirse saciado, aumentan la quema de grasas y estimulan la secreción de insulina [5,6]. “Los fármacos contra la obesidad pueden replicar una, dos o tres incretinas en una molécula y, por tanto, son eficaces en distintos grados”, explicó la doctora Susanne Reger-Tan, jefa del Centro de Excelencia en Diabetes de la Clínica de Endocrinología, Diabetología y Metabolismo del Hospital Universitario de Essen (D) [1]. El tratamiento con análogos de la incretina, a menudo denominado en los medios de comunicación “inyecciones para adelgazar”, conduce a una pérdida de peso sustancial en personas con obesidad y sin la molesta sensación de hambre. “Según el estado actual de los conocimientos, este nuevo enfoque farmacológico supone realmente un cambio de juego en la terapia de la obesidad”, afirma el Prof. Reger-Tan. No obstante, se trata de una intervención en el organismo. “Su uso debe realizarse tras un cuidadoso análisis de riesgos y beneficios en el contexto de las indicaciones para las que se aprueban estas sustancias, y debe ir acompañado de una terapia básica multimodal para lograr resultados sostenibles”.
Dos AR GLP-1 y un agonista dual GIP/GLP-1 están aprobados en este país.
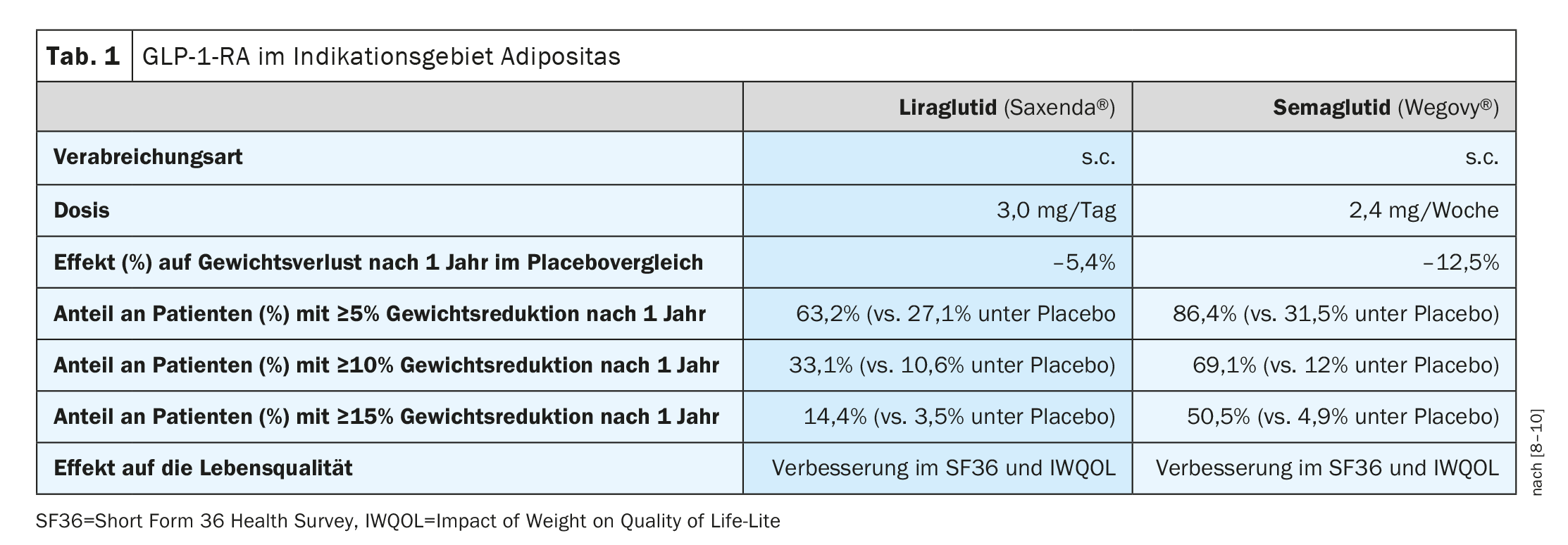
Además de Saxenda® (liraglutida 3 mg), disponible en Suiza desde hace algún tiempo para el tratamiento de la obesidad en pacientes obesos mayores de 12 años, Wegovy® (semaglutida 2,4 mg) también recibió la aprobación de Swissmedic para esta indicación en 2022 (Tab. 1) [7]. Ambas sustancias activas pertenecen al grupo de los agonistas de los receptores del GLP-1 (GLP-1-RA), también conocidos como “incretiniméticos/análogos de la incretina”. Tanto Saxenda® como Wegovy® son análogos de acción prolongada de la incretina GLP-1 que se administran por vía subcutánea. Los efectos de estas sustancias se basan, entre otras cosas, en promover la síntesis y liberación de insulina e inhibir la liberación de glucagón. El vaciado del estómago se retrasa, lo que aumenta la sensación de saciedad. Mientras que Saxenda® es un medicamento aprobado para adultos con obesidad, Wegovy® no está cubierto por el seguro médico en Suiza. Se aplica una limitación temporal para Saxenda® [13] hasta el 30.06.2026. Además de un IMC ≥35 kg/m2 o ≥28 kg/m2 **, se requiere que se coman al menos 500 kcal diarias menos de las que el cuerpo quema de energía (“dieta deficitaria de 500 kcal/día”). Además, los pacientes tienen que demostrar un aumento de la actividad física (por ejemplo, con un podómetro). El tratamiento previo con GLP-1-RA y la cirugía bariátrica previa o prevista se encuentran entre los criterios de exclusión. La prescripción sólo puede ser realizada por especialistas en endocrinología/diabetología y en centros de obesidad. Según la limitación actual [13], Saxenda® no debe combinarse con otros GLP-1-RA, gliptinas, inhibidores de SGLT-2 o insulina. Cuando se utiliza Saxenda® por primera vez, debe conseguirse una reducción de peso de al menos el 5% o el 7% del peso corporal inicial tras 16 semanas de tratamiento.
** o un IMC ≥28 kg/m2 si existen enfermedades concomitantes adicionales relacionadas con el peso, como prediabetes o diabetes mellitus tipo 2, hipertensión arterial o dislipidemia.
| Agonista dual GIP/GLP-1 La tirzepatida (Mounjaro®) es un agonista de los receptores GIP y GLP-1 que se administra una vez a la semana. Se trata de una molécula única que activa los receptores del péptido-1 similar al glucagón (GLP-1) y del polipéptido insulinotrópico dependiente de la glucosa (GIP), ambas hormonas incretinas naturales. Tanto los receptores GIP como los GLP-1 se encuentran en zonas del cerebro humano relevantes para la regulación del apetito. Se ha demostrado que la tirzepatida reduce la ingesta de alimentos y modula el metabolismo de las grasas. Esto dio lugar a una pérdida de peso significativa en estudios de pacientes obesos. Actualmente también se está investigando sobre triagonistas que se dirigen al receptor del glucagón además de a los receptores GIP y GLP-1. |
| a [12,13] |
En 2022 también se aprobó la tirzepatida (Mounjaro®) (recuadro ), un agonista dual GIP/GLP-1. La tirzepatida activa tanto el polipéptido insulinotrópico dependiente de la glucosa (GIP) como los receptores del péptido 1 similar al glucagón (GLP-1). La dosis inicial de tirzepatida es de 2,5 mg una vez a la semana. Después de cuatro semanas, la dosis se aumenta a 5 mg una vez a la semana. Si es necesario, la dosis puede aumentarse en pasos de 2,5 mg, después de al menos cuatro semanas a la dosis actual. La dosis máxima es de 15 mg una vez a la semana. En el programa de ensayos SURPASS, dependiendo de la dosis (5, 10 ó 15 mg), se consiguió una reducción del peso corporal del 7-14,5% con tirzepatida en un plazo de 40 a 52 semanas de tratamiento [11].
Literatura:
- “Obesidad: nueva era en la terapia de pérdida de peso”, Sociedad Alemana de Endocrinología (DGE), 05.09.2023.
- Colaboradores GBDO, et al: Efectos sobre la salud del sobrepeso y la obesidad en 195 países durante 25 años. N Engl J Med 2017; 377: 13-27.
- Pearson-Stuttard J, et al: Carga mundial de cáncer atribuible a la diabetes y al alto índice de masa corporal: una evaluación comparativa del riesgo. Lancet Diabetes Endocrinol 2018; 6:e6-e15.
- “Proyecto sobre inmunometabolismo y microbioma intestinal ” www.udem.insel.ch/de/lehre-und-forschung/
research-focus/adipositas/immunometabolism-and-gut-microbiome-project (última consulta: 09.10.2023) - Nogueiras R, Nauck MA, Tschop MH: Coagonistas de la hormona intestinal para el tratamiento de la obesidad: del banco a la cabecera. Nat Metab 2023; 5: 933-944.
- Ussher JR, Drucker DJ: Agonistas del receptor del péptido 1 similar al glucagón: beneficios cardiovasculares y mecanismos de acción. Nat Rev Cardiol 2023; 20: 463-474.
- Información sobre medicamentos, www.swissmedicinfo.ch (último acceso 09.10.2023)
- Wilding JPH, et al: Semaglutida una vez a la semana en adultos con sobrepeso u obesidad. N Engl J Med 2021; 384(11): 989-1002.
- Pi-Sunyer X, et al: Ensayo aleatorizado y controlado de 3,0 mg de liraglutida en el control del peso. N Engl J Med 2015; 373(1): 11-22.
- Kolotkin RL, et al: Mejoras en la calidad de vida relacionada con la salud durante 3 años con liraglutida 3,0 mg en comparación con placebo en participantes con sobrepeso u obesidad. Clin 2018; 8(1): 1-10.
- Müller TD, Blüher M: Terapia de la obesidad: ¿serán las farmacoterapias la alternativa a la cirugía metabólica? [Tratamiento de la obesidad: ¿reemplazarán las farmacoterapias a la cirugía metabólica en el futuro?] Inn Med (Heidelb) 2023; 64(7): 629-635.
- “Mecanismo de acción de la tirzepatida descifrado”, www.helmholtz-munich.de/newsroom/news/artikel/unraveling-the-mode-of-action-of-tirzepatide (último acceso 10.10.2023)
PRÁCTICA GP 2023; 18(10): 36-37