Con el paso del tiempo, pueden producirse fluctuaciones en el efecto en la terapia del Parkinson con L-dopa. Entonces, el tratamiento de las discinesias y fluctuaciones motoras inducidas por la L-dopa es la tarea más importante en la práctica clínica. Un bloqueo adicional de la COMT puede provocar una prolongación de la semivida de la L-dopa y un aumento de la biodisponibilidad.
Más de 50 años después de su introducción en la práctica clínica habitual, la L-dopa sigue siendo la sustancia más eficaz para controlar los síntomas motores de la enfermedad de Parkinson y continúa siendo uno de los fármacos para el Parkinson mejor tolerados [1,2]. Sin embargo, la terapia crónica a largo plazo con L-dopa se asocia al desarrollo de complicaciones motoras en forma de fluctuaciones del efecto y discinesias inducidas por el fármaco en algunos de los pacientes tratados. La frecuencia de estas complicaciones asociadas a la terapia con L-dopa varía en función de la duración de la enfermedad y de la terapia, de la dosis de L-dopa elegida y de la edad del paciente. En los estudios de terapia controlada, entre el 20 y el 30% de los pacientes desarrollaron complicaciones motoras en los primeros años de terapia, y esta tasa aumenta en la mayoría de las series a largo plazo hasta al menos el 50% tras más de cinco años de tratamiento [3,4]. Las encuestas realizadas a pacientes muestran regularmente que los afectados encuentran más estresantes las fluctuaciones en el efecto con episodios en parte impredecibles de síntomas recurrentes de Parkinson que la inquietud inducida por los fármacos, siempre que estos últimos no alcancen un nivel incapacitante [5]. El tratamiento de las discinesias y fluctuaciones motoras inducidas por -L-dopa sigue siendo una de las tareas más importantes tanto en la práctica clínica como en la investigación terapéutica en la enfermedad de Parkinson.
Fluctuaciones motoras bajo L-dopa – espectro clínico y mecanismos subyacentes
La presentación más común y también a menudo inicial de las fluctuaciones del efecto bajo L-dopa es el retorno de los síntomas parkinsonianos hacia el final de los intervalos de dosificación de un tratamiento en curso con tomas repetidas a intervalos de cuatro o más horas y se denomina fenómeno de “desgaste”. Los pacientes perciben estas disminuciones como un retorno o un aumento de los signos motores clásicos del Parkinson, como el temblor, la rigidez muscular y la inmovilidad, pero también suelen ir acompañadas de síntomas no motores, como sensación de apatía, bloqueo del pensamiento, depresividad, ansiedad o dolor [6]. Esta combinación de movilidad alterada con alteraciones adicionales del bienestar hace que las fases bajas sean especialmente desagradables para los pacientes [7]. Sin un interrogatorio específico sobre la asociación temporal de los síntomas de queja con los momentos de toma de L-dopa, los fenómenos de desgaste pueden escapar a una clasificación correcta, como han demostrado los estudios con cuestionarios de desgaste [8]. En la figura 1 se resumen otras manifestaciones de las fluctuaciones del impacto.
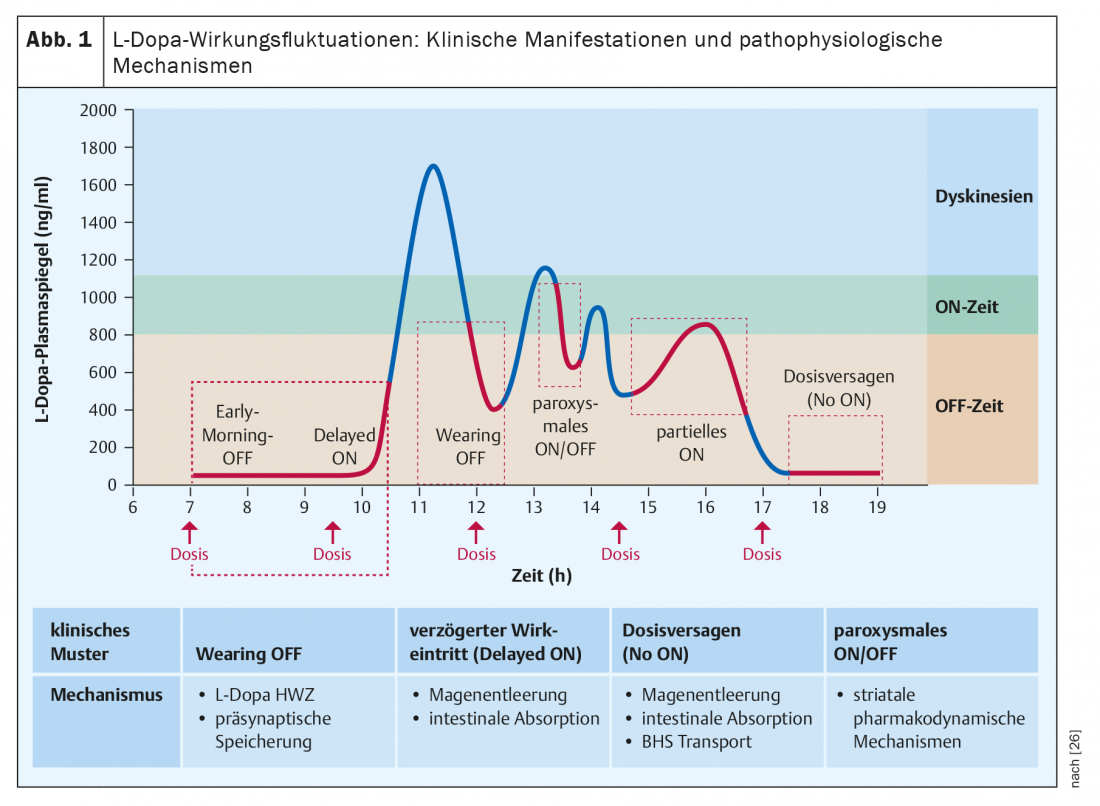
Desde el punto de vista fisiopatológico, la corta semivida (aprox. 90 minutos) de la L-dopa es la principal responsable de las fluctuaciones por desgaste, que provocan cambios regulares en los niveles máximos y mínimos en sangre durante la administración de varias dosis únicas a lo largo del día. Como la capacidad de almacenamiento neuronal de dopamina formada a partir de L-dopa exógena disminuye durante el curso de la enfermedad, estas oscilaciones periféricas también provocan fluctuaciones en la disponibilidad sináptica de dopamina. Fenómenos como el retraso en el inicio de la acción de una dosis oral o incluso la pérdida completa del efecto de una dosis única suelen deberse a una absorción gastrointestinal alterada (retraso del vaciado gástrico, competencia de la absorción intestinal de L-dopa con los aminoácidos de los alimentos), mientras que las caídas repentinas e inesperadas del efecto, aparentemente sin relación con el momento de la ingesta, se basan en cambios farmacodinámicos centrales [9]. (Fig. 1).
Los factores de riesgo más importantes para el desarrollo de fluctuaciones motoras son la duración de la enfermedad, el nivel de la dosis de L-dopa y la edad de los pacientes [10]. Mientras que el aumento del riesgo de complicaciones con la duración de la enfermedad se explica por la pérdida progresiva de neuronas de proyección nigroestriatal y, por tanto, de la capacidad de almacenamiento de dopamina formada a partir de L-dopa exógena, el efecto de la edad (mayor riesgo en pacientes más jóvenes) no se ha aclarado definitivamente. El efecto de la dosis de L-dopa es similar (una mayor dosis por peso corporal corresponde a un mayor riesgo).
Opciones de tratamiento farmacológico para las fluctuaciones motoras
En principio, se dispone de tres clases de fármacos dopaminérgicos para la farmacoterapia oral de pacientes con fluctuaciones del efecto de la L-dopa, así como de antagonistas de los receptores de adenosina A2 para la terapia adyuvante en EE.UU. y Japón. [11] (Tab. 1). Los agonistas de la dopamina (preparados orales estándar, preparados de liberación sostenida y una formulación transdérmica) son capaces de compensar las fluctuaciones en el efecto de la L-dopa debido a su semivida significativamente más larga en comparación con la L-dopa (o la administración continua en el caso de la formulación en parche). El tamaño del efecto de estas terapias adicionales en los estudios clínicos se situó en el rango de una reducción del tiempo de desconexión diario acumulado de dos a tres horas que puede registrarse con los diarios de los pacientes. Los inhibidores de la monoaminooxidasa B (inhibidores de la MAO-B) prolongan el efecto de la L-dopa al bloquear la vía de degradación central de la dopamina liberada sinápticamente y se ha demostrado en ensayos clínicos que reducen el tiempo de desconexión diario en aproximadamente una hora. Los inhibidores de la COMT prolongan el efecto de la L-dopa al alterar la farmacocinética periférica y tienen tamaños de efecto que van desde algo menos de una hora hasta algo menos de dos horas de reducción del tiempo de desconexión. La istradefylina, un inhibidor de los receptores A2 de la adenosina, también está aprobada en Japón y EE.UU. para el tratamiento de la fluctuación de efectos El principio de acción de los antagonistas A2 A consiste en una potenciación de la transducción de señales dopaminérgicas en la denominada vía de proyección indirecta desde el cuerpo estriado al globo pálido. Estudios recientes sobre el tratamiento de la discinesia inducida por L-dopa con una formulación de liberación sostenida de amantadina, ahora aprobada en EE.UU., también han demostrado un efecto de este fármaco no dopaminérgico sobre las fluctuaciones del efecto [12].
Además de las medidas terapéuticas mencionadas, las fases bajas individuales también pueden tratarse con terapias denominadas “a demanda”, como las inyecciones subcutáneas de apomorfina y, más recientemente en EE.UU., también la administración sublingual de apomorfina o la inhalación de L-dopa. Para los pacientes con fluctuaciones refractarias del efecto que no responden satisfactoriamente a todas estas medidas, se dispone tanto de infusiones intestinales de L-dopa como de infusiones continuas subcutáneas de apomorfina [13].
Papel de los inhibidores de la COMT en el tratamiento de las fluctuaciones de efecto
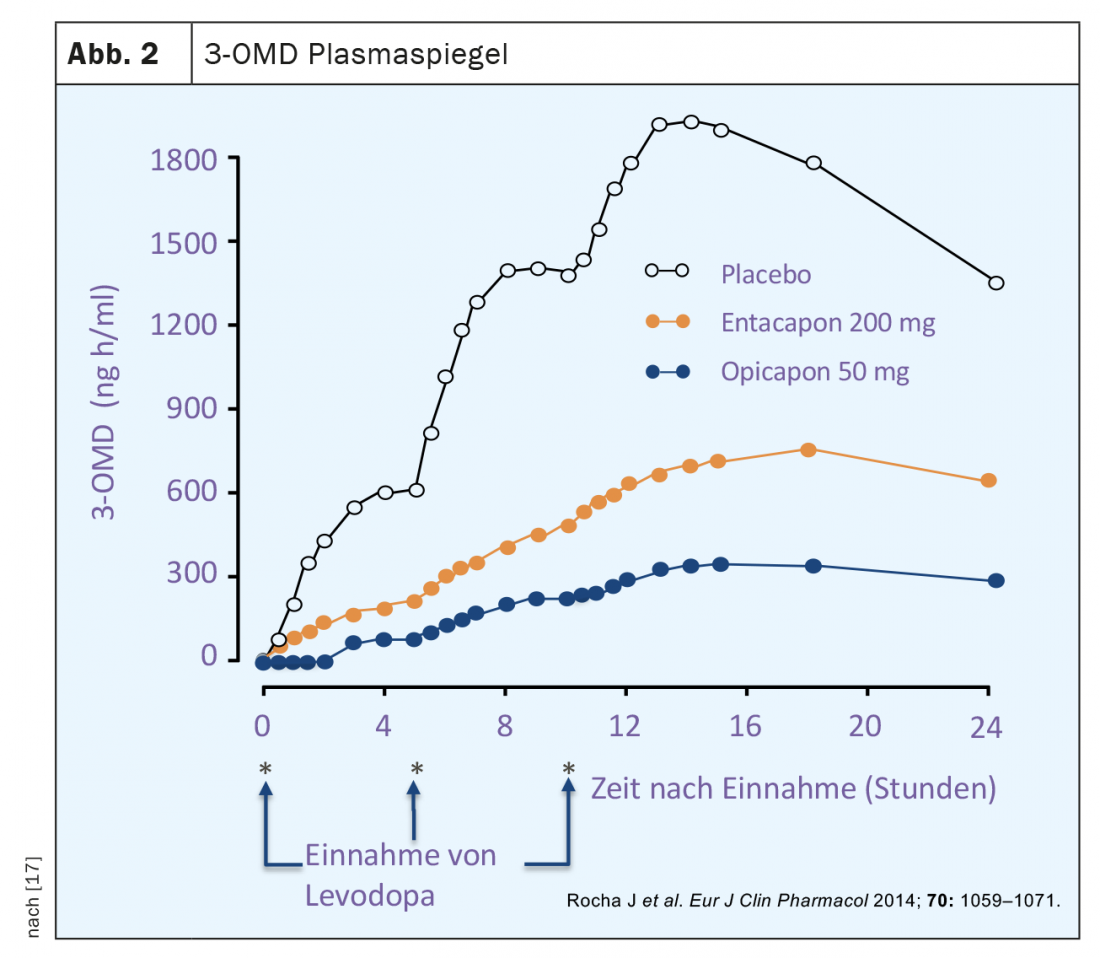
La terapia clásica con L-dopa adopta la forma de preparados combinados de L-dopa con un inhibidor periféricamente activo de la aminoácido aromático descarboxilasa (AADC). De este modo, se impide que la dopamina se produzca a partir de la L-dopa administrada por vía oral en la periferia, especialmente en el hígado. Antes de la introducción de dichos inhibidores, la terapia basada únicamente en L-dopa se asociaba a una necesidad de dosis mucho mayor y también a efectos secundarios dopaminérgicos periféricos, en particular náuseas e hipotensión. Sin embargo, a pesar de la inhibición de la AADC, el metabolismo hepático sigue teniendo lugar con la terapia clásica de L-dopa, que utiliza la vía de degradación menos utilizada a través de la catecol-o-metil transferasa. Esta vía metabólica de la L-dopa conduce a la formación del metabolito principal 3-o-metil-dopa (3-OMD), cuya semivida es significativamente más larga que la de la L-dopa y cuyo nivel en sangre en los pacientes de Parkinson tratados con L-dopa es muchas veces superior al de la L-dopa (Fig. 2).
Un bloqueo adicional de la COMT (doble inhibición enzimática de la AADC y la COMT) conduce a una prolongación de la semivida de la L-dopa, así como a un aumento de la biodisponibilidad [14]. Históricamente, la tolcapona fue el primer inhibidor de la COMT introducido en la terapia del Parkinson, mostrando una eficacia muy buena con una reducción del tiempo de desconexión diario de hasta dos horas, pero tuvo que ser retirada temporalmente del mercado en la UE debido a una hepatotoxicidad grave y ahora sólo se utiliza como fármaco de segunda línea bajo una estrecha vigilancia de la función hepática. El inhibidor de la COMT entacapona, que se aprobó aproximadamente un año después de que se aprobara por primera vez la tolcapona en 1997, está libre de tales efectos hepatotóxicos pero es menos eficaz que la tolcapona [15]. Ambos inhibidores de la COMT de primera generación pueden producir diarrea, lo que obliga a interrumpir el tratamiento en un 3% a 5% de las personas tratadas, y provocar una decoloración de la orina debido al efecto colorante de los metabolitos de estos dos compuestos nitrocatecólicos excretados en la orina [14].
En 2016, se aprobó un nuevo inhibidor selectivo de la COMT de acción periférica, la opicapona, para el tratamiento de las fluctuaciones de los efectos en la UE y también está disponible en Suiza desde 2020.
Farmacología de la opicapona
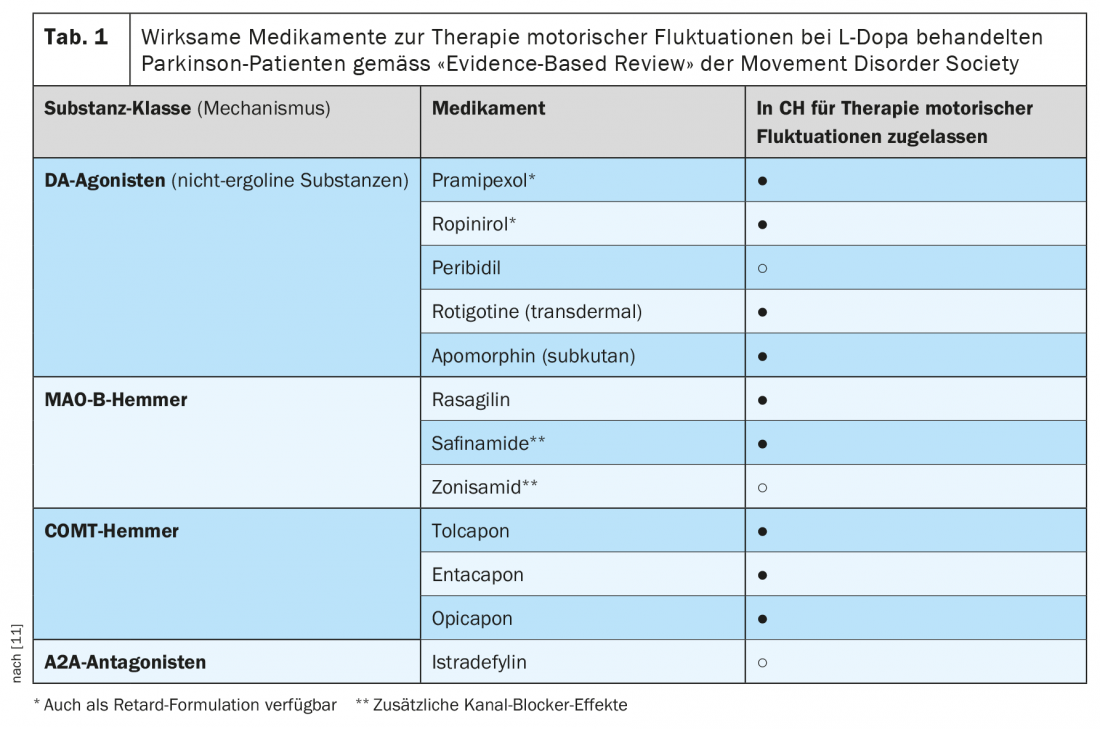
La opicapona es un inhibidor selectivo de acción periférica de la COMT. En comparación con la entacapona, existe una alta afinidad de unión a la enzima y una tasa de disociación más lenta de la opicapona del complejo COMT [16]. Este último requiere una duración de acción mucho más larga en comparación con la entacapona o la tolcapona, con la posibilidad de una dosis diaria de opicapona. Los estudios de la actividad COMT en eritrocitos tanto de voluntarios sanos como de pacientes de Parkinson mostraron una reducción máxima de hasta el 100% y de alrededor del 60% 24 horas después de una dosis única. (Fig. 3). La mayor inhibición de la actividad COMT por la opicapona en comparación con la entacapona también se reflejó en una mayor reducción de los niveles plasmáticos de 3 OMD (Fig. 2). La biodisponibilidad (área bajo la curva, AUC) de una dosis única de L-dopa más un inhibidor de la descarboxilasa aumenta hasta un 35% con la opicapona de forma dependiente de la dosis.La opicapona se convierte principalmente en metabolitos inactivos en el hígado y alrededor del 70% se elimina en las heces por excreción hepatobiliar. En pacientes con insuficiencia hepática moderadamente grave (Child-Pugh B), se producen aumentos significativos de la concentración y la biodisponibilidad de la opicapona en comparación con los individuos sanos, por lo que puede ser necesario ajustar la dosis. Para uso en pacientes con trastornos hepáticos graves (Child-Pugh C), no se dispone de datos y no se recomienda el uso de opicapona en este caso. En Suiza, en general no se recomienda el uso de opicapona en caso de disfunción hepática (Child-Pugh A,B,C) o cirrosis hepática.
Estudios clínicos sobre la eficacia del Opicapone
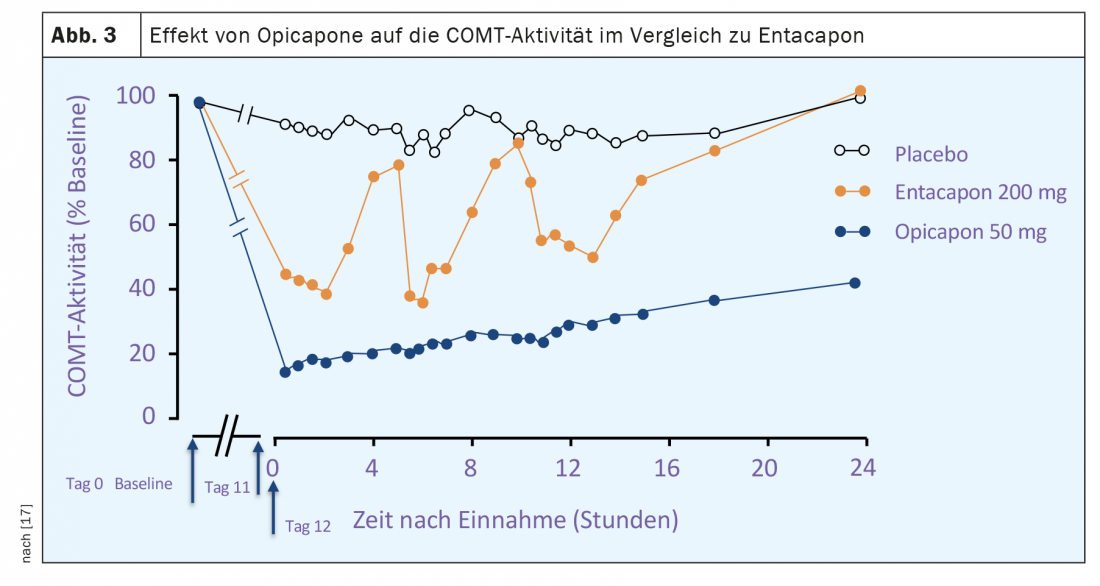
La aprobación de la opicapona para el tratamiento de las fluctuaciones motoras en pacientes con Parkinson tratados con L-dopa se basa en las pruebas de eficacia de dos grandes estudios doble ciego de fase III (BIPARK I y II), que incluyeron un total de más de 1000 pacientes. [18] (Fig. 4). En BIPARK I, se compararon tres dosis de opicapona (5 mg, 25 mg, 50 mg) con placebo y entacapona como comparador activo, mientras que en BIPARK II, se compararon 25 y 50 mg de opicapona con placebo. La mediana de la duración de la enfermedad de los pacientes incluidos era de entre 7 y 8 años y, en el momento de la inclusión en el estudio, la mediana del tiempo de descanso diario era de aproximadamente seis horas. El criterio de valoración primario de ambos estudios fue el cambio en el tiempo de descanso diario entre la inclusión en el estudio y el final de la fase de tratamiento doble ciego tras 15 semanas. Los análisis secundarios determinaron la prolongación de la puntualidad en el mismo periodo, los cambios en los porcentajes de puntualidad y de puntualidad, el número de los llamados respondedores de puntualidad con reducción de al menos una hora y de respondedores de puntualidad con prolongación de al menos una hora. Además, se evaluaron las valoraciones globales de los cambios en la EP por parte de los investigadores y los pacientes, así como las escalas de calidad de vida (PDQ-39).
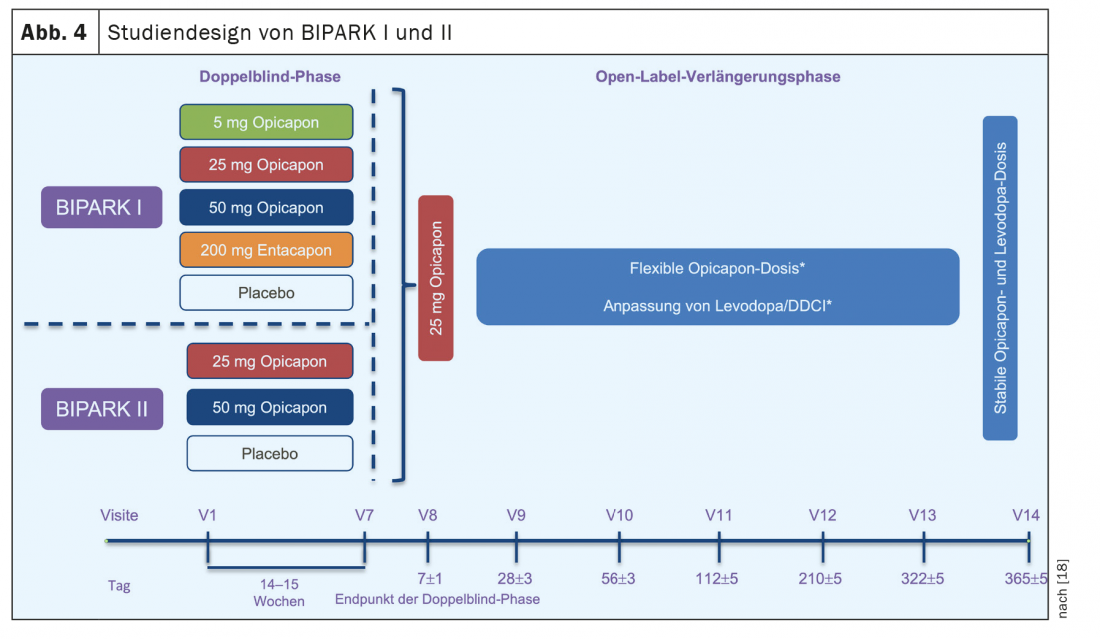
Los resultados del estudio en relación con el criterio de valoración primario de BIPARK I y BIPARK II se muestran en la figura 5. La reducción media del tiempo de desconexión con 50 mg de opicapona fue de algo menos de dos horas y fue numéricamente mayor que en el brazo de tratamiento con entacapona (1,6 h). Sin embargo, la comparación entre opicapona y entacapona en BIPARK I sólo se diseñó para demostrar la no inferioridad; no se pudo demostrar una superioridad estadísticamente significativa de la opicapona en el diseño elegido. El efecto placebo fue similar en ambos estudios (aproximadamente una hora) y los cambios en el tiempo de inicio se reflejaron en la reducción del tiempo de finalización en ambos estudios (1,4 y 1,8 horas, respectivamente, para 50 mg de opicapona en comparación con 0,8 horas para el placebo).

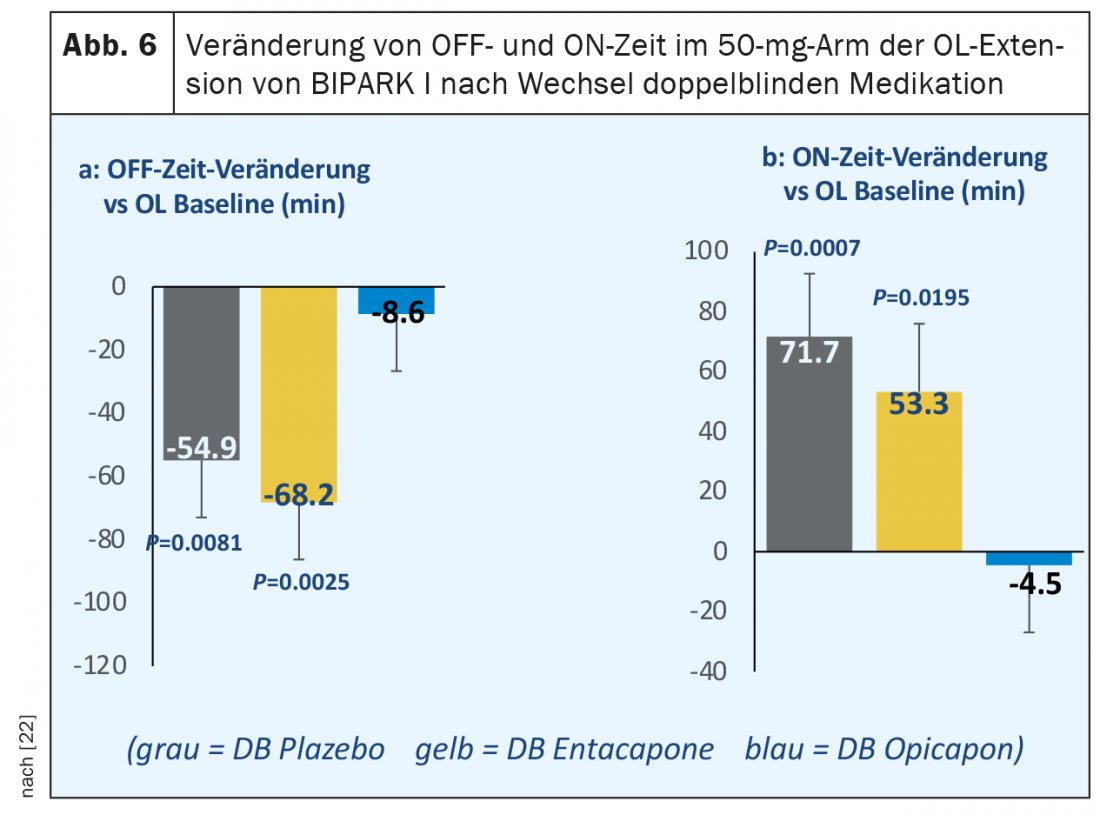
Tras la finalización de la fase doble ciego de tres meses de BIPARK I y BIPARK II, se ofreció a los pacientes la continuación del tratamiento abierto con opicapona en una fase de extensión de un año. Aquí, todos los pacientes recibieron inicialmente 25 mg de opicapona una vez al día con la posibilidad de ajustar la dosis en el curso. Los hallazgos más significativos de estos estudios de extensión fueron la persistencia del efecto sobre la reducción del tiempo off y la prolongación del tiempo on en aquellos pacientes que ya habían sido tratados con opicapona en la fase doble ciego. En el estudio de extensión BIPARK I, también se observó una mejora adicional estadísticamente significativa en el tiempo de desconexión diario absoluto de 40 minutos tras pasar del tratamiento doble ciego con entacapona al tratamiento abierto con 50 mg de opicapona [22]. En un análisis post hoc de este estudio de extensión de etiqueta abierta, los efectos fueron aún más sorprendentes en un subgrupo de 122 pacientes tratados con 50 mg de opicapona hasta el final del estudio, con una reducción aproximada de 70 minutos del tiempo off en comparación con el tratamiento doble ciego con entacapona y una ganancia de 53 minutos del tiempo on sin discinesias angustiosas. (Fig. 6). Otro análisis post-hoc determinó la proporción de pacientes que mostraron una reducción de las horas de descanso diarias o un aumento de las horas de actividad diarias de al menos dos horas desde el inicio hasta el final del estudio (los llamados “superrespondedores”) en la fase doble ciego de BIPARK I y BIPARK II con 50 mg de opicapona. De un total de 265 pacientes en ambos estudios combinados, 100 (37%) cumplían este criterio (Antonini et al., póster EAN 2020).
Tolerabilidad de la opicapona en ensayos clínicos
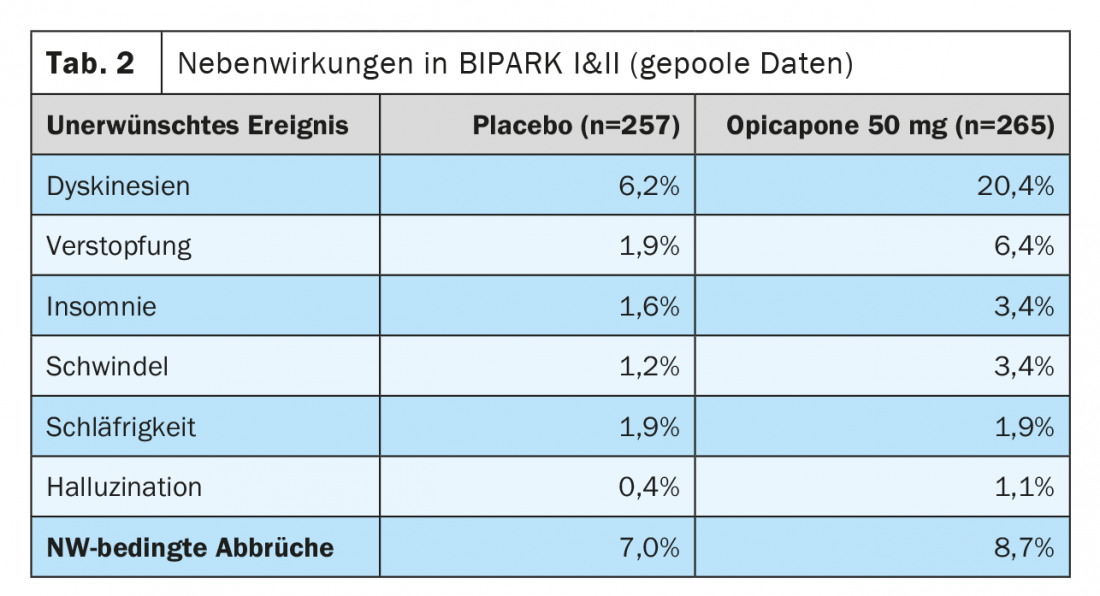
Los acontecimientos adversos más frecuentes de la opicapona en los estudios resumidos anteriormente fueron la discinesia, que se produjo en el 16% en el brazo de dosificación de 50 mg (BIPARK I) y el 24% (BIPARK II) en comparación con el 4% y el 8% en los brazos de placebo de los dos estudios (Tabla 2). Aproximadamente el 6% de los pacientes de BIPARK I y BIPARK II que tomaban 50 mg de opicapona informaron de estreñimiento, mientras que no se notificó ningún caso de diarrea clínicamente relevante ni de decoloración de la orina. Del mismo modo, en los estudios BIPARK I y II (incluidos los estudios de extensión de etiqueta abierta), no hubo pruebas de toxicidad hepática ni diferencias en las interrupciones del estudio relacionadas con efectos secundarios entre la opicapona y el placebo [18,23,24].
Uso de la opicapona en la práctica clínica
La dosis diaria recomendada de opicapona es de 50 mg y debe tomarse como dosis única una hora antes o después de una dosis de L-dopa. La ingesta simultánea de preparados de L-dopa y Opicapone puede provocar un aumento significativo de la tasa de absorción de L-dopa, por lo que desde un punto de vista pragmático se recomienda tomar Opicapone antes de acostarse, lo que suele facilitar el intervalo de una hora hasta la última dosis diaria. Un cambio de un tratamiento previamente existente con Entacapona o Tolcapona a Opicapona puede realizarse en 24 horas sin una fase de “lavado”, ya que la inhibición de la COMT de los dos preparados dura menos de 24 horas. Aunque hasta ahora no se han observado algunos de los efectos secundarios limitantes de la entacapona o la tolcapona (diarrea, decoloración urinaria o hepatotoxicidad en la tolcapona), la opicapona también puede causar efectos secundarios dopaminérgicos al aumentar la biodisponibilidad de la L-dopa. Lo más habitual es la inducción o exacerbación de la discinesia inducida por fármacos, que normalmente puede corregirse reduciendo la dosis diaria de L-dopa o las terapias dopaminérgicas concomitantes, como los inhibidores de la MAO-B o los agonistas dopaminérgicos. En los pacientes que ya presentan discinesias funcionalmente relevantes antes de la adición de Opicapone, puede considerarse una reducción de la dosis de L-dopa en un 20-30% simultáneamente al inicio del tratamiento. En este caso, sin embargo, un control a corto plazo (en la consulta o por teléfono) debería comprobar si se ha producido un deterioro del estado parkinsoniano como consecuencia de la reducción, y deberían realizarse nuevos ajustes si fuera necesario. También existe un mayor riesgo de efectos dopaminérgicos adversos tras la adición de opicapona en pacientes con disfunción cognitiva clínicamente relevante, especialmente con antecedentes de alucinosis o confusión inducida por fármacos. También en este caso son necesarios controles a corto plazo, así como ajustes de la medicación en caso necesario (reducción de la dosis de dopaminérgicos, adición de quetiapina o clozapina).
Un estudio observacional reciente de 495 pacientes en un entorno de práctica clínica mostró una tasa global de interrupción del tratamiento debido a efectos secundarios del 17% en los primeros tres a seis meses. La discinesia se produjo en el 11%, pero sólo fue motivo de interrupción del tratamiento en el 1% [25]. En cambio, la proporción de pacientes que se asignaron a sí mismos uno de los tres grados de mejoría (de poco a mucho mejor) en la escala de autoevaluación (‘Patient Global Impression of Change’, P-GIC) tras 3 meses de tratamiento con opicapona fue del 77% (48% “mucho” o “muchísimo” mejor).
Resumen
La adición de inhibidores de la COMT es una estrategia eficaz para mejorar las fluctuaciones motoras en tratamiento continuo con L-dopa, como han demostrado numerosos estudios de alta calidad [11]. La entacapona y la opicapona se encuentran entre los fármacos de primera elección en esta indicación, mientras que la tolcapona es un fármaco de segunda elección debido a su hepatotoxicidad. La inhibición farmacológica de la COMT es el único enfoque en la terapia farmacológica del Parkinson que modifica directamente uno de los factores patogenéticos más esenciales para el desarrollo de las fluctuaciones del efecto: la corta vida media de la L-dopa. Esto hace que la administración combinada de L-dopa e inhibidores de la COMT en pacientes con estas complicaciones motoras sea un enfoque racional que debe utilizarse precozmente. Por razones teóricas, incluso se ha postulado que una combinación con un inhibidor de la COMT ya utilizado al inicio del tratamiento con L-dopa podría conducir a la prevención de complicaciones motoras – sin embargo, un único estudio que lo ha investigado hasta ahora encontró efectos negativos en términos de discinesias más rápidas y frecuentes en el transcurso de hasta cuatro años. [10].
Hasta ahora, la terapia con inhibidores de la COMT se ha visto limitada por la toxicidad de la tolcapona, muy eficaz, y el efecto más débil de la entacapona en comparación con la tolcapona. Además, se produjeron reacciones de intolerancia intestinal con diarrea grave y decoloración indeseable de la orina causada por ambas sustancias. Con la opicapona, se dispone de un nuevo representante altamente eficaz de esta clase, que presenta varias ventajas: el efecto inhibidor sobre la COMT es significativamente más fuerte que el de la entacapona, lo que también se ha reflejado en unos efectos numéricamente mayores sobre la reducción diaria del tiempo OFF en los ensayos clínicos en comparación con la entacapona. La duración de la inhibición de la COMT por la opicapona es duradera, lo que permite una dosificación una vez al día, y en los ensayos clínicos no se han observado diarrea ni decoloración de la orina. Esto debería impulsar el uso de inhibidores de la COMT en el tratamiento de las fluctuaciones del efecto, pero teniendo en cuenta que la potenciación de los efectos de la L-dopa también puede provocar efectos secundarios dopaminérgicos. La discinesia es la más común, pero casi siempre puede controlarse reduciendo la dosis de L-dopa. Los “efectos de ahorro” de la L-dopa mediante la adición de inhibidores potentes de la COMT, como la opicapona, también pueden utilizarse en la práctica para evitar un aumento de la frecuencia de dosificación de L-dopa.
La inhibición de la COMT es un enfoque racional para optimizar la ingesta de L-dopa en pacientes con EP con fluctuaciones en el efecto, que también resulta útil y eficaz en combinación con otras clases de fármacos (Tab. 1) . Un requisito previo para el tratamiento oportuno es el diagnóstico clínico a tiempo de las fluctuaciones de desgaste, que sólo es posible con tiempo suficiente para el interrogatorio específico de los pacientes y, si es necesario, de los familiares o cuidadores.
Mensajes para llevarse a casa
- Más de la mitad de los pacientes de Parkinson tratados con L-dopa desarrollan fluctuaciones motoras (on-off fluctuations) en el curso a largo plazo. Las fases bajas son especialmente desagradables para los afectados debido a la combinación de síntomas motores y no motores, pero las fluctuaciones de “desgaste” se pasan por alto fácilmente en la práctica sin un interrogatorio específico.
- La corta vida media de la L-dopa conduce a fluctuaciones del nivel sanguíneo dependientes de la dosis y es un factor central en la patogénesis de las fluctuaciones del efecto bajo L-dopa Los inhibidores de la COMT interfieren en el metabolismo periférico de la L-dopa y conducen a prolongaciones de la vida media y la biodisponibilidad. Por lo tanto, son fármacos de primera elección para reducir las fluctuaciones del efecto bajo L-dopa.
- La opicapona es un nuevo inhibidor de la COMT de acción periférica con una larga duración de acción y la opción de una dosis diaria. El efecto inhibidor sobre la COMT es más fuerte en comparación con la entacapona y los ensayos clínicos han mostrado reducciones numéricamente mayores del tiempo diario OFF.
- La opicapona presenta ventajas sobre los anteriores inhibidores de la COMT en cuanto a la ausencia de inducción de diarrea o decoloración de la orina. El efecto secundario más importante del Opicapone para la práctica es una posible potenciación de las discinesias inducidas por la L-dopa, por lo que puede ser necesario reducir la dosis de L-dopa.
- La adición de inhibidores de la COMT es una medida farmacológica racional y obvia para optimizar la farmacocinética de la L-dopa cuando se producen fluctuaciones del efecto.

Literatura:
- Djamshidian A, Poewe W: Apomorfina y levodopa en la enfermedad de Parkinson: dos fármacos revolucionarios de los años 50. Parkinsonism Relat Disord 2016; S9-S12.
- LeWitt PA, Fahn S: Terapia con levodopa para la enfermedad de Parkinson: una mirada hacia adelante y hacia atrás. Neurología 2016; 86: S3-S12
- Ahlskog JE, Muenter MD: Frecuencia de las discinesias y fluctuaciones motoras relacionadas con la levodopa según la estimación de la literatura acumulada. Mov Disord 2001; 16: 448-458.
- Chaudhuri RK, Poewe W, Brooks D: Complicaciones motoras y no motoras de la levodopa: fenomenología, factores de riesgo y características de imagen. Mov Disord. 2018;33: 909-919.
- Hung SW, Adeli GM, Arenovich T, et al: Percepción del paciente de la discinesia en la enfermedad de Parkinson. J Neurol Neurosurg Psychiatry 2010;81: 1112
- Chou KL, Stacy M, Simuni T, et al: El espectro del “off” en la enfermedad de Parkinson: ¿Qué hemos aprendido en 40 años? Parkinsonismo y trastornos relacionados 2018; 51: 9-16.
- Politis M, Wu K, Molloy S, et al: Síntomas de la enfermedad de Parkinson: la perspectiva del paciente. Mov Disord. 2010;25: 1646-1651.
- Stocchi F, Antonini A, Barone P, grupo de estudio DEEP, et al: Early DEtection of wEaring off in Parkinson disease: the DEEP study. Parkinsonism Relat Disord. 2014 feb;20(2): 204-211.
- Poewe W, Antonini A, Zijlmans JC, et al: Levodopa en el tratamiento de la enfermedad de Parkinson: un viejo fármaco que sigue fuerte. Clin Interv Aging. 2010 Sep 7;5: 229-238
- Olanow CW, Kieburtz K, Rascol O, et al: por los investigadores de STRIDE-PD. Factores predictivos del desarrollo de discinesia inducida por levodopa y desgaste en la enfermedad de Parkinson. Mov Disord 2013; 28: 1064-1071.
- Fox SH, Katzenschlager R, Lim SY, et al: International Parkinson and movement disorder society evidence-based medicine review: Actualización de los tratamientos para los síntomas motores de la enfermedad de Parkinson. Mov Disord. 2018;33: 1248-1266.
- Pahwa R, Tanner CM, Hauser RA, et al: ADS-5102 (Amantadine) Extended-Release Capsules for Levodopa-Induced Dyskinesia in Parkinson Disease (EASE LID Study): Un ensayo clínico aleatorizado. JAMA Neurol. 1 de agosto de 2017;74(8): 941-949.
- Aradi SD, Hauser RA: Manejo médico y prevención de las complicaciones motoras en la enfermedad de Parkinson. Neuroterapéutica. 2020 ago 5. doi: 10.1007/s13311-020-00889-4
- Müller T: Inhibidores de la catecol-O-metiltransferasa en la enfermedad de Parkinson. Drogas. 2015 Feb;75(2): 157-74.
- Lees AJ: Comparación de la eficacia basada en la evidencia de la tolcapona y la entacapona como terapia adyuvante en la enfermedad de Parkinson. CNS Neurosci Ther. 2008 ;14(1): 83-93.
- Scott LJ: Opicapona: una revisión en la enfermedad de Parkinson. Drogas. 2016 Sep;76(13): 1293-1300.
- Rocha JF, Falcão A, Santos A, et al: Efecto de la opicapona y la entacapona sobre la farmacocinética de la levodopa durante tres administraciones diarias de levodopa. Eur J Clin Pharmacol. 2014 Sep;70(9): 1059-1071.
- Fabbri M, Ferreira JJ, Lees A, et al: Opicapona para el tratamiento de la enfermedad de Parkinson: Revisión de un nuevo medicamento autorizado. Mov Disord. 2018 Oct;33(10): 1528-1539.
- Lees AJ, Ferreira J, Rascol O, et al: Opicapone as Adjunct to Levodopa Therapy in Patients with Parkinson Disease and Motor Fluctuations: A Randomized Clinical Trial. JAMA neurología. 2017;74(2): 197-206.
- Ferreira JJ, Lees A, Rocha JF, et al: Investigadores de Bi-Park 1. Opicapona como complemento de la levodopa en pacientes con enfermedad de Parkinson y fluctuaciones motoras al final de la dosis: un ensayo aleatorizado, doble ciego y controlado. Lancet Neurol. 2016 Feb;15(2): 154-165
- Ferreira JJ, Lees A, Rocha JF, et al: Eficacia a largo plazo de la opicapona en pacientes con enfermedad de Parkinson fluctuante: un análisis conjunto de los datos de dos ensayos clínicos de fase 3 y sus extensiones de etiqueta abierta. Eur J Neurol. 2019 Jul;26(7): 953-960.
- Ferreira JJ, Lees A, Poewe W, et al: Eficacia de la opicapona y cambio de la entacapona en la enfermedad de Parkinson fluctuante. Neurología 2018; 90: e1849-e1857
- Lees A, Ferreira JJ, Rocha JF, et al: Perfil de seguridad de la opicapona en el tratamiento de la enfermedad de Parkinson. J Parkinsons Dis. 2019;9(4): 733-740.
- Scott LJ. Opicapona: Una revisión en la enfermedad de Parkinson. Fármacos del SNC. 2021 Ene;35(1): 121-131.
- Reichmann H, Lees A, Rocha JF, et al: Investigadores de OPTIPARK. Eficacia y seguridad de la opicapona en pacientes con enfermedad de Parkinson con fluctuaciones motoras: el estudio abierto OPTIPARK. Transl Neurodegener. 2020 Mar 4;9: 9.
- Poewe W, Deuschl G, Seppi K, et al: Enfermedad de Parkinson – terapia. En: G.Deuschl, WH Oertel, W Poewe: Síndromes de Parkinson y otros trastornos del movimiento, 2ª edición, Thieme Stuttgart, 2020, 109-157.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2021; 19(2). Publicado el 17.3.21 (antes de impresión)