La modulación de los receptores S1P es una importante e interesante diana terapéutica en el tratamiento de la esclerosis múltiple debido a su diversidad funcional. En la actualidad, se dispone de tres moduladores del receptor de S1P para pacientes con EMRR y uno para pacientes con EMPS. Ninguno de los moduladores del receptor S1P mostró un efecto negativo sobre la cognición y la fatiga.
La esclerosis múltiple (EM) es una enfermedad neurológica común que provoca desmielinización y daño axonal a través de la inflamación crónica inmunomediada del sistema nervioso central (SNC) [1]. La mayoría de los afectados (aproximadamente el 85%) presentan inicialmente un curso remitente-recurrente (EMRR), que en el transcurso de la enfermedad se transforma en una fase secundaria crónica progresiva [2]. La EMRR se define por recaídas con síntomas clínicos nuevos o crecientes. A esto le siguen fases de remisión parcial o completa. Durante las fases de remisión, la progresión de la enfermedad no es evidente [1,2].
El diagnóstico de la EM requiere pruebas objetivas de un acontecimiento inflamatorio en el SNC y pruebas adicionales de una propagación espacial y temporal del proceso de la enfermedad (diseminación en el espacio y el tiempo). Las pruebas paraclínicas más importantes para confirmar el diagnóstico son la resonancia magnética (RM) y el examen del líquido cefalorraquídeo (LCR) [3].
Actualmente existe un consenso en que las recaídas por sí solas no son significativas en términos del proceso de la enfermedad y su desarrollo. Por lo tanto, el número de recaídas ofrece poca información sobre la cantidad de daño estructural y funcional realmente presente. Además, la pérdida de volumen cerebral, que puede producirse muy pronto en el curso de la enfermedad, no está necesariamente asociada a la actividad de empuje. Desde una perspectiva patológica, el daño tisular activo en la EM está asociado a la inflamación. Además, es probable que otros mecanismos, como el estrés oxidativo que conduce al daño mitocondrial, estén implicados en la inducción de la desmielinización y la neurodegeneración tanto en la fase recidivante como en la progresiva de la EM [4]. Dado que ni la fase RR ni la progresiva de la EM presentan características patológicas o mecanicistas distintivas, las diferencias cuantitativas más que cualitativas entre estas fases parecen ser las responsables del fenotipo predominante resultante [4,5]. En la actualidad, la terapia moderna de la EM tiene como objetivo el diagnóstico precoz y el uso temprano de fármacos modificadores de la progresión para influir lo más favorablemente posible en la evolución de la discapacidad en una fase temprana [1,2,6].
Fatiga y problemas cognitivos
Sin embargo, no es sólo la progresión física de la discapacidad lo que plantea grandes retos a los pacientes afectados y a los médicos que los tratan. En la vida cotidiana, se trata principalmente de síntomas como la fatiga y los problemas cognitivos. Se calcula que entre el 75 y el 95% de todos los pacientes con EM sufren fatiga y entre el 40 y el 50%, deterioro cognitivo [7]. Ambos síntomas tienen graves efectos sobre la participación social, la capacidad laboral y la calidad de vida en general [7,8]. Es importante incluir los síntomas mencionados en la evaluación de la progresión y registrarlos regularmente, una vez al año, con instrumentos sensibles, independientemente de la EDSS [9]. Esto permite evaluar al individuo respectivo en el curso longitudinal. En cuanto a la cognición, existen pruebas de que los pacientes que ya muestran anomalías cognitivas en el momento del diagnóstico tienen un mayor riesgo de sufrir una patología agresiva con una progresión grave de la discapacidad [10]. De ello podría derivarse desde el principio un algoritmo terapéutico mejor adaptado al caso individual.
Dado que la fatiga es el síntoma que, junto con los trastornos cognitivos, es responsable de la jubilación anticipada y la invalidez, al elegir la inmunoterapia hay que tener cuidado de no utilizar fármacos que previsiblemente intensifiquen los síntomas.
Terapias modificadoras del curso
Las opciones de tratamiento modificadoras de la enfermedad se conocen como terapias modificadoras de la enfermedad (TME) y pueden administrarse en forma de comprimidos, cápsulas, inyecciones o infusiones. El objetivo es reducir tanto la tasa anual de recaídas como la progresión. Existen preparados con diferentes modos de acción. En este trabajo, nos centramos en los moduladores del receptor S1P. En Suiza, cuatro preparados de esta clase de fármacos están aprobados actualmente – fingolimod, ozanimod y ponesimod para la EMRR, siponimod como único modulador del receptor S1P para pacientes con EMPS [11–14].
Receptores de esfingosina-1-fosfato
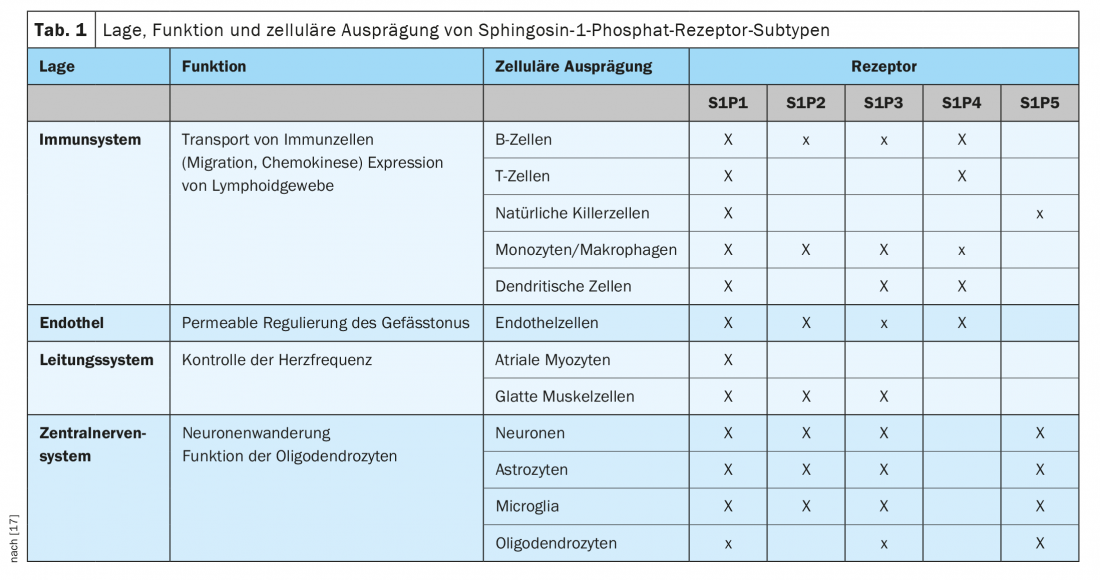
Las esfingosinas son componentes estructurales de la membrana celular a partir de los cuales se forman muchos lípidos bioactivos, como la S1P. Se trata de un metabolito lipídico bioactivo multifuncional que actúa como molécula soluble de señalización y circula por la sangre y el sistema linfático [15]. La S1P interviene en diversos procesos fisiológicos y fisiopatológicos a través de su interacción con los receptores de S1P, que son receptores de superficie celular acoplados a proteínas G de alta afinidad que se encuentran en todo el organismo [16].
La S1P tiene afinidad de unión por cinco subtipos diferentes de receptores de S1P a través de los cuales se transducen las señales celulares. Los receptores S1P1, S1P2 y S1P3 se expresan de forma ubicua, y cada subtipo tiene una especificidad celular diferente. En cambio, la expresión de los receptores S1P4 y S1P5 está menos extendida. Los receptores S1P4 están restringidos al tejido linfoide y hematopoyético y los receptores S1P5 se encuentran en el bazo y en la sustancia blanca del SNC, principalmente en los oligodendrocitos (Tab. 1) [17].
En consecuencia, los receptores de S1P intervienen en muchas funciones biológicas, como la proliferación celular, la angiogénesis, la organización del citoesqueleto, la quimiotaxis de las células endoteliales, el transporte de células inmunitarias y la mitogénesis. También desempeñan un papel en el desarrollo del cerebro y el corazón, la proliferación de las células de la piel, la permeabilidad vascular y la regulación del tono vascular y bronquial [18]. Esta diversidad funcional hace de la modulación de los receptores de S1P una interesante e importante diana terapéutica.
El desarrollo de moduladores del S1PR
Los moduladores de los receptores de S1P pueden actuar tanto como antagonistas funcionales como agonistas tradicionales, dependiendo del subtipo o subtipos de receptores de S1P a los que se dirijan, y pueden tener una especificidad variable [19]. Se trata de pequeñas moléculas para administración oral. El principal mecanismo inmunológico de los moduladores del receptor S1P se basa en la regulación de la migración de linfocitos mediante la interacción con el receptor S1P1. Este mecanismo se basa en un gradiente de concentración de S1P, que es fisiológicamente más elevado en la sangre que en los tejidos linfáticos. Cuando el ligando se une al receptor en las células que expresan el receptor 7 de quimioquinas con motivo C-C (CCR7), el receptor S1P1 se internaliza y se degrada, lo que provoca una pérdida de capacidad de respuesta al gradiente de S1P. En consecuencia, los linfocitos se retienen en el timo y en los órganos linfoides secundarios, lo que da lugar a un menor número de linfocitos en la sangre periférica y limita la migración de las células inflamatorias [20].
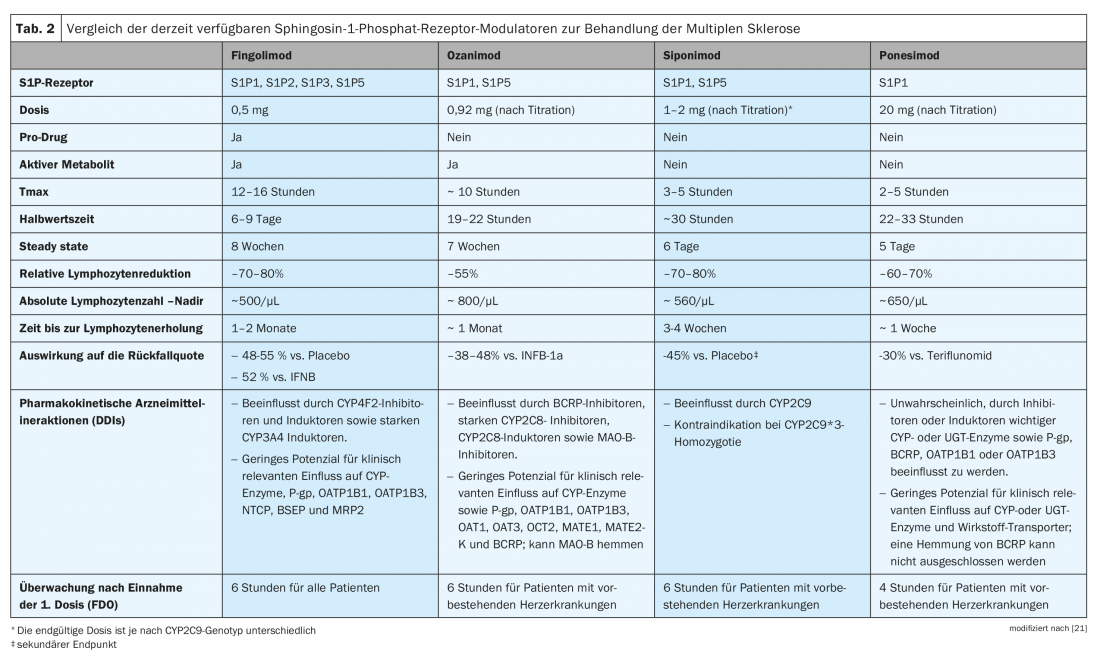
Algunos de los moduladores del receptor S1P actúan como profármacos (fingolimod) que requieren fosforilación u otros pasos metabólicos para convertirse en el compuesto farmacológicamente activo, mientras que otros son fármacos directamente activos (siponimod, ozanimod, ponesimod). Por lo tanto, a pesar de un mecanismo de acción comparable, los moduladores del S1PR tienen propiedades farmacocinéticas diferentes (Tab. 2) [21]. Por lo tanto, para tomar una decisión terapéutica a medida, es esencial considerar los preparados de la clase de sustancia activa de forma diferenciada.
Los moduladores S1PR de un vistazo
El fingolimod (FTY) fue el primer modulador de S1PR aprobado para la terapia de la EMRR. El profármaco clorhidrato de fingolimod es fosforilado estereoselectivamente al metabolito activo (S)-fingolimod fosfato principalmente en el hígado por la esfingosina quinasa-2 (SphK-2). Se trata de un análogo de la S1P. La modulación de los receptores conduce a una regulación a la baja de los receptores en la superficie celular y reduce la sensibilidad al ligando endógeno. De este modo, bloquea la salida de linfocitos de los ganglios linfáticos al torrente sanguíneo periférico y reduce el número de linfocitos en la sangre a un 20-30% del valor inicial. Dado que la activación del S1PR3 puede provocar un efecto agonista inicial en las células cardiacas, causando bloqueos auriculoventriculares (AV), debe realizarse una evaluación exhaustiva antes de iniciar la terapia. El paciente debe ser evaluado para detectar bradicardia, QT largo, bloqueo AV y otros factores de riesgo de arritmia y ser monitorizado durante seis horas después de la primera administración. -Además, deben excluirse las afecciones preexistentes. Deben controlarse constantemente las enzimas hepáticas, el recuento sanguíneo y la presión arterial. Si los linfocitos descienden por debajo de 200/ml, está indicada una interrupción del tratamiento. Los niveles elevados de enzimas hepáticas podrían tratarse con una reducción de la dosis a fingolimod cada dos días. Sin embargo, esto puede reducir su eficacia. Especialmente en los pacientes más jóvenes y en los pacientes a los que se les ha cambiado el natalizumab, existe un riesgo de efectos rebote con un mayor riesgo de recaídas y actividad radiológica [22,23].
Los datos de un estudio que comparaba fingolimod con placebo o interferón beta 1a mostraron una reducción de las recaídas de alrededor del 50% y una reducción del desarrollo de lesiones cerebrales nuevas o que aumentaban de tamaño del 74% en [24–26]. Además, se demostró una influencia favorable en el rendimiento cognitivo, medido con el PASAT-3, con fingolimod en comparación con placebo [27]. Sin embargo, también se ha descubierto que el modulador S1PR aumenta el riesgo de infecciones por herpesvirus y criptococos, riesgo que aumenta con una mayor duración del tratamiento y una edad más avanzada [28]. Otras complicaciones potencialmente graves pueden ser lesiones hepáticas con elevación de las transaminasas, cáncer de piel como el carcinoma basocelular y complicaciones oculares (por ejemplo, edema macular, hemorragia retiniana y oclusión de la vena retiniana).
El siponimod fue aprobado en Suiza en 2020 para el tratamiento del síndrome clínicamente aislado, la esclerosis múltiple remitente-recurrente y la esclerosis múltiple secundaria progresiva activa [29,30]. Este inhibidor del S1PR se une selectivamente a los subtipos S1PR1 y S1PR5. De este modo, el principio activo impide la migración de linfocitos desde los ganglios linfáticos y reduce la recirculación de células T hacia el sistema nervioso central (SNC) para limitar la inflamación en el SNC. La hipótesis en la que se basa supone menos efectos fuera del objetivo que con el fingolimod [30]. De forma análoga al fingolimod, deben comprobarse las afecciones preexistentes, como enfermedades oculares, del ritmo cardiaco y hepáticas graves, y actualizarse el estado de vacunación (por ejemplo, varicela). Otras posibles complicaciones asociadas a la inmunosupresión inducida incluyen un mayor riesgo de infecciones y cáncer de piel. Los posibles efectos secundarios al inicio de la terapia (por ejemplo, bradicardia, bloqueo AV) pueden reducirse con la ayuda de un esquema de titulación. Esto prevé la administración de 0,25 mg/día los días 1 y 2, seguido de 0,5 mg el día 3, 0,75 mg el día 4, 1,25 mg el día 5, seguido de una dosis de mantenimiento de 2 mg diarios. Debe tenerse en cuenta que el siponimod se metaboliza principalmente por el CYP2C9. Una variante menos común de esta enzima (CYP2C9*3) tiene una actividad metabolizadora reducida. Por este motivo, los heterocigotos para CYP2C9*3 deben recibir la mitad de la dosis de mantenimiento, mientras que la homocigosis es una contraindicación para el tratamiento con siponimod [32].
En comparación con el placebo, a los 6 meses se observó una reducción del número de lesiones con realce de contraste en ponderación T1 y de lesiones T2 nuevas o de nuevo agrandamiento (84% para siponimod 10 mg, 80% para siponimod 2 mg y 58% para siponimod 0,5 mg) [30]. Además, también se ha demostrado una reducción significativa de la progresión de la discapacidad en pacientes con EMPS [29]. En particular, los enfermos más jóvenes, los que tienen una EDSS más baja al inicio, una menor duración de la enfermedad al inicio y signos de actividad inflamatoria aguda responden bien al tratamiento [31].
También cabe destacar que los pacientes que recibieron tratamiento con siponimod mostraron un beneficio en la velocidad de procesamiento de la información medida por el SDMT. Esto demostró no sólo un retraso del deterioro cognitivo, sino también una mejora cognitiva clínicamente relevante en un plazo de 6 meses [33].
El ozanimod también ha sido aprobado para el tratamiento de la EMRR y, al igual que el siponimod, se une selectivamente a los subtipos S1PR1 y S1PR5, impidiendo la fuga de linfocitos de los órganos linfoides secundarios [34]. En pacientes sin síntomas cardiacos actuales/preexistentes, no es necesario observar la dosis inicial cuando se aumenta el fármaco (0,23 mg los días 1-4, 0,46 mg los días 5-7, y después 0,92 mg una vez al día).
Los resultados del estudio muestran una menor tasa anualizada de recaídas, un menor número de lesiones anualizadas con gadolinio, lesiones T2 nuevas o en aumento y una menor tasa de atrofia cerebral, con un perfil de seguridad favorable en comparación con el interferón beta-1a [35]. Sin embargo, la progresión de la discapacidad fue comparable entre los grupos. De forma similar al siponimod, también se encontraron efectos positivos sobre la velocidad cognitiva (SDMT) con ozanimod [36].
El ponesimod está aprobado para adultos con esclerosis múltiple activa remitente-recurrente desde noviembre de 2020, lo que lo convierte en la última incorporación a esta clase de fármacos. El modulador S1PR con alta afinidad por el S1PR1 tiene una vida media corta de 32 horas [37]. Tras interrumpir el tratamiento, los recuentos de linfocitos se normalizan en siete días. Se requiere una monitorización inicial de la dosis en pacientes con enfermedades/condiciones cardiacas actuales o preexistentes, ya que el inicio del tratamiento con Ponvory produce una reducción transitoria de la frecuencia cardiaca y anomalías de la conducción auriculoventricular (AV).
La eficacia del ponesimod ya se estableció en un estudio de fase II de búsqueda de dosis y se confirmó posteriormente en un ECA de fase III más amplio. En comparación con el placebo, el tratamiento con ponesimod (10 mg, 20 mg y 40 mg) cumplió el criterio de valoración primario de reducir el número acumulado de lesiones nuevas que realzan con gadolinio en un estudio de fase II en pacientes con EMRR [38]. Se produjeron bradicardia transitoria y bloqueo auriculoventricular en el 2% de los participantes cada uno. La disnea o los efectos secundarios respiratorios se registraron de forma dependiente de la dosis [38]. El ponesimod también demostró ser superior a un comparador activo (teriflunomida) en términos de fatiga [39].
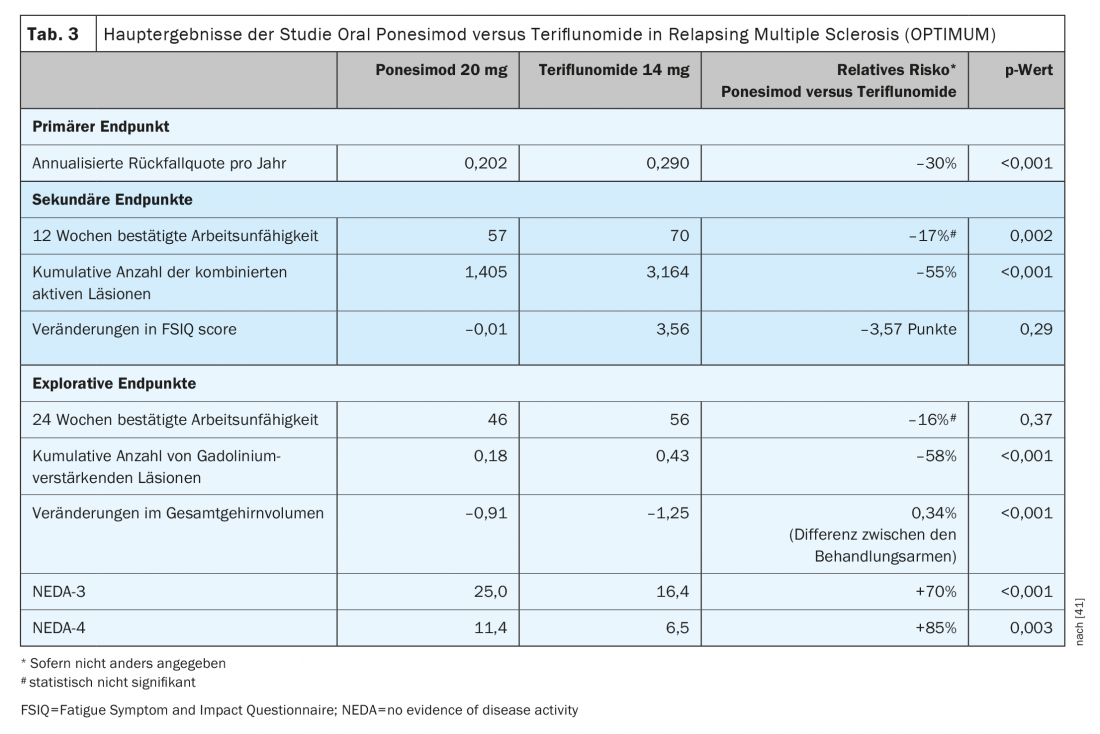
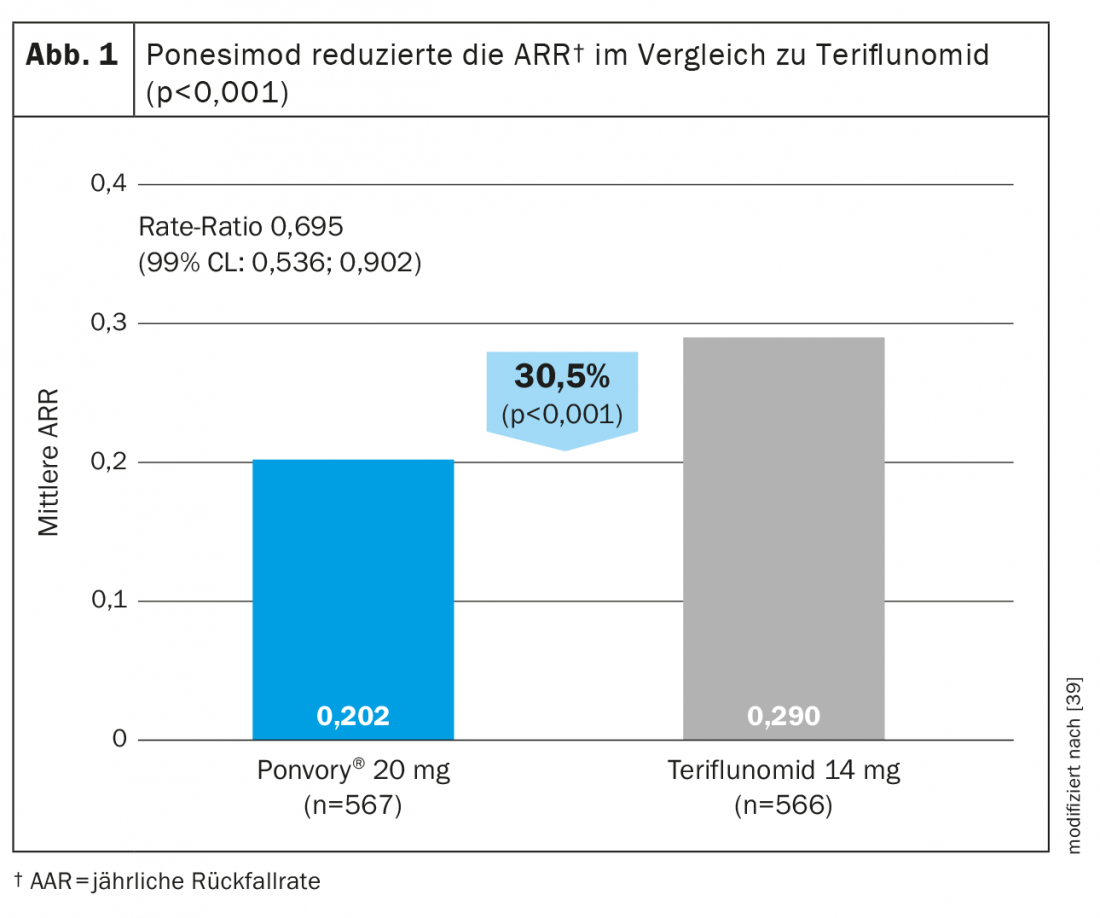
Ponesimod es el primer DTM oral aprobado que se evalúa frente a otro agente oral establecido para el tratamiento de la esclerosis múltiple remitente-recurrente. El ponesimod 20 mg se comparó con la teriflunomida en un estudio de fase III (OPTIMUM) en pacientes con esclerosis múltiple remitente-recidivante (Tabla 3) [39]. El criterio de valoración primario fue la tasa de recaída anulada durante el periodo de estudio. Los criterios de valoración secundarios incluían el número de lesiones T1 nuevas que realzaban con gadolinio y el número de lesiones T2 nuevas o que aumentaban de tamaño hiperintensas desde el inicio hasta la semana 108, así como el tiempo transcurrido hasta la progresión de la discapacidad confirmada a los 3 meses. Los criterios de valoración exploratorios considerados fueron los pacientes sin recaída y el cambio porcentual medio en el volumen cerebral desde el inicio hasta la semana 108.
El estudio demostró que el ponesimod lograba una reducción de la RRA un 30,5% mayor que la teriflunomida (Fig. 1) . Además de la actividad de la resonancia magnética y la pérdida de volumen cerebral, la fatiga también se redujo mejor con ponesimod en comparación con el comparador activo teriflunomida [38]. En términos de reducción de la progresión de la discapacidad confirmada, la eficacia fue comparable en ambos grupos de prueba [39].
La proporción de pacientes con al menos un acontecimiento adverso emergente del tratamiento (AETT) o un acontecimiento adverso grave (AAG) también fue comparable en ambos grupos de tratamiento. La mayoría de los EAET fueron de leves a moderados y no dieron lugar a la interrupción del tratamiento. Los efectos secundarios más frecuentes en el grupo de ponesimod fueron: Elevación de ALT, nasofaringitis, cefalea, infección del tracto respiratorio superior e hipertensión.El efecto beneficioso del ponesimod 20 mg sobre la enfermedad de la EM se mantuvo durante unos ocho años sin que se detectaran nuevos efectos secundarios [40].
En general, los efectos del tratamiento con ponesimod parecen ser coherentes con los de otros moduladores del receptor de S1P, sin problemas de seguridad inesperados, aunque esto debe interpretarse con cautela en ausencia de estudios comparativos directos.
A diferencia del fingolimod, pero de forma similar al ozanimod y al siponimod, el régimen de administración ascendente del ponesimod minimiza el efecto sobre la frecuencia y el ritmo cardíacos AES en la primera dosis, por lo que no se requiere una monitorización cardiovascular prolongada al inicio del tratamiento. Además, la característica de una vida media más corta del ponesimod en comparación con el fingolimod puede ser una ventaja en caso de vacunación o embarazo y en el tratamiento de los efectos secundarios [41].
Conclusión
La clase de moduladores de S1PR ofrece una nueva opción eficaz y emocionante para la gestión del tratamiento de la EM. Aunque los preparados aprobados actualmente se basan en el mismo mecanismo de acción, difieren en su manejo y perfil. Por lo tanto, para tomar una decisión terapéutica individualizada, deben tenerse en cuenta datos como la farmacodinámica, la farmacocinética, las medidas necesarias antes y al inicio de la terapia, así como durante la misma, y las posibles interacciones farmacológicas.
Mensajes para llevarse a casa
- La modulación de los receptores S1P es una importante e interesante diana terapéutica debido a su diversidad funcional.
- En la actualidad, se dispone de tres moduladores del receptor de S1P para pacientes con EMRR y uno para pacientes con EMPS.
- El fingolimod actúa sobre S1P1, S1P2, S1P3 y S1P5.
- Siponimod, ozanimod y ponesimod actúan específicamente sobre S1PR1 y S1PR5.
- En pacientes con EM sin síntomas cardíacos actuales/preexistentes, no se requiere observación con la administración inicial de ozanimod y ponesimod.
- La semivida más corta del siponimod, el ozanimod y el ponesimod ayuda a que los linfocitos se recuperen más rápidamente tras la interrupción del tratamiento.
- Los moduladores del receptor de S1P mencionados anteriormente no han demostrado afectar negativamente a la cognición ni a la fatiga.
Literatura:
- Aktas O, et al: Diagnóstico de la esclerosis múltiple: revisión de los criterios McDonald 2017. Neurologist 2018; 89: 1344-1354.
- www.nationalmssociety.org/What-is-MS/Types-of-MS/Relapsing-remitting-MS (último acceso 01.09.2022)
- Thompson AJ, Banwell BL, Barkhof F, et al: Diagnóstico de la esclerosis múltiple: revisiones de 2017 de los criterios McDonald. Lancet Neurol 2018;1 7(2): 162-173.
- Lassmann H: Lesiones corticales en la esclerosis múltiple: inflamación frente a neurodegeneración. Cerebro. 2012; 135(Pt 10):2904-2905.
- Tobin WO, Kalinowska-Lyszczarz A, Weigand SD, et al: Correlación clínica de los subtipos inmunopatológicos de la esclerosis múltiple. Neurología. 2021; 97(19): e1906-e1913.
- Baecher-Allan C, et al: Esclerosis múltiple: mecanismos e inmunoterapia. Neuron 2018; 97(4): 742-768.
- Penner IK: Evaluación de la cognición y la fatiga en la esclerosis múltiple: práctica diaria y futuras direcciones. Acta Neurologica Scandinavica 2016; 134 (Suppl. 200): 19-23.
- Kobelt, et al: Nuevos datos sobre la carga y los costes de la esclerosis múltiple en Europa. Mult Scler. 2017; 23(8): 1123-1136.
- Penner IK, Warnke C: Trastornos cognitivos en la esclerosis múltiple. DGNeurología 2021; 3: 184-186.
- Pitteri et al: El deterioro cognitivo predice la progresión de la discapacidad y el adelgazamiento cortical en la EM: Un estudio de 8 años. Mult Scler. 2017; 23(6):848-854.
- Gilenya® SmPC, a partir de: noviembre de 2020. www.swissmedicinfo.ch
- Zeposia® SmPC, a partir de: julio de 2020. www.swissmedicinfo.ch
- Información sobre el producto Ponvory®, a partir de noviembre de 2021. www.swissmedicinfo.ch
- Información sobre el producto Mayzent®, a partir de: octubre de 2020. www.swissmedicinfo.ch
- Rosen H, Germana Sanna M, Gonzalez-Cabrera PJ, Roberts E: La organización del sistema de señalización de la esfingosina 1-fosfato. Curr Top Microbiol Immunol 2014; 378: 1-21.
- Kunkel GT, Maceyka M, Milstien S, Spiegel S: Targeting the sphingosine-1-phosphate axis in cancer, inflammation and beyond. Nat Rev Drug Discov 2013; 12(9): 688-702.
- Cartier A, Hla T: Esfingosina 1-fosfato: señalización lipídica en patología y terapia. La ciencia. 2019;366(6463):eaar5551.
- Maceyka M, Harikumar KB, Milstien S, Spiegel S. Señalización de la esfingosina-1-fosfato y su papel en la enfermedad. Trends Cell Biol 2012; 22(1): 50-60.
- Subei AM, Cohen JA: Moduladores del receptor de esfingosina 1-fosfato en la esclerosis múltiple. CNS Drugs 2015; 29(7): 565-575.
- Chaudhry BZ, Cohen JA, Conway DS: Moduladores del receptor de esfingosina 1-fosfato para el tratamiento de la esclerosis múltiple. Neurother J Am Soc Exp Neurother 2017; 14(4): 859-873.
- Pérez-Jeldres T, Alvarez-Lobos M, Rivera-Nieves J: Dirigirse a la señalización de la esfingosina-1-fosfato en las enfermedades inmunomediadas: más allá de la esclerosis múltiple. Drogas. 2021; 81(9):985-1002.
- Zecca C, et al: Media dosis de fingolimod para el tratamiento de la esclerosis múltiple remitente-recurrente: Estudio observacional. Mult Scler 201; 24: 167-174.
- Yamout BI, Zeineddine MM, Sawaya RA, Khoury SJ: Seguridad y eficacia del tratamiento con dosis reducidas de fingolimod. J Neuroimmunol 2015; 285: 13-15.
- Kappos L, et al: Un ensayo controlado con placebo de fingolimod oral en la esclerosis múltiple recidivante. N Engl J Med 2010; 362: 387-401.
- Calabresi PA, et al: Seguridad y eficacia del fingolimod en pacientes con esclerosis múltiple remitente-recurrente (FREEDOMS II): ensayo doble ciego, aleatorizado, controlado con placebo, de fase 3. Lancet Neurol 2014; 13: 545-556.
- Cohen JA, et al: Fingolimod oral o interferón intramuscular para la esclerosis múltiple recidivante. N Engl J Med 2010; 362: 402-415.
- Langdon DW et al: Características basales y efectos del fingolimod sobre el rendimiento cognitivo en pacientes con esclerosis múltiple remitente-recurrente. Eur J Neurol 2021; 28(12):4135-4145.
- Fischer-Barnicol B, et al.: Combinación de teriflunomida e interferón como terapia de seguimiento tras LMP asociada a fingolimod. Neurol Neuroimmunol Neuroinflamm 2021; 8. doi: 10.1212/NXI.0000000000000927
- Kappos L, et al: Siponimod frente a placebo en la esclerosis múltiple secundaria progresiva (EXPAND): un estudio doble ciego, aleatorizado, de fase 3. Lancet 2018; 391: 1263-1273.
- Selmaj K, et al: Siponimod para pacientes con esclerosis múltiple remitente-recurrente (BOLD): un estudio adaptativo, de dosis variable, aleatorizado, de fase 2. Lancet Neurol 2013; 12: 756-767.
- Gajofatto A: El siponimod y su potencial en el tratamiento de la esclerosis múltiple secundaria progresiva: las pruebas hasta la fecha. Drug Des Devel Ther 2017; 11: 3153-3157.
- Huth F, Gardin A, Umehara K, He H: Predicción del impacto de los genotipos del citocromo P450 2C9 en el potencial de interacción farmacológica del siponimod con el modelado farmacocinético de base fisiológica: un enfoque integral para las recomendaciones de la etiqueta del fármaco. Clin Pharmacol Ther 2019; 106:1113-1124.
- Gold, et al: Siponimod frente a placebo en la esclerosis múltiple secundaria progresiva activa: un análisis post hoc del estudio de fase 3 EXPAND.J Neurol 2022; 269(9): 5093-5104.
- Lamb YN: Ozanimod: Primera aprobación. Fármacos 2020; 80:841-848.
- Comi G, et al: Seguridad y eficacia del ozanimod frente al interferón beta-1a en la esclerosis múltiple recidivante (SUNBEAM): un ensayo multicéntrico, aleatorizado, de un mínimo de 12 meses, de fase 3. Lancet Neurol 2019; 18: 1009-1020.
- De Luca J et al: Efecto de Ozanimod en el rendimiento de la prueba de modalidades de dígitos simbólicos en la EM recidivante. Mult Scler Relat Disord. 2021; 48:102673.
- D’Ambrosio D, Freedman MS, Prinz J: Ponesimod, un modulador selectivo del receptor S1P1: un tratamiento potencial para la esclerosis múltiple y otras enfermedades inmunomediadas. Ther Adv Chronic Dis 2016; 7: 18-33.
- Olsson T, et al: Ponesimod oral en la esclerosis múltiple remitente-recurrente: un ensayo aleatorizado de fase II. J Neurol Neurosurg Psychiatry 2014; 85: 1198-1208.
- Kappos L, Fox RJ, Burcklen M, et al: Ponesimod comparado con teriflunomida en pacientes con esclerosis múltiple recidivante en el estudio OPTIMUM de fase 3 de comparador activo: un ensayo clínico aleatorizado. JAMA Neurol 2021; 78(5): 558-567.
- Freedman MS, Pozzilli C, Havrdova EK, et al: Long-term Treatment With Ponesimod in Relapsing-Remitting Multiple Sclerosis: Results from Randomized Phase 2b Core and Extension Studies. Neurología 2022 Jun 6;10.1212/WNL.0000000000200606.
- Ruggieri S, Quartuccio ME, Prosperini L: Ponesimod en el tratamiento de las formas recidivantes de la esclerosis múltiple: actualización de los datos clínicos emergentes. Degener Neurol Neuromuscul Dis 2022; 12: 61-73.
InFo NEUROLOGíA Y PSIQUIATRÍA 2022; 20(5): 12-18.