El carcinoma epitelial de ovario es un grupo heterogéneo de carcinomas que presentan una etiología, una genética y, por tanto, un pronóstico biológico diferentes. En los estadios avanzados (IIB-IV), el tratamiento estándar sigue siendo la terapia citorreductora máxima, la ponderación de la morbilidad y la continuación inmediata de la quimioterapia con carboplatino/paclitaxel. La quimioterapia adyuvante sigue siendo carboplatino y paclitaxel (q3w o q1w). En la situación R1 o estadio IV, el bevacizumab también debe administrarse durante la terapia y continuarse como terapia de mantenimiento, ya que mostró un beneficio de supervivencia de unos nueve meses. La individualización de la terapia en función de la biología subyacente es esencial, por lo que es necesaria la implicación de todos los expertos y de un equipo interprofesional e interdisciplinar en un centro tumoral.
Alrededor de 200.000 mujeres en todo el mundo desarrollan cáncer de ovario epitelial (COE). Alrededor del 60-70% de los pacientes se diagnostican en un estadio avanzado (estadio FIGO III-IV). De estos pacientes, alrededor del 70% sufren una recidiva, lo que suele significar una situación controlable pero ya no curativa. El pronóstico en los estadios avanzados es modesto, con una tasa de supervivencia a 5 años del 50%. En los estadios iniciales (FIGO I-IIA), las pacientes suelen curarse tras una estadificación quirúrgica adecuada y una terapia adyuvante con sistemas que contienen platino (estudio ACTION). Sin embargo, las tasas europeas de incidencia y mortalidad estandarizadas por edad sólo han cambiado ligeramente en los últimos 40 años, a pesar de la mejora de la subespecialización quirúrgica y de los nuevos fármacos de segunda línea.
Sintomatología
Los síntomas de la EOC suelen ser inespecíficos y aparecen tarde. Los síntomas de los que se queja con frecuencia suelen ser de origen gastrointestinal: meteorismo, cambios en los hábitos fecales, dificultades miccionales y aumento del perímetro abdominal. El signo clínico más importante es un tumor sólido, irregular y fijo en la pelvis que puede delimitarse en la exploración ginecológica.
Subtipos histológicos
Los subtipos histológicos del carcinoma ovárico están morfológicamente bien delimitados: seroso (75-80%), endometrioide (10%), mucinoso (10%), de células claras (1%), de células transicionales (1%) e indiferenciado (1%). Estos histotipos no sólo difieren puramente morfológicos, sino que también muestran un patrón de comportamiento biológico diferente, que está representado, entre otras cosas, por una clara distinción genética a nivel del ARNm [1]. Y el curso clínico también difiere en función de los subtipos biológicos. Así pues, el pronóstico del COE endometrioide es significativamente mejor que el del COE mucinoso [2]. En el futuro, la terapia deberá orientarse cada vez más hacia los subtipos biológicos para lograr mejores pronósticos.
Durante mucho tiempo se pensó que el carcinoma de ovario tenía más probabilidades de aparecer de forma esporádica y que sólo era hereditario en un 10-15% de los casos. Las mutaciones hereditarias relevantes para el cáncer de ovario se encuentran en los genes BRCA1 (Chr. 17,60%) y BRCA2 (Chr. 13,30%), así como mutaciones en los genes de reparación de errores de emparejamiento del ADN MLH1, MSH2, MSH6, PMS1, PMS2 (5%), que también causan el “cáncer de colon sin poliposis humana” (HNPCC) o síndrome de Lynch [3]. Un estudio australiano reciente demostró que hasta un 20% de todos los carcinomas serosos presentan una mutación en el gen BRCA1 o -2 [4]. En los carcinomas serosos indiferenciados, sabemos que existe un fenotipo denominado “BRCAness”. Dado que tanto el BRCA como el PARP desempeñan un papel en la modificación de la resistencia tumoral, el tratamiento con los llamados inhibidores del PARP es fundamental, y es probable que aumente en el futuro.
Nuestros conocimientos sobre el desarrollo del cáncer de ovario se revolucionaron en 2007, cuando se extirparon los anexos de portadoras de la mutación BRCA1/2 y se descubrieron carcinomas tubáricos in situ precoces. Esto condujo a la constatación de que una proporción significativa de los carcinomas ováricos serosos se originan probablemente en la trompa. Anteriormente, se había supuesto que el epitelio superficial monocapa que recubre el ovario se altera por la ovulación constante y produce quistes de inclusión con alteraciones metaplásicas [5, 6].
Terapia del cáncer de ovario
La terapia del cáncer de ovario es multimodal e incluye cirugía y quimioterapia o terapia diana, así como radioterapia en el pasado.
Ya en la década de 1940 se postuló por primera vez que la resección completa de todos los restos tumorales es esencial para el pronóstico. Pero sólo con la subespecialización de ginecólogos especiales como oncólogos ginecológicos fue posible realizar la cirugía citorreductora por debajo de los 2 cm. En este caso, si es posible, debe aspirarse a una citorreducción completa en lugar de óptima [7, 8]. Según el antiguo Consenso del GCIG (Intergrupo de Cáncer Ginecológico) realizado en 2010, una citorreducción óptima es un foco tumoral residual <1 cm (alcanzable en el 47%) [9]. Sin embargo, en la nueva definición consensuada del GCIG, la citorreducción óptima corresponde a la ausencia de tumor residual macroscópicamente visible (alcanzable sólo en el 34%) [10].
Varios estudios han demostrado que la supervivencia depende significativamente del volumen tumoral residual. Un metaanálisis de Bristow con más de 6.000 pacientes de 2002 mostró claramente la correlación lineal entre el alcance de la citorreducción y el número de pacientes.
Supervivencia en [8]. Los temas de debate actuales se refieren al grado de agresividad en la citorreducción, por ejemplo, de la parte superior del abdomen [11] o de los ganglios linfáticos. En el estudio de un gran centro de tumores estadounidense, se demostró que la citorreducción completa era posible en el 85,3% y la citorreducción óptima (<1 cm) en otro 13,5%. Sin embargo, esto sólo fue posible con un aumento masivo de la morbilidad debido a los extensos procedimientos adicionales, por ejemplo, resecciones rectosigmoideas (52,1%), extirpación del diafragma (40,5%), ablación de implantes peritoneales (89%) o esplenectomías, resecciones hepáticas y pancreatectomías distales (19%) [7]. Dado que la terapia de la EOC no sólo incluye la citorreducción quirúrgica, sino también la pronta continuación de la terapia con quimioterapia, parece cuestionable que una citorreducción prolongada con una elevada morbilidad y el retraso de varios meses de la quimioterapia posterior sea útil, especialmente en pacientes de edad avanzada.
En la actualidad, no existen estudios que hayan demostrado un beneficio de la linfonodectomía. Esto es especialmente cierto en el caso de un tumor residual independientemente de su volumen. Un análisis retrospectivo de pacientes de diversos estudios AGO-OVAR (n=3388) mostró un pequeño beneficio en términos de supervivencia global en el 51,3% de las pacientes con reducción tumoral óptima cuando se realizó una linfonodectomía pélvica/paraaórtica sistemática [12]. Sin embargo, aparte de esta única observación retrospectiva, no existen datos prospectivos que prueben la situación de hecho.
Terapia quirúrgica
El tratamiento quirúrgico del COE debe realizarse siempre mediante laparatomía longitudinal si se sospecha urgentemente de malignidad. La laparascopia no tiene ningún valor en el tratamiento primario del COE y aumenta el riesgo de rotura del tumor o del quiste. Si se produce una rotura tumoral iatrogénica intraoperatoria, el pronóstico empeora con el “upstaging” a un estadio IC. El tratamiento del tumor debe incluir siempre la estadificación completa en la fase inicial y la citorreducción en la fase avanzada, ya que esto también es pronóstico. En la cirugía de preservación de la fertilidad puede realizarse una adenexectomía unilateral. Sin embargo, en el caso de una estadificación incompleta, en el 30% de los casos se produce una “estadificación ascendente” en la segunda operación. La tabla 1 muestra los requisitos de la terapia quirúrgica, incluida la cirugía de preservación de la fertilidad en la fase inicial. Dado que los carcinomas mucinosos avanzados suelen ser de origen no ovárico, siempre debe realizarse una apendicectomía y una amplia exploración del intestino/estómago [13].

A diferencia del tratamiento del COE precoz, el tratamiento del COE avanzado está diseñado para maximizar la cirugía citorreductora. Después del estadio FIGO, el remanente tumoral tras la resección máxima es el segundo pronóstico más importante
Factor. Deben extirparse todas las lesiones tumorales visibles. Una resección completa es claramente mejor que una resección <1 cm (1-10 mm). Un metaanálisis de la AGO demostró que la resección completa prolongaba la supervivencia 30 meses en el estadio IV, 47 meses en el estadio IIIC y 60 meses en los estadios IIB-IIIB [14].
La resección intestinal, la resección del diafragma y la resección parcial del hígado también pueden mejorar el resultado, pero también causan la correspondiente morbilidad y mortalidad y sólo deben ser realizadas por oncólogos ginecológicos experimentados.
Radioterapia
En la década de 1980, la radioterapia se utilizó como terapia adyuvante porque mostró un beneficio sobre la quimioterapia con ciclofosfamidas. Sin embargo, hoy en día ha pasado a un segundo plano por la introducción de la quimioterapia que contiene platino y, a pesar de su buena eficacia, sólo se utiliza en raras ocasiones. Sin embargo, en la situación paliativa, la radioterapia para el control de los síntomas sigue teniendo un papel importante y también puede considerarse tras una citorreducción secundaria óptima en la recidiva localizada.
Quimioterapia
Hoy en día, la quimioterapia con platino es la norma en el tratamiento adyuvante del cáncer de ovario, así como en la situación de recidiva con un intervalo adecuado (>6 meses). En la década de 1980, se evaluaron varias terapias combinadas, en particular la combinación de platino con ciclofosfamida o doxorrubicina. También se estudiaron combinaciones triples, pero en general aportaron más toxicidad que beneficio a los pacientes.
El segundo pilar principal de la quimioterapia son los taxanos, que inicialmente se extrajeron del tejo del Pacífico (Taxus brevifolia). La combinación de carboplatino y paclitaxel sigue siendo el estándar en quimioterapia adyuvante para el cáncer de ovario y se ha probado en varios estudios (GOG111, OV10, ICON3). Desde 2004 la combinación de carboplatino/paclitaxel i.v. ha sido la norma mundial basada en los datos del estudio. Esto también se recomendó en un documento de consenso [9].
Varios estudios han investigado el uso de la quimioterapia en grupos de bajo riesgo frente a los de alto riesgo (GOG, ICON 1, ACTION). Los debates actuales giran en torno a la administración de quimioterapia neoadyuvante (EORTC55971,
estudio CHORUS), la quimioterapia intraperitoneal (SWOG, GOG172), la administración semanal de paclitaxel (JGOG3016, MITO7, ICON8), la administración adicional de terapias diana, en particular bevacizumab (ICON7, GOG218, AURELIA, OCEANS), así como el denominado “paclitaxel” en curso tras la quimioterapia. “Mantenimiento”, es decir, quimioterapia de mantenimiento con bevacizumab.
Los ensayos de fase III que han anunciado un cambio de paradigma en la terapia estándar para el cáncer de ovario avanzado a lo largo de las décadas fueron:
- GOG111 (n=386) y OV10 (n=680), que compararon cisplatino/ciclofosfamida con cisplatino/paclitaxel y mostraron un beneficio para la supervivencia de la combinación con paclitaxel.
- GOG158 (n=792) y OVAR3 (n=883), que compararon cisplatino/paclitaxel con carboplatino/paclitaxel y mostraron una eficacia similar con mejor tolerabilidad para el carboplatino
- GOG172 (n=429), que comparó la administración iv de cisplatino/paclitaxel con la intraperitoneal y observó una mejora de la eficacia pero un aumento de la toxicidad y una reducción de la calidad de vida de los pacientes.
- JGOG3016 (n=637), que comparó la combinación de carboplatino/paclitaxel como régimen semanal frente a un régimen de taxol cada tres semanas y mostró un beneficio en la supervivencia para el régimen de paclitaxel semanal.
- GOG218 (n=1873) e ICON7 (n=1528), que estudiaron carboplatino/paclitaxel con placebo frente a carboplatino/paclitaxel con y sin bevacizumab continuado y mostraron un beneficio significativo en la supervivencia de las pacientes que presentaban un carcinoma avanzado (FIGO III/IV) y no podían ser operadas de forma óptima (ICON7).
El bevacizumab es el primer fármaco de la lista de terapias que se desarrolló como una nueva “terapia dirigida” en el contexto de las pruebas genéticas en el cáncer de ovario. Ataca los vasos tumorales uniéndose al “factor de crecimiento endotelial vascular” (VEGF), que a su vez se une al receptor del mismo nombre. El VEGF es responsable de la supervivencia de las células endoteliales, de las anomalías vasculares, de la estimulación del crecimiento de nuevos vasos y del aumento de la permeabilidad vascular [15]. Fue uno de los principales candidatos en el análisis de genes desregulados en el cáncer de ovario [16]. El VEGF desempeña un papel central en la ovulación normal, la angiogénesis estimulada por el VEGF es esencial para el crecimiento tumoral y desempeña un papel importante en el desarrollo del cáncer de ovario al promover los cambios de crecimiento benigno a maligno y contribuir a la formación de metástasis peritoneales y a la producción de ascitis [17]. Por lo tanto, no es sorprendente que unos niveles elevados de VEGF en la sangre se asocien a un peor pronóstico. En la actualidad existen cuatro ensayos de fase III del inhibidor del VEGF bevacizumab en el cáncer de ovario, tanto adyuvantes (GOG-0218 e ICON7 [18, 19]) como paliativos de primera línea en situaciones sensibles y refractarias al platino (OCEANS y AURELIA [20, Pujade-Lauraine ASCO 2012]).
El tratamiento de los estadios iniciales (FIGO IA G1-FIGO IIA) del cáncer de ovario incluye quimioterapia con platino; esto mejora el pronóstico de supervivencia en aproximadamente un 8% al cabo de cinco años. Los tumores en estadio IA G1 no deben recibir quimioterapia, ya que tienen un pronóstico excelente sólo con cirugía. Todos los demás estadios iniciales reciben quimioterapia con carboplatino/paclitaxel cada tres semanas durante un total de cuatro a seis ciclos.
En la terapia combinada carboplatino/paclitaxel, el paclitaxel puede administrarse opcionalmente en “dosis densas” semanales. Los datos japoneses (JGOG3016) son excelentes, pero aún no está claro hasta qué punto son transferibles a las pacientes europeas, aunque no fueron los carcinomas de células claras sino los serosos los que mostraron la respuesta. El ensayo europeo MITO7 no mostró beneficios en la SLP (supervivencia sin progresión) con carboplatino y paclitaxel semanales, pero sí una mejor tolerabilidad.
Ahora se esperan con impaciencia los datos del ensayo ICON8, que también está probando el concepto de dosis densa en un brazo.
Tratamiento recurrente
Alrededor del 70% de las pacientes diagnosticadas en estadio avanzado FIGO III/IV sufrirán una recidiva en el transcurso de los cinco primeros años tras la terapia adyuvante. Después, por desgracia, se encuentra en una situación paliativa sin posibilidades de curación por lo general. Sin embargo, a diferencia de las últimas décadas, la situación de la recidiva se caracteriza por el hecho de que las opciones terapéuticas han aumentado y a menudo se puede conseguir una situación de recidiva estable durante años.
Los objetivos de la terapia de recaída deben incluir el control de los síntomas, la prolongación de la supervivencia libre de síntomas y el mantenimiento/mejora de la calidad de vida. El tratamiento de estos pacientes es cada vez más complejo a medida que se dispone de más datos, y la elección del tratamiento o la espera prudente depende de factores individuales. Sin embargo, siempre que sea posible, las decisiones sobre el tratamiento deben basarse en pruebas y proceder de ensayos aleatorios. Una nueva intervención quirúrgica sólo tiene sentido para pacientes seleccionados, es decir, si por ejemplo
- El paciente está libre de recidivas durante más de dos años
- El tumor parece completamente resecable
- Existe una afectación aislada de los ganglios linfáticos
- No presenta ascitis ni carcinomatosis peritoneal
- El paciente muestra un buen rendimiento.
Actualmente se están generando datos prospectivos sobre la resección en el ensayo DESKTOP-III. Este estudio revisa aleatoriamente el valor de la resección en caso de recidiva sensible al platino. Ya se ha adquirido experiencia en el estudio DESKTOP-II y se ha desarrollado una puntuación predictiva de la operabilidad [21].
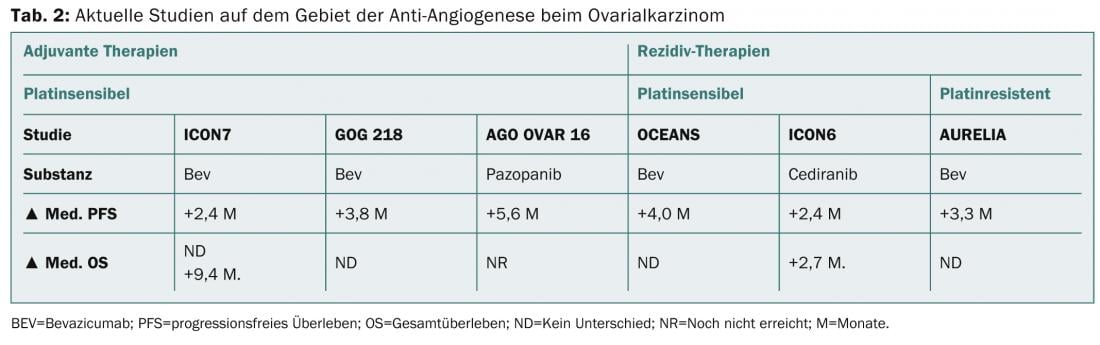
Las nuevas opciones de quimioterapia para el cáncer de ovario recidivante tanto en la situación sensible al platino como en la refractaria al platino pueden ser la administración adicional de bevacizumab o la administración semanal de paclitaxel. La tabla 2 muestra los avances actuales en el campo de la antiangiogénesis tanto en la terapia inicial como en la de recidiva.
En el caso de los pacientes refractarios a la terapia, también son necesarios unos buenos cuidados paliativos, que ya se han incluido de antemano en las decisiones terapéuticas. El pronóstico en esta situación suele ser muy malo (<1 año de supervivencia) y, por lo tanto, el control de los síntomas es la prioridad.
En general, deben tenerse muy en cuenta los siguientes cofactores a la hora de elegir un agente quimioterapéutico paliativo: Tiempo hasta la recaída, agentes quimioterapéuticos adyuvantes recibidos, síntomas actuales, deseos y comodidad del paciente (¿alopecia?), estado general, comorbilidades, tolerancia de la quimioterapia anterior, toxicidad residual (polineuropatía) y función de los órganos. Si el estado ECOG de los pacientes con tumores sensibles al platino es bueno, está indicada una combinación que contenga platino con un taxano/antraciclina, ya que se produce una mejora del pronóstico en comparación con la terapia singular con platino [22]. Por lo general, se recomienda la inclusión de estos pacientes en un posible ensayo clínico.
Debido a la creciente complejidad, una paciente con cáncer de ovario debe ser tratada siempre en un equipo interdisciplinar interprofesional en el marco de un centro de tumores ginecológicos. Esto tiene la ventaja no sólo de una mayor experiencia con estos pacientes, sino también, en particular, de la estrecha interconexión de las distintas disciplinas y la coordinación óptima de las medidas de apoyo y terapéuticas.
Dr. Marcus Vetter
Prof. Dra. med. Viola Heinzelmann-Schwarz
Literatura:
- Heinzelmann-Schwarz VA, et al: Br J Cancer 2006; 94(6): 904-913.
- Winter III WE, et al: JCO 20 de agosto de 2007; 25(24): 3621-3627.
- Burke W, et al: JAMA 1997; 277(12): 997-1003.
- Alsop K, et al: J Clin Oncol 2012; 30(21): 2654-2663.
- Auersperg N, et al: Endocr Rev 2001; 22(2): 255-288.
- Jarboe E, et al: Int J Gynecol Pathol 2008; 27(1): 1-9.
- Eisenkop SM, Friedman RL, Wang HJ: Gynecol Oncol 1998; 69(2): 103-108.
- Bristow RE, et al: Gynecol Oncol 2002; 86(2): 163-170.
- du Bois A, et al. (Intergrupo de Cáncer Ginecológico; AGO-OVAR; ANZGOG; EORTC; GEICO; GINECO; GOG; JGOG; MRC/NCRI; NCIC-CTG; NCI-US; NSGO; RTOG; SGCTG; IGCS; Equipo organizador de las dos OCCC internacionales anteriores): Ann Oncol 2005; 16(8): viii7-viii12.
- Stuart GC, et al. (Participantes de la4ª Conferencia de Consenso sobre el Cáncer de Ovario (OCCC); Intergrupo de Cáncer Ginecológico): Int J Gynecol Cancer 2011; 21(4): 750-755.
- Barlin JN, et al: Gynecol Oncol 2013; 130(2): 284-288.
- du Bois A, et al. (Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens. Papel potencial de la linfadenectomía en el cáncer de ovario avanzado): J Clin Oncol 2010; 28(10): 1733-1739.
- Schilder JM, et al: Gynecol Oncol 2002; 87(1): 1-7.
- du Bois A, et al: Cancer 2009 Mar 15; 115(6): 1234-1244.
- Ferrara N: Endocr Rev 2004; 25(4): 581-611.
- Jacob F, et al: Biomark Med 2009; 3(6): 743-756.
- Belotti D, et al: Cancer Res 2003; 63(17): 5224-5229.
- Burger RA, et al. (Grupo de Oncología Ginecológica): N Engl J Med 2011; 365(26): 2473-2483.
- Perren TJ, et al. (Investigadores de ICON7): N Engl J Med 2011; 365(26): 2484-2496.
- Aghajanian C, et al: J Clin Oncol 2012; 30(17): 2039-2045.
- Harter P, et al: Int J Gynecol Cancer 2011 feb; 21(2): 289-295.
- Raja FA, et al: Ann Oncol 2013 dic; 24(12): 3028-3034.
InFo Oncología y Hematología 2014; (2)1: 8-13











