El antígeno de membrana prostático específico (PSMA) desempeña un papel cada vez más importante no sólo en el diagnóstico del carcinoma de próstata. Con el radioligando 117Lutecio-PSMA-617, también se dispone de una nueva opción terapéutica para el cáncer de próstata resistente a la castración avanzado (CPRCm). Esto podría avanzar pronto hacia fases más tempranas de la enfermedad y líneas de terapia.
La radioterapia con 117Lutecio-PSMA-617suscitó un gran interés en todos los grandes congresos de oncología celebrados este año. Razón suficiente para que tuviera su propia sesión en la Conferencia de Consenso sobre Cáncer de Próstata Avanzado (APCCC), que tuvo lugar el 9 de octubre. Además de los resultados de los estudios actuales, en esta ocasión también se debatieron los retos clínicos y las esperanzas de futuro, tanto en la terapia basada en PSMA como en el diagnóstico.
PSMA: Tablas de multiplicar pequeñas
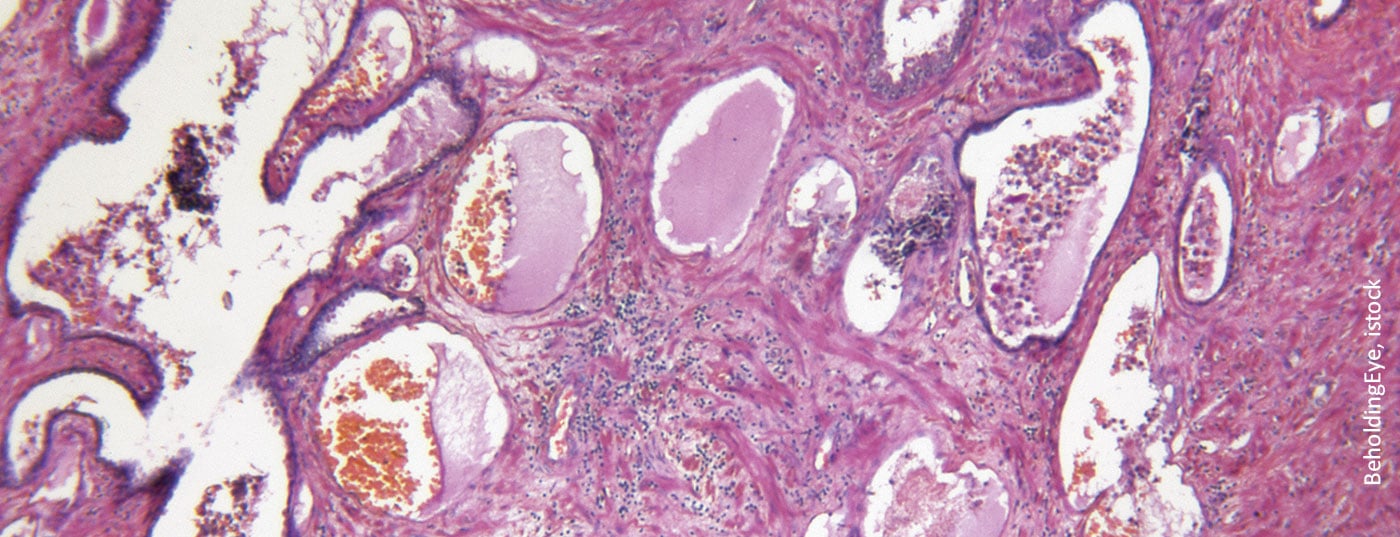
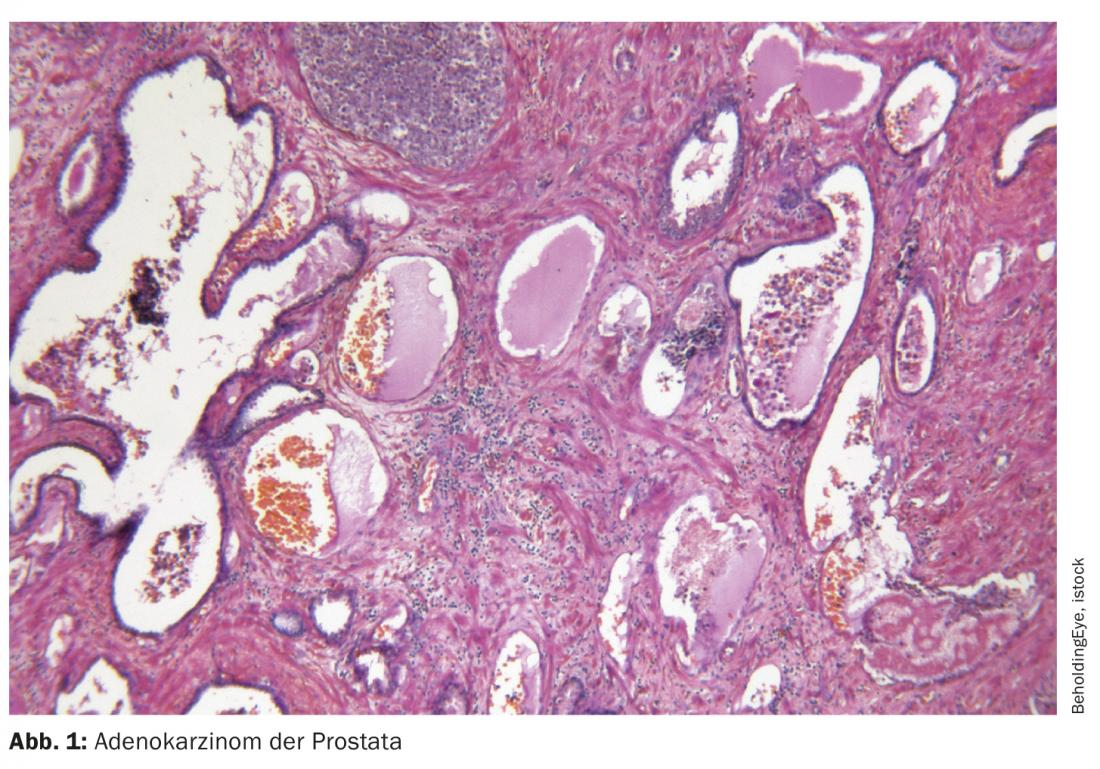
El antígeno de membrana específico de la próstata (PSMA) es una proteína transmembrana con la función enzimática de una folato hidrolasa carboxipeptidasa. Tiene un dominio citoplasmático corto, un dominio extracelular largo y una región transmembrana hidrófoba [1,2]. El PSMA se expresa especialmente -aunque no de forma exclusiva- en las células epiteliales de la próstata. En el carcinoma de próstata, se encuentra una sobreexpresión de hasta 1000 veces en comparación con otros tipos de tejidos. Lo más probable es que la proteína sirva para la captación de ácido fólico y glutamato, pero su función exacta aún no está clara. Además de en la próstata, el PSMA se encuentra fisiológicamente en las glándulas lagrimales y salivales y en el intestino delgado. Se detecta una expresión ligeramente inferior en el hígado, el bazo y los ganglios parasimpáticos, lo que a veces puede dar lugar a resultados falsos positivos en la obtención de imágenes basadas en PSMA [3]. Además, dado que los trazadores utilizados se excretan por vía renal, la captación en los riñones, uréteres y vejiga es inevitable.
Existen marcadas diferencias intra e interindividuales en la expresión de PSMA, que son de gran importancia en la clínica. Por un lado, sin PSMA falta la diana terapéutica y, por otro, las lesiones PSMA negativas no pueden detectarse en las imágenes basadas en PSMA. Hasta un 10% de los pacientes no muestran expresión o ésta es mínima. En general, es mayor en el CPRCm que en el cáncer de próstata sensible a la castración (CSPC). Unos niveles más altos de PSMA se asocian a una puntuación de Gleason más alta y a una peor supervivencia global [4]. A menudo, algunos focos de un paciente expresan PSMA mientras que otros permanecen invisibles en la PET PSMA, lo que supone un reto clínico.
El PSMA fue reconocido como una diana terapéutica y diagnóstica potencial hace más de 30 años. Ya en 1996 se produjo la primera aprobación de la FDA de un anticuerpo monoclonal dirigido contra el PSMA: ProstaScint®. Sin embargo, esto demostró no ser muy fiable en los estudios clínicos, ya que se une al dominio citoplasmático del PSMA y, por tanto, sólo se asienta en las células cancerosas apoptóticas. Por lo tanto, los enfoques más recientes dirigidos al PSMA se basan en atacar el dominio extracelular de la proteína transmembrana.
La interacción del receptor de andrógenos con el PSMA es interesante. Así, la terapia de privación de andrógenos (TDA) suele provocar un aumento de la expresión de PSMA [5,6] tanto en los casos sensibles a la castración como en los resistentes a ella. Algunas metástasis sólo aparecen en las imágenes PSMA después de la ADT. Debido a la respuesta tumoral, el carcinoma de próstata sensible a la castración (CSPC) provoca efectos opuestos de la ADT en la obtención de imágenes PSMA: el número de células tumorales disminuye, pero éstas muestran una mayor expresión de PSMA.
PSMA en imagen
Mientras tanto, la PSMA-PET representa un método de imagen robusto con un proceso bien definido y una buena disponibilidad global. Las directrices correspondientes existen desde 2017 y se espera una actualización en 2022 [7]. Sin embargo, el uso óptimo no está aclarado de forma concluyente y existen algunos retos clínicos. Entre otras cosas, existe un gran número de trazadores que aún no se han comparado adecuadamente entre sí (resumen 1) . Algunas comparaciones con unos pocos pacientes muestran resultados similares para las diferentes sustancias [8,9]. Los datos más sólidos existen para la comparación entre 18F-PSMA-1007y 68Ga-PSMA-11, presumiblemente porque estos trazadores son los más utilizados. En este contexto, se ha demostrado que el 18F-PSMA-1007produce más falsos positivos. Las lesiones óseas en particular no pueden detectarse de forma fiable con 18F-PSMA-1007debido a la acumulación fisiológica en la médula ósea. Por lo tanto, especialmente con este trazador, deben utilizarse imágenes adicionales como la resonancia magnética o la tomografía computarizada para interpretar las imágenes. Por otro lado, el 18F-PSMA-1007ha demostrado ser extremadamente útil para evaluar las afecciones locorregionales [10]. En términos de sensibilidad, no parece haber ninguna desventaja de un trazador [11]. La conclusión es que probablemente sean más adecuados distintos trazadores en función del entorno, un campo en el que aún queda mucho por investigar.

Además de la falta de una caracterización precisa de los distintos trazadores, la PSMA-PET también plantea otros retos, sobre todo de carácter financiero. Independientemente de la sustancia utilizada, la sensibilidad del método nunca es del 100%. Además, la evaluación fiable de las imágenes requiere cierta experiencia, una experiencia que no puede darse por sentada en vista de la novedad. El PSMA no es en absoluto específico del cáncer, de la próstata o incluso del cáncer de próstata. La expresión también se encuentra, por ejemplo, en el linfoma, el carcinoma de pulmón y el adenocarcinoma de colon, así como en diversas inflamaciones activas como la enfermedad de Crohn o la COVID-19. El significado clínico de las imágenes basadas en PSMA y su impacto en la práctica clínica también quedan por aclarar en el futuro.
Esto plantea la candente cuestión de si la PSMA-PET es realmente la mejor modalidad para una estadificación fiable. Esta cuestión es difícil de aclarar, sobre todo porque en casi todos los ensayos clínicos realizados hasta la fecha se ha utilizado la imagen convencional para evaluar el estadio tumoral y faltan comparaciones aleatorias. Sustituir o complementar las imágenes clásicas con PSMA-PET podría tener un impacto duradero y difícil de evaluar en la gestión clínica, incluida la terapia y, por tanto, el resultado. Si, por ejemplo, el método detecta metástasis no detectadas previamente, no hay que olvidar el peligro de un tratamiento excesivo. Por otro lado, probablemente haya pacientes que se beneficiarían de una evaluación más precisa del estadio de su enfermedad y, por tanto, de una intensificación del tratamiento. El objetivo debe seguir siendo utilizar la imagen para identificar a los pacientes que realmente necesitan un aumento de la intensidad y mejorar así sus resultados clínicos.
Para ilustrar esta cuestión, en la APCCC se presentaron algunas cifras impresionantes. Así, el 98% de los pacientes con CPRC considerados M0 en la estadificación convencional presentan lesiones en la PSMA-PET, de las cuales el 24% son locales y el 76% son N1/M1 [12]. En general, cerca de la mitad de los pacientes M0 originales se convierten así en pacientes M1, una elevación de estadio con consecuencias. Porque aunque las opciones de tratamiento son similares en el CPRC metastásico y no metastásico, según el estado de aprobación actual, la opción de apalutamida o darolutamida se pierde [13]. Con las nuevas modalidades de diagnóstico por imagen, la gestión clínica siempre debe cuestionarse y adaptarse, un proceso que actualmente está en pleno apogeo en el cáncer de próstata. No cabe duda de que la PSMA-PET es superior a la TC convencional y a la PET de colina, que se utilizaba hasta 2016, en términos de especificidad y sensibilidad. Sin embargo, queda por aclarar su valor clínico, de forma óptima en el marco de ensayos clínicos aleatorizados.
Radioterapia basada en PSMA
Por controvertido que pueda ser el uso de PSMA-PET en la estadificación, es igualmente claro en la selección de pacientes para la terapia con radioligandos dirigidos a PSMA. Por ello, el 117Lutecio-PSMA-617ya es accesible en centros especializados de Suiza como parte de un programa de uso compasivo, aunque aún no se ha obtenido la aprobación de Swissmedic [13]. Hasta ahora, el tratamiento se utiliza tras el fracaso de un agente dirigido al RA y un taxano (docetaxel) en el CPRCm. En la actualidad, la secuencia terapéutica ideal con cabazitaxel aún no está clara y debe evaluarse individualmente. Debido a la naturaleza diferente de la terapia, tiene un alto potencial para complementar de forma óptima las opciones existentes. Además, con una tasa de expresión de alrededor del 87% en el CPRCm, el PSMA es una diana casi ubicua que incluye biomarcadores de respuesta. Por lo tanto, el tratamiento dirigido al PSMA podría ser una opción para un gran número de enfermos en el futuro, y la identificación de los pacientes adecuados no es especialmente complicada.
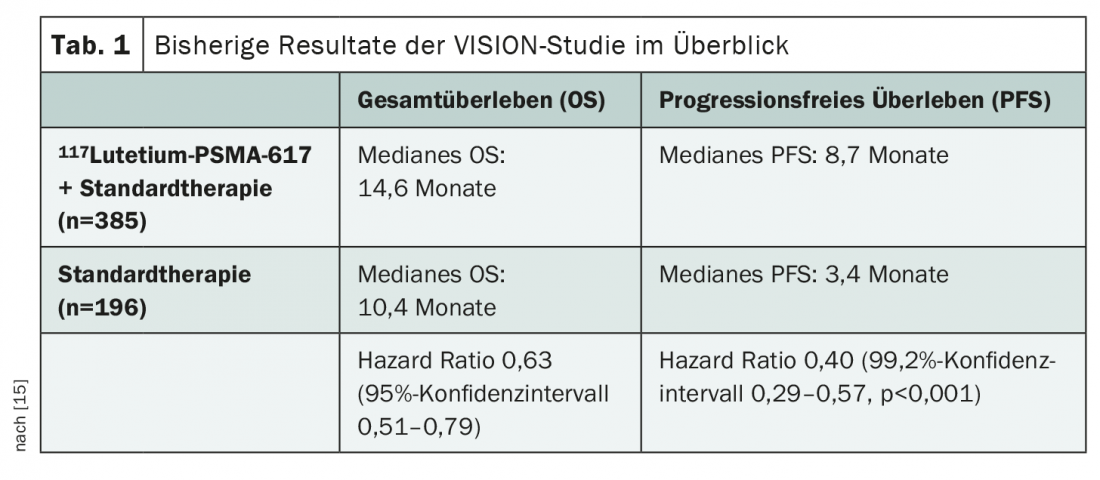
La mayor parte de los datos disponibles hasta ahora sobre el 117Lutecio-PSMA-617proceden del estudio VISION recientemente publicado [14,15] presentado en varios congresos. Se investiga la adición de 117Lutecio-PSMA-617a la terapia estándar en el CPRCm tras el pretratamiento con al menos un bloqueante de los receptores androgénicos y un régimen de quimioterapia basado en taxanos en el contexto de una PET/TC con 68Galio-PSMA-11positiva. Ya se han demostrado beneficios significativos en la supervivencia global (SG) y la supervivencia sin progresión (SLP) en todos los subgrupos (tabla 1) . Dada la eficacia demostrada de la terapia con 117Lutecio-PSMA-617en este escenario, surgen ahora varias preguntas más. Por ejemplo, aún debe aclararse cuál es el momento óptimo para el tratamiento. ¿Debe utilizarse 117Lutecio-PSMA-617antes, con o después de la quimioterapia? ¿Y podría utilizarse también el tratamiento con radioligandos en fases más tempranas de la enfermedad, por ejemplo en el CSPC o en casos no metastásicos? ¿Cuál es la situación respecto a las opciones terapéuticas posteriores? También se carece hasta la fecha de datos fiables sobre la evaluación de la toxicidad a largo plazo, en particular la supresión de la médula ósea. Es probable que esta cuestión pase cada vez más a primer plano con la realización de pruebas en fases cada vez más tempranas de la enfermedad y de las líneas terapéuticas.
Algunos estudios investigan actualmente la secuencia óptima de tratamiento con 117Lutecio-PSMA-617. Por ejemplo, está en marcha el ensayo PSMAfore, que prueba la eficacia del radioligando en el CPRCm después de un bloqueante de los receptores androgénicos pero antes de la quimioterapia. Se está investigando una aplicación aún más temprana en el ensayo PSMAddition, que está probando la adición de 117Lutecio-PSMA-617al tratamiento estándar en el CPSPm de primera línea. Incluso en el contexto neoadyuvante, actualmente se está llevando a cabo un ensayo: LuTectomía. Aunque el beneficio en el CPRCm tras la quimioterapia basada en taxanos se considera ahora probado, su uso en líneas terapéuticas y estadios de la enfermedad más tempranos se verá en los próximos años.
¿La selección del paciente como clave?
<Los expertos del APCCC atribuyeron el hecho de que sólo se lograra una reducción del 50% del PSA en la mayoría de los pacientes del estudio VISION con la terapia 117-lutecio-PSMA-617, entre otras cosas, a la inadecuada selección de pacientes realizada hasta la fecha. Probablemente no todos los pacientes incluidos se beneficiaron del tratamiento adicional. Esto puede indicar que, además de la PSMA-PET, deben utilizarse otros métodos de selección de pacientes para lograr una eficacia clínica óptima. Podrían ser de naturaleza genética, pero una FDG-PET adicional también es una opción.
El perfil genético del cáncer de próstata es extremadamente heterogéneo; por ejemplo, la enfermedad metastásica de novo suele mostrar un perfil genético menos favorable con un peor pronóstico [16]. Estos pacientes responden peor a varias terapias, lo que también puede ser cierto para el tratamiento con 117Lutecio-PSMA-617. Sin embargo, faltan datos fiables al respecto, razón por la que es necesario determinar el perfil genético en el marco de estudios clínicos. Así, en el futuro, el perfil genético también podría tenerse en cuenta en las decisiones de tratamiento, además de la expresión de PSMA.
Tampoco está claro si la FDG-PET debe utilizarse para la selección de pacientes además de la PSMA-. Esto no se hizo en el estudio VISION [14] – a diferencia del estudio TheraP, que comparó el tratamiento con 117Lutecio-PSMA-617con el cabazitaxel en el CPRCm [17]. La FDG-PET adicional condujo, por un lado, a un mayor número de exclusiones del estudio y, por otro, a una mayor tasa de respuesta al tratamiento con 117Lutecio-PSMA-617del 66% (VISION: 46%). Esto se debe probablemente a que tanto los pacientes que tenían metástasis con expresión de PSMA como los que no tenían la expresión correspondiente pudieron ser identificados y excluidos gracias a la FDG-PET. Aparte de un beneficio potencial en la selección de pacientes, la realización de la FDG-PET también aporta ventajas en la caracterización más precisa de la enfermedad y la optimización de los lugares de muestreo de la biopsia. Por ejemplo, los síntomas causados por las metástasis pueden clasificarse mejor y tratarse correctamente en una fase temprana. En general, la heterogeneidad intraindividual del carcinoma de próstata metastásico, a menudo existente, representa una limitación importante para el tratamiento con radioligandos. Esto puede detectarse mediante una FDG-PET adicional.
Sueños de futuro: De combinaciones y nuevas sustancias activas
El desarrollo del 117Lutecio-PSMA-617sienta las bases de una nueva opción terapéutica en el cáncer de próstata. Habrá que examinarlos más de cerca en los próximos años y caracterizarlos en función de su potencial. Aún deben encontrarse las combinaciones terapéuticas óptimas, así como las secuencias. Además, existen enfoques de tratamiento alternativos que también se dirigen al PSMA.
Se abre un amplio campo de investigación en el ámbito de las posibles terapias combinadas con 117Lutecio-PSMA-617. Las combinaciones adecuadas de fármacos podrían, entre otras cosas, prevenir la resistencia debida a la heterogeneidad de la enfermedad. Las combinaciones con enzalutamida en primera línea (ENZA-P), y olaparib (LuPARP) y pembrolizumab (PRINCE) en segunda línea se están investigando actualmente en el CPRCm. Y las cosas también están cambiando con respecto a las posibles terapias posteriores. Aquí, la atención se centra especialmente en los emisores α. Por un lado, podrían utilizarse después del emisor β 117Lutecio-PSMA-617y, por otro, podrían ser una alternativa más eficaz y suave a éste. Esto se debe a que los emisores α provocan una mayor transferencia de energía a menor distancia. En la actualidad, las sustancias 225Act-PSMA-617, 225Act-J591y 227Thorium-PSMA-TTCse están investigando en ensayos de fase I.
Otras clases de fármacos alternativos dirigidos contra el PSMA son las células CAR-T y los anticuerpos biespecíficos (BiTE, Bispecific T-Cell Engagers) como el acapatamab. En la actualidad, éstas se encuentran todavía en sus inicios y su desarrollo también está resultando difícil dado el avanzado estado de la enfermedad y la alta vulnerabilidad de la población de pacientes. No obstante, existen los primeros resultados prometedores de los ensayos de fase I, con tasas de respuesta en torno al 34% [18]. Seguimos sintiendo curiosidad.
Fuente: PSMA in diagnostics and therapy. Sesión 2, Conferencia de Consenso sobre Cáncer de Próstata Avanzado (APCCC) en línea, 09.10.2021.
Literatura:
- Rajasekaran AK, Anilkumar G, Christiansen JJ: ¿Es el antígeno de membrana específico de la próstata una proteína multifuncional? Am J Physiol Cell Physiol. 2005; 288(5): C975-981.
- Sengupta S, et al: Comparación de los ligandos del antígeno prostático específico de membrana en la investigación de traslación clínica para el diagnóstico del cáncer de próstata. Cancer Rep (Hoboken). 2019; 2(4): e1169.
- Hofman MS, et al: PET de antígeno de membrana prostático específico: utilidad clínica en el cáncer de próstata, patrones normales, perlas y trampas. Radiografía. 2018; 38(1): 200-217.
- Paschalis A, et al.: Heterogeneidad del antígeno de membrana específico de la próstata y defectos en la reparación del ADN en el cáncer de próstata. Eur Urol. 2019; 76(4): 469-478.
- Bakht MK, et al: Influencia de la terapia de privación de andrógenos en la captación de agentes dirigidos al PSMA: oportunidades y retos emergentes. Nucl Med Mol Imaging. 2017; 51(3): 202-211.
- Hope TA, et al: 68Ga-PSMA-11 PET Imaging of Response to Androgen Receptor Inhibition: First Human Experience. J Nucl Med. 2017; 58(1): 81-4.
- Fendler WP, et al: (68)Ga-PSMA PET/CT: Directriz de procedimiento conjunta de la EANM y la SNMMI para la obtención de imágenes del cáncer de próstata: versión 1.0. Eur J Nucl Med Mol Imaging. 2017; 44(6): 1014-1024.
- Giesel FL, et al: Comparación intraindividual de (18)F-PSMA-1007 y (18)F-DCFPyL PET/TC en la evaluación prospectiva de pacientes con carcinoma de próstata recién diagnosticado: un estudio piloto. J Nucl Med. 2018; 59(7): 1076-80.
- Dietlein M, et al.: Comparación de [(18)F]DCFPyL y [ (68)Ga]Ga-PSMA-HBED-CC para la obtención de imágenes PSMA-PET en pacientes con cáncer de próstata recidivante. Mol Imaging Biol. 2015; 17(4): 575-584.
- Dietlein F, et al.: Comparación intraindividual de (18)F-PSMA-1007 con ligandos PSMA excretados renalmente para la obtención de imágenes PSMA PET en pacientes con cáncer de próstata recidivante. J Nucl Med. 2020; 61(5): 729-734.
- Rauscher I, et al.: Matched-Pair Comparison of (68)Ga-PSMA-11 PET/CT and (18)F-PSMA-1007 PET/CT: Frequency of Pitfalls and Detection Efficacy in Biochemical Recurrence After Radical Prostatectomy. J Nucl Med. 2020; 61(1): 51-57.
- Fendler WP, et al: Tomografía por emisión de positrones con ligando de antígeno de membrana prostático específico en hombres con cáncer de próstata resistente a la castración no metastásico. Clin Cancer Res. 2019; 25(24): 7448-7454.
- Información sobre medicamentos de Swissmedic: www.swissmedicinfo.ch (última consulta: 21.10.2021).
- Sartor O, et al: Lutecio-177-PSMA-617 para el cáncer de próstata metastásico resistente a la castración. N Engl J Med. 2021; 385(12): 1091-1103.
- Morris MJ, et al: Estudio de fase III de lutecio-177-PSMA-617 en pacientes con cáncer de próstata metastásico resistente a la castración (VISION). Reunión anual de la ASCO 2021, Sesión plenaria Cáncer genitourinario – de próstata, testículos y pene, Resumen #LBA4.
- Deek MP, et al: El paisaje mutacional del cáncer de próstata metastásico sensible a la castración: la teoría del espectro revisada. Eur Urol. 2021; 80(5): 632-640.
- Hofman MS, et al: [(177)Lu]Lu-PSMA-617 frente a cabazitaxel en pacientes con cáncer de próstata metastásico resistente a la castración (TheraP): un ensayo aleatorizado, abierto, de fase 2. Lancet. 2021; 397(10276): 797-804.
- Einsele H, et al.: La plataforma BiTE (bispecific T-cell engager): Desarrollo y potencial futuro de una terapia inmuno-oncológica dirigida a distintos tipos de tumores. Cáncer. 2020; 126(14): 3192-3201.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(6): 26-28 (publicado el 8.12.21, antes de impresión).