En la actualidad se han identificado varios factores de riesgo que predisponen al desarrollo de afectación articular en presencia de psoriasis. Los dermatólogos desempeñan un papel clave en la detección precoz. Una terapia sistémica adecuada en una “ventana de oportunidad” puede tener un impacto positivo en términos de resultados a largo plazo. Aunque las opciones de tratamiento han mejorado, la respuesta a la terapia no es satisfactoria para todos los pacientes con APs. Por ello, la investigación prosigue a un ritmo febril y se están ensayando nuevas estrategias de tratamiento.
La actividad mínima de la enfermedad (AM E) se considera una terapia de éxito para la artritis psoriásica (APs). Los avances en el desciframiento de las relaciones patogenéticas de la APs han impulsado el desarrollo de la terapéutica sistémica moderna, con el resultado de que ahora se dispone de productos biológicos y “pequeñas moléculas” dirigidas contra diversos objetivos: TNF, interleucina (IL)-12/23, IL-17, IL-23, JAK-STAT, PDE-4. Los resultados terapéuticos se han elevado a un nuevo nivel (Tab. 1) [1]. Mientras que los fármacos antirreumáticos modificadores de la enfermedad sintéticos convencionales (csDMARDs**) consiguieron una MDA en el 17% de los pacientes con APs según una revisión sistemática publicada en 2020, el tratamiento con biológicos (bDMARDs) consiguió una MDA en el 57% [2]. Aunque se trata de un salto cualitativo, también refleja una proporción significativa de no encuestados.
** csDMARDs: en particular el metotrexato, también la sulfasalazina o la leflunomida; en contraste con los sintéticos dirigidos (tsDMARDs) como el apremilast y los biológicos (bDMARDs)
Recomendaciones GRAPPA y EULAR
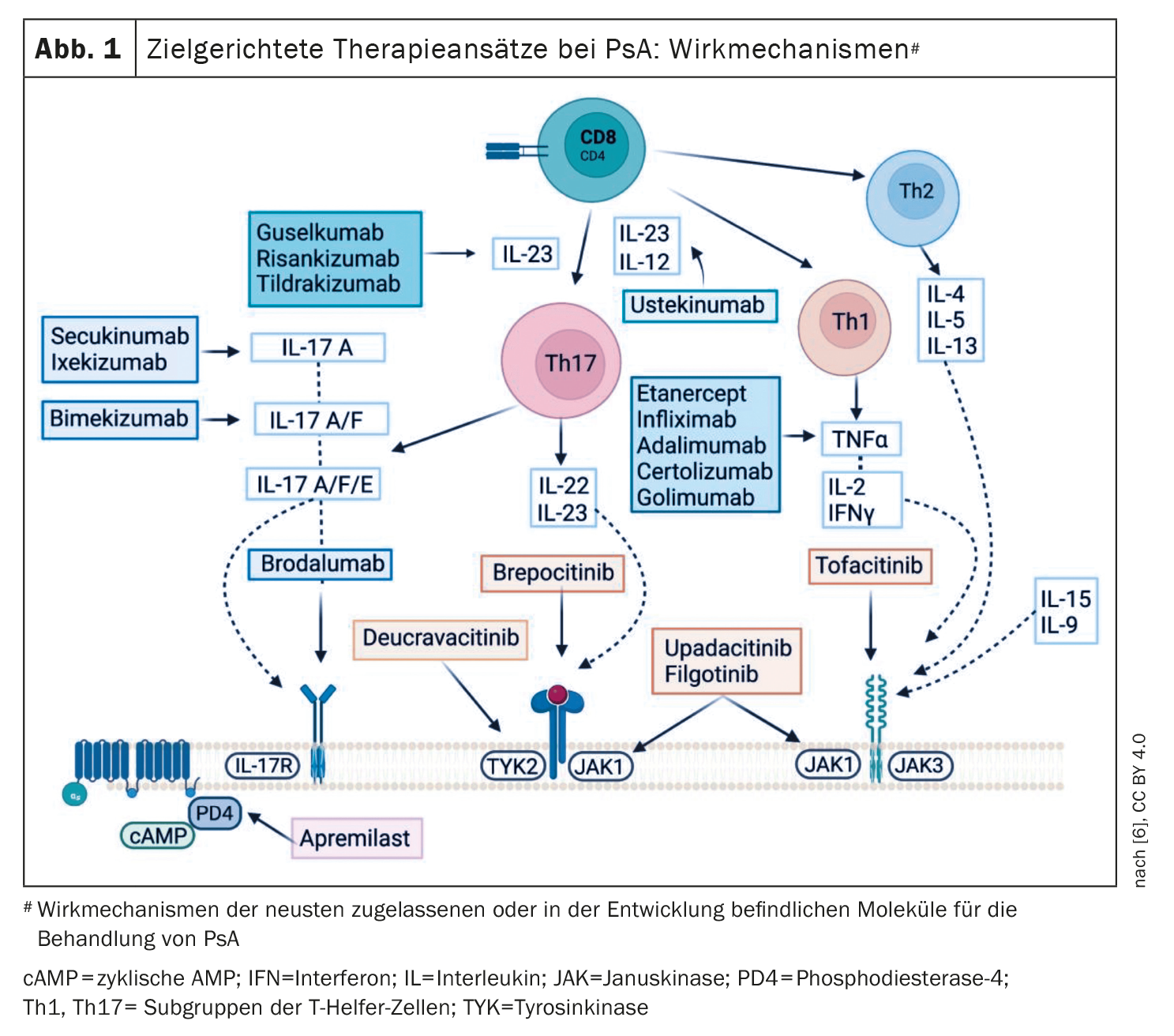
En vista de la heterogeneidad de la APs, cada vez es más importante una estrategia de tratamiento personalizada. Las recomendaciones actuales del Grupo de Investigación y Evaluación de la Psoriasis y la Artritis Psoriásica (GRAPPA) y de la Liga Europea contra el Reumatismo (EULAR) sugieren abordar todos los dominios activos de la enfermedad y las comorbilidades relevantes para la APs de un paciente determinado [3,4]. La actual directriz S3 sobre psoriasis recomienda que los dermatólogos lleven a cabo el diagnóstico y la selección del tratamiento de la APs de forma interdisciplinar en colaboración con un reumatólogo [5]. Según el algoritmo de tratamiento EULAR y GRAPPA, los csDMARDs se consideran tratamiento de primera línea, seguido del inhibidor de la PDE-4 apremilast, los biológicos (bDMARDs) o el uso de DMARDs sintéticos dirigidos como los inhibidores de la Janus quinasa (JAK) [3,4]. Los DMARD autorizados actualmente en Suiza en el área de indicación de la artritis psoriásica se muestran en la figura 1.
El apremilast y el TNF-α-i son opciones de tratamiento de eficacia probada
El apremilast es una “pequeña molécula” de administración oral que inhibe la fosfodiesterasa 4 (PDE-4). La inhibición de la PDE-4 promueve un aumento del AMP cíclico intracelular, lo que impide la síntesis de citoquinas proinflamatorias y aumenta las citoquinas antiinflamatorias (IL-10) [6]. Las directrices recomiendan apremilast en particular para la psoriasis con afectación ungueal, la APs periférica, la entesitis y la dactilitis. Los estudios ESTEEM demostraron eficacia en la psoriasis en placas y la afectación ungueal y los estudios PALACE aportaron pruebas de eficacia en la PsA [7,8]. Además, en varios ensayos controlados aleatorizados (ECR), se consiguió una respuesta ACR20 con una frecuencia significativamente mayor en la semana 16 con ambas dosis de apremilast (20 mg o 30 mg, 2x/d) que con placebo [9–12].
Los inhibidores del TNF-α son una opción de tratamiento biológico probada para la APs, para la que existen pruebas de eficacia en todos los dominios de la APs [6]. Según un metaanálisis, el adalimumab, el etanercept y el infliximab son equivalentes en términos de respuesta ACR20 [13].
¿”Golpear fuerte y pronto” con biológicos altamente eficaces?
Un enfoque para optimizar los resultados del tratamiento consiste en intervenir lo antes posible con productos biológicos altamente eficaces, de modo que pueda retrasarse o incluso evitarse el desarrollo de la APs [14]. Los pacientes con psoriasis de alto riesgo de desarrollar APs (artralgia, psoriasis ungueal o craneal o PASI>6) recibieron tratamiento con el inhibidor de la IL-17A secukinumab en el estudio IVEPSA. Tras un periodo de tratamiento de 24 semanas, las lesiones cutáneas, así como las puntuaciones de artralgia y sinovitis (evaluadas mediante TC y RMN) habían mejorado [15]. Y en otro estudio, el inhibidor de la IL12/23 ustekinumab produjo una reducción de la entesopatía subclínica periférica en 23 pacientes con psoriasis en placas de moderada a grave tras 12 semanas, y este efecto duró hasta la semana 52 [16]. Y también hay resultados de estudios sobre el inhibidor de la IL-23 guselkumab que apuntan en una dirección similar [17].
Estudios comparativos sobre los inhibidores de la IL-17A
En las últimas décadas, ha quedado claro que las células Th17, la IL-23 y la IL-17 desempeñan un papel inmunopatológico central [1]. Como resultado, los antagonistas del TNF-α ya no son la primera opción entre los biológicos para la APs; en su lugar, están ganando terreno el ustekinumab y los inhibidores de la IL-17A. En pacientes con APs que habían respondido de forma inadecuada a los csDMARDs, el IL-17A-i ixekizumab demostró ser superior al adalimumab en un estudio cara a cara, tanto en términos de mejora de la entesitis como de las lesiones cutáneas [18]. Y en un estudio cara a cara realizado por McInnes et al. El secukinumab fue al menos tan eficaz como el inhibidor del TNF-α para los criterios de valoración musculoesqueléticos, pero obtuvo mejores resultados en cuanto a la mejora de las lesiones cutáneas [19]. Según Sundanum et al. 2023, que muestran que la IL-17A-i en la APs tiene una base de pruebas cada vez mayor en términos de eficacia y seguridad [1]. El inhibidor de la IL-17A/F bimekizumab sólo está autorizado actualmente en Suiza para la psoriasis en placas, pero demostró ser superior al placebo en el estudio BE COMPLETE en términos de respuesta ACR50 en pacientes que habían recibido previamente terapia con TNF-α-i [20].
IL-23-i – dos representantes aprobados para la PsA
Risankizumab y guselkumab están actualmente autorizados en el área de indicación de la APs en Suiza. En los estudios KEEPsAKE, un número significativamente mayor de pacientes tratados con risankizumab lograron una respuesta ACR-20 en la semana 24 que los tratados con placebo [21,22]. La ampliación de la indicación del guselkumab se basa en los estudios DISCOVER. Tanto los pacientes sin tratamiento como los tratados previamente con TNF-α-i mostraron una respuesta ACR20 significativamente mayor con guselkumab en la semana 24 en comparación con el placebo [23–25]. El tildrakizumab, otro IL-23-i aprobado para la psoriasis en placas, tiene resultados positivos de un estudio de fase II en la APs; el programa del estudio INSPIRE de fase III aún no ha finalizado [26–28].
¿Y la vía de señalización JAK/STAT?
La familia JAK está formada por cuatro miembros: Janus quinasa (JAK)-1, JAK-2, JAK-3 y tirosina quinasa (TYK)-2. Los efectos inmunomoduladores y proinflamatorios están mediados a través de la vía de señalización JAK/STAT. El tofacitinib inhibe específicamente las JAK1 y JAK3. En un estudio de fase III, se demostró la eficacia del tofacitinib en comparación con el placebo tanto en pacientes con APs sin tratamiento previo como en pacientes tras el fracaso del tratamiento con TNF-α-i [30,31]. El upadacitinib inhibe la JAK1 y demostró ser superior al placebo en el estudio de fase III SELECT-PsA 1 en términos de respuesta ACR20. Además, el upadacitinib 15 mg no fue inferior al adalimumab, mientras que el JAK-i fue superior al adalimumab en la dosis de 30 mg, aunque se produjeron más acontecimientos adversos graves con el upadacitinib [32]. Y en el SELECT-PsA, los pacientes con APs en los que el TNF-α-i no era eficaz o que no podían tolerarlo lograron una respuesta ACR20 significativamente mayor y una tasa de ADM más elevada con upadacitinib (15 mg o 30 mg al día) [33]. En un estudio de fase II, el deucravacitinib, un inhibidor de TYK2, también demostró ser superior al placebo en ambas dosis (6 mg y 12 mg/día) en artritis, entesitis y dactilitis [34].
En cuanto a la seguridad de los miembros de la familia JAK, el estudio de vigilancia ORAL descubrió que los pacientes con artritis reumatoide tratados con tofacitinib presentaban un mayor riesgo de acontecimientos cardiovasculares que los tratados con TNF-α-i [35]. Como consecuencia, tanto la Agencia Europea del Medicamento (EMA) como la Administración de Alimentos y Fármacos de EE.UU. (FDA) han emitido una advertencia sobre el uso de JAK-i en pacientes mayores de 65 años, fumadores y en presencia de factores de riesgo cardiovascular, acontecimientos tromboembólicos o antecedentes de enfermedad maligna [6].
Literatura:
- Sundanum S, Orr C, Veale D: Targeted Therapies in Psoriatic Arthritis-An Update. Int J Mol Sci 2023 mar 28; 24(7):6384
- Zardin-Moraes M, et al: Prevalencia de pacientes con artritis psoriásica que alcanzan una actividad mínima de la enfermedad en estudios reales y ensayos clínicos aleatorizados: revisión sistemática con metaanálisis. J Rheumatol 2020; 47: 839.
- Gossec L, et al: Recomendaciones EULAR para el manejo de la artritis psoriásica con terapias farmacológicas: actualización de 2019. Ann Rheum Dis 2020; 79: S700-S712.
- Coates LC, et al: Grupo para la Investigación y Evaluación de la Psoriasis y la Artritis Psoriásica (GRAPPA): Recomendaciones de tratamiento actualizadas para la artritis psoriásica 2021 Nat Rev Rheumatol 2022; 18: 465-479.
- Nast A et al. Directriz alemana S3 sobre el tratamiento de la psoriasis vulgar, adaptada por EuroGuiDerm, register.awmf.org/assets/guidelines/013-001l_S3_Therapie-Psoriasis-vulgaris_2021-07-verlaengert.pdf, (última consulta: 23 de enero de 2024)
- Azuaga AB, Ramírez J, Cañete JD: Artritis psoriásica: patogenia y terapias dirigidas. Int J Mol Sci 2023; 24(5): 4901. doi: 10.3390/ijms24054901. www.mdpi.com/1422-0067/24/5/4901#,(última consulta: 23.01.2024)
- Papp K, et al: Apremilast, un inhibidor oral de la fosfodiesterasa 4 (PDE4), en pacientes con psoriasis en placas de moderada a grave: resultados de un ensayo de fase III, aleatorizado y controlado (ensayo de eficacia y seguridad que evalúa los efectos del apremilast en la psoriasis [ESTEEM] 1). JAAD 2015; 73: 37-49.
- Paul C, et al. Eficacia y seguridad del apremilast, un inhibidor oral de la fosfodiesterasa 4, en pacientes con psoriasis en placas de moderada a grave durante 52 semanas: un ensayo controlado aleatorizado de fase III (ESTEEM 2). Br J Dermatol 2015; 173: 1387-1399.
- Kavanaugh A, et al: Informe ampliado: Tratamiento de la artritis psoriásica en un ensayo de fase 3 aleatorizado y controlado con placebo con apremilast, un inhibidor oral de la fosfodiesterasa 4. Ann Rheum Dis 2014; 73: 1020.
- Cutolo M, et al: Un ensayo de fase III, aleatorizado y controlado de Apremilast en pacientes con artritis psoriásica: resultados del ensayo PALACE 2. J Rheumatol 2016; 43: 1724-1734.
- Edwards CJ, et al: Informe ampliado: Apremilast, un inhibidor oral de la fosfodiesterasa 4, en pacientes con artritis psoriásica y afectación cutánea actual: un ensayo de fase III, aleatorizado y controlado (PALACE 3). Ann Rheum Dis 2016; 75: 1065.
- Wells AF, et al: Monoterapia con apremilast en pacientes con artritis psoriásica sin DMARD: resultados del ensayo PALACE 4 aleatorizado y controlado con placebo. Reumatología 2018; 57: 1253.
- Fénix-Caballero S, et al: Comparación directa e indirecta de la eficacia y seguridad de adalimumab, etanercept, infliximab y golimumab en la artritis psoriásica. J Clin Pharm Ther 2013; 38: 286-293.
- Kimak A, et al: Artritis psoriásica: desarrollo, detección y prevención: una revisión exhaustiva. J Clin Med 2023; 12(11): 3850
- 15 Kampylafka E, et al. Intercepción de la enfermedad con inhibición de la interleucina-17 en pacientes de psoriasis de alto riesgo con inflamación articular subclínica: datos del estudio prospectivo IVEPSA. Arthritis Res 2019; 21: 178.
- Savage L, et al: Regresión de la entesopatía subclínica periférica en pacientes sin tratamiento tratados con ustekinumab para la psoriasis crónica en placas de moderada a grave: un estudio de viabilidad prospectivo, abierto y de cincuenta y dos semanas de duración. Arthritis Rheumatol 2019; 71 : 626-631.
- Haberman RH, et al: Eficacia del guselkumab, un inhibidor selectivo de la IL-23, en la prevención de la artritis en una cohorte multicéntrica de psoriasis en riesgo (PAMPA): Protocolo de un ensayo multicéntrico aleatorizado, doble ciego, controlado con placebo. BMJ Open 2022; 12:e063650.
- Mease PJ, et al: A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological-naïve patients with active psoriatic arthritis: 24-week results of a randomised, open-label, blinded-assessor trial. Ann Rheum Dis 2020;79: 123-131.
- McInnes IB, et al: Secukinumab frente a adalimumab para el tratamiento de la artritis psoriásica activa (EXCEED): Un ensayo de fase 3b, doble ciego, de grupos paralelos, aleatorizado y controlado de forma activa. Lancet 2020; 395: 1496-1505.
- Merola JF, et al: Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor-α inhibitors: A randomised, double-blind, placebo-controlled, phase 3 trial (BE COMPLETE). Lancet 2023; 401: 38-48.
- Kristensen LE, et al: Eficacia y seguridad del risankizumab para la artritis psoriásica activa: resultados a las 24 semanas del ensayo aleatorizado, doble ciego, de fase 3 KEEPsAKE 1. Ann Rheum Dis 2022; 81: 225-231.
- Östör A, et al: Eficacia y seguridad del risankizumab para la artritis psoriásica activa: resultados a las 24 semanas del ensayo aleatorizado, doble ciego, de fase 3 KEEPsAKE 2. Ann Rheum Dis 2022; 81: 351-358.
- Deodhar A, et al: Guselkumab in Patients with Active Psoriatic Arthritis Who Were Biologic-Naive or Had Previously Received TNFα Inhibitor Treatment (DISCOVER-1): Un ensayo de fase 3 doble ciego, aleatorizado y controlado con placebo. Lancet 2020: 395: 1115-1125.
- Mease PJ, et al: Guselkumab in Biologic-Naive Patients with Active Psoriatic Arthritis (DISCOVER-2): Un ensayo de fase 3 doble ciego, aleatorizado y controlado con placebo. Lancet 2020; 395: 1126-1136.
- Coates LC, et al: Eficacia y seguridad del guselkumab en pacientes con artritis psoriásica activa que no responden adecuadamente a los inhibidores del factor de necrosis tumoral: resultados a un año de un estudio de fase IIIb, aleatorizado y controlado (COSMOS). Ann Rheum Dis 2022; 81: 359-369.
- ClinicalTrials.Gov. Identificador: NCT04314544, https://clinicaltrials.gov,(último acceso 23/01/2024)
- ClinicalTrials.Gov. Identificador: NCT04314531, https://clinicaltrials.gov,(último acceso 23/01/2024)
- Mease PJ, et al: Eficacia y seguridad del tildrakizumab en pacientes con artritis psoriásica activa: resultados de un estudio de fase IIb aleatorizado, doble ciego, controlado con placebo, de dosis múltiples y 52 semanas Ann Rheum Dis 2021; 80: 1147-1157.
- Swissmedic: Información sobre medicamentos, https://swissmedicinfo.ch,(último acceso 23.01.2024)
- 30 Gladman D, et al: Tofacitinib para la artritis psoriásica en pacientes con una respuesta inadecuada a los inhibidores del TNF. NEJM 2017; 377: 1525-1536.
- Mease P, et al. Tofacitinib o adalimumab frente a placebo para la artritis psoriásica. NEJM 2017; 377: 1537-1550.
- McInnes IB, et al: Upadacitinib en pacientes con artritis psoriásica y una respuesta inadecuada a la terapia no biológica: datos de 56 semanas del estudio de fase 3 SELECT-PsA 1. RMD Open 2021; 7: e00183
- Mease PJ, et al: Upadacitinib para la artritis psoriásica refractaria a los biológicos: SELECT-PsA 2 Ann Rheum Dis 2021; 80: 312-320.
- Mease PJ, et al: Eficacia y seguridad del inhibidor selectivo de TYK2, deucravacitinib, en un ensayo de fase II en artritis psoriásica. Ann Rheum Dis 2022; 81: 815-822.
- Ytterberg SR, et al: Riesgo cardiovascular y de cáncer con tofacitinib en la artritis reumatoide. NEJM 2022; 386: 316-326.
PRÁCTICA DERMATOLÓGICA 2024; 34(1): 40-41