La diabetes tipo 1 es una de las enfermedades metabólicas más comunes en niños y adolescentes. Un diagnóstico de diabetes tipo 1 supone una carga considerable para los afectados y sus familias, especialmente en los niños pequeños. Gracias al desarrollo de terapias inmunomoduladoras y de insulina basadas en fármacos y a los crecientes avances tecnológicos, se dispone de opciones terapéuticas cada vez más innovadoras para alcanzar los valores objetivo definidos internacionalmente. La terapia más moderna actualmente disponible es el acoplamiento del sistema de sensores, el algoritmo de control y la bomba de insulina, el sistema AID (administración automatizada de insulina).
La diabetes tipo 1 es una de las enfermedades metabólicas más comunes en niños y adolescentes. Actualmente (2021) hay 26.642 personas con diabetes tipo 1 en Suiza, con una incidencia de unos 20 nuevos casos por cada 100.000 niños y adolescentes <16 años. La edad media en el momento del diagnóstico fue de 8,8 años (datos por cortesía de Daniel Konrad, Sociedad Suiza de Endocrinología y Diabetología Pediátricas). Durante años se ha observado un aumento de la incidencia en la infancia y la adolescencia. Se supone que el número de casos se duplicará cada 20 años. Los niños que enferman son cada vez más jóvenes, por lo que la carga patológica acumulada de glucosa y el riesgo de enfermedades cardiovasculares secundarias son correspondientemente mayores. Según las estimaciones estadísticas, la pérdida de esperanza de vida para la diabetes que se manifiesta antes de los 10 años es de unos 17 años, dependiendo por supuesto del control metabólico [1,2].
Puede realizar el examen CME en nuestra plataforma de aprendizaje después de revisar los materiales recomendados. Haga clic en el siguiente botón:
Especialmente desde el estudio DCCT [3], se ha reconocido lo importante que es mantener los niveles de glucosa dentro de un intervalo objetivo definido para evitar complicaciones posteriores. Por lo tanto, el diagnóstico de la diabetes tipo 1 también supone una carga considerable para los afectados y sus familias, sobre todo en la primera infancia. Gracias al desarrollo de terapias inmunomoduladoras y de insulina basadas en fármacos y a los crecientes avances tecnológicos, se dispone de opciones terapéuticas cada vez más innovadoras para alcanzar los valores objetivo definidos internacionalmente. La terapia más moderna actualmente disponible es el acoplamiento del sistema de sensores, el algoritmo de control y la bomba de insulina, el sistema AID (administración automatizada de insulina) .
Desarrollo de la tecnología para la diabetes
La terapia con bomba de insulina (CSII) se utiliza de forma rutinaria en la medicina de adultos desde la década de 1980. En la década de 2000, se estableció cada vez más como una terapia estándar para niños y adolescentes. El desarrollo ulterior de los sensores de glucosa hizo posible los sistemas de bomba de insulina asistidos por sensores, es decir, el acoplamiento del sensor y la bomba de insulina. [4,5] Inicialmente, era posible interrumpir el suministro de insulina en caso de hipoglucemia (LGS, Low Glucose Suspend ) (PARADIGM VEO), más tarde una interrupción predictiva y anticipatoria del suministro de insulina en caso de hipoglucemia inminente (PLGM, Predictive Low Glucose Management) (MiniMed 640G) Dependiendo del sistema, el suministro de insulina se interrumpe durante 5-120 minutos hasta que se vuelve a alcanzar con seguridad un valor objetivo de glucosa definido. En los últimos años, los sistemas AID han llevado la terapia con insulina al siguiente nivel de control automático.
Al mismo tiempo, personas ambiciosas con diabetes de tipo 1 (“Comunidad Looper”, “#WeAreNotWaiting”), que no querían esperar a los sistemas disponibles en el mercado, desarrollaron por sí mismas algoritmos de código abierto e instrucciones de construcción, los acoplaron a bombas de insulina y sistemas CGM convencionales y los convirtieron en sistemas semiautomatizados. Estos sistemas de código abierto o “hágalo usted mismo” (DIY) están sujetos a un proceso de mejora continua por parte de los usuarios, conducen a resultados de buenos a muy buenos y han promovido el desarrollo posterior de sistemas autorizados comercialmente [6,7]. Sin embargo, al utilizar estos sistemas de bricolaje, hay que tener en cuenta que la responsabilidad del fabricante expira cuando estos productos sanitarios se utilizan para fines distintos a los especificados por el fabricante. No se someten a un procedimiento de autorización. A diferencia de los medicamentos, que también pueden utilizarse fuera de la autorización (uso fuera de lo indicado) con la indicación adecuada y el consentimiento de los padres, esta opción no está disponible para los productos sanitarios sólo por motivos legales.
Debido a los datos convincentes y a la experiencia sistemáticamente positiva en todos los grupos de edad, los sistemas de AID se recomiendan en las directrices de consenso de la ISPAD [8,9] y también en las directrices S3 de la Sociedad Alemana de Diabetes [10] en todos los grupos de edad.
AID – Dosificación automática de insulina
Los sistemas AID constan de tres componentes: Un sensor de glucosa, un algoritmo de cálculo y una bomba de insulina. El algoritmo de cálculo se integra en la bomba de insulina, en una aplicación para smartphone o en un dispositivo portátil independiente y se acopla al sistema de sensores. El algoritmo de cálculo controla la administración de insulina basal adaptativa.
Los sistemas de identificación automática disponibles actualmente en el mercado se basan en diferentes algoritmos de cálculo que proceden originalmente de la tecnología de control industrial. El principio básico es que se miden los valores de glucosa y el algoritmo determina la diferencia entre el valor actual y un valor objetivo definido y lo utiliza para calcular el cambio en la variable manipulada que debe suministrarse. La variable de control, la insulina, se libera y el ciclo comienza de nuevo. Existen tres algoritmos de cálculo principales que pueden utilizarse [11].
| Criterios de selección para una ayuda |
| – Restricción de edad |
| – Cantidad de insulina/peso corporal |
| – Control: aplicación, bomba, dispositivo independiente |
| – ¿Manguera sí/no? |
| – Preferencia de sensor |
| – Problemas de piel |
| – Facilidad de uso |
| – Carga automática de datos |
PID (Proporcional-Integral-Derivativo)
Este algoritmo es relativamente sencillo, sin simulación compleja de una curva de glucosa. Funciona del mismo modo que un regulador de temperatura en la tecnología de calefacción, que intenta mantener la temperatura ambiente constante en un valor objetivo definido. Sólo requiere el ajuste de unos pocos parámetros, como la duración de acción de la insulina y las proporciones de IA, pero sólo puede compensar de forma limitada las fuertes fluctuaciones de la glucosa (MiniMed 780G).
MPC (control predictivo de modelos)
Se basa en un modelo de referencia que intenta mejorar iterativamente las variables del proceso. La evolución actual de los valores se compara con la referencia. Se utiliza para calcular lo grande que debe ser el cambio en la variable manipulada para volver al modelo de referencia. La calidad de las variables del proceso es crucial (CamAPS FX, myLife; Control IQ, Tandem ; OmniPod 5, Insulet; DBLG1, Diabeloop).
Lógica difusa
Se trata de un modelo matemático de incertidumbre que se utiliza, por ejemplo, en los sistemas inteligentes de control de semáforos y adapta la duración de la fase semafórica al volumen de tráfico. Puede hacer frente a la vaguedad de las decisiones humanas y realiza ajustes según el principio “si-entonces”. Para ello, el algoritmo necesita muchos escenarios posibles, ya que sólo puede funcionar en escenarios conocidos [12].
El reto para todos los algoritmos son los numerosos factores de influencia desconocidos. Por la noche, normalmente pueden alcanzarse niveles normales de glucosa en el intervalo objetivo con un pequeño margen de fluctuación. Por el contrario, el transcurso del día está sujeto a muchos factores de influencia variables, como las diferentes comidas, los factores de estrés psicológico fluctuantes o la actividad física espontánea. La principal diferencia entre los sistemas de identificación automática radica en los parámetros que el usuario puede modificar activamente y los que están predefinidos por el sistema. Este es también un factor decisivo en el asesoramiento sobre la selección del sistema.
| Valores objetivo para el control metabólico |
| – HbA1c <7% (53 mmol/mol) |
| – Tiempo en rango (TiR) 70-180 mg/dl (3,9-10 mmol/l): >70% |
| – Tiempo por debajo del rango (TbR) 54-70 mg/dl (3,0-3,9 mmol/l): <4% |
| – Tiempo por debajo del rango (TbR) <54 mg/dl (3,0 mmol/l): <1% |
| Futuro: Tight in Tight Range (TiTR) 70-140 mg/dl (3,9-7,8 mmol/l): >50% [22] |
Los sistemas de AID disponibles en la actualidad son sistemas de “AID híbridos” con un suministro de insulina adaptable, basal e independiente de los alimentos. Los bolos de insulina prandiales y los bolos de corrección, raramente necesarios, deben seguir introduciéndose manualmente, de ahí lo de “AYUDA híbrida”.
El desarrollo técnico de estos sistemas avanza rápidamente, por lo que cabe esperar nuevos sistemas cada 18 meses por término medio. Los sistemas autorizados en Europa se muestran en la Tabla 1. La bomba mylife Ypsopump con la aplicación mylife CamAPS FX, el Tandem t:slim X2 con Control IQ y el MiniMed 780G de Medtronic son sistemas de ayuda para niños y adolescentes que pueden recetarse en Suiza. Actualmente sólo se dispone de un sistema, especialmente para las familias con niños pequeños, para las que es especialmente difícil lograr un control metabólico cercano a la norma. En Alemania, el OmniPod 5 también es prescribible para niños a partir de 2 años desde otoño de 2023.
¿Qué sistema de ayuda para quién?
La decisión a favor de un sistema de ayuda es individual. No todos los sistemas se adaptan a todas las personas. En la decisión intervienen varios factores. En primer lugar, hay que tener en cuenta las restricciones de edad. Para los niños <6 años, actualmente sólo existe en Suiza un sistema de ayuda (CamAPS FX a partir de 1 año) [13]. En Alemania, el OmniPod 5 (a partir de dos años) es un segundo sistema disponible para niños <6 años. A partir de los seis años, el t:slim X2 Control IQ es otra opción y a partir de los siete años el MiniMed 780G [14,15]. Además del límite de edad, el peso corporal o la cantidad mínima de insulina también pueden influir en la decisión. Es importante considerar si el control debe realizarse a través de una aplicación para smartphone, la bomba de insulina o una unidad de control independiente. Otro factor es la facilidad de uso, la aplicación principalmente mediante iconos (CamAPS FX) para las barreras lingüísticas o comidas fijas (CamAPS FX) para la discalculia puede ser de gran ayuda. Si el OmniPod 5 está disponible, la cuestión de una bomba de insulina con o sin sonda suele ser central [16]. A la hora de tomar una decisión, debe tenerse en cuenta la preferencia por un sistema de sensores con el que pueda acoplarse la bomba de insulina. Si existe algún problema cutáneo debido a la intolerancia a determinadas composiciones de yeso o carcasa, esto puede limitar las opciones de selección. Un último factor decisivo a favor o en contra de un sistema de ayuda puede ser el software. Cada sistema de identificación automática puede leerse directamente a través de un programa informático; hasta ahora no existe un programa informático compatible con todos los sistemas, es decir, cada institución supervisora debe poder adquirir y costearse diferentes sistemas informáticos.
Para simplificar el proceso de toma de decisiones, sería deseable que los tres componentes del sistema AID pudieran combinarse libremente. La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) se ha fijado el objetivo de lograr esta interoperabilidad y ha definido objetivos y normas para los sensores y las bombas de insulina. En Europa, el objetivo de interoperabilidad con el Reglamento de Productos Sanitarios, que entró en vigor en mayo de 2021, aún no es previsible [17]. Desde noviembre de 2022, el “MyLife CamAPS FX” es al menos un sistema de ayuda que puede utilizarse con dos sensores de glucosa diferentes. También se espera que el “t:slim X2 Control IQ” sea compatible con dos sistemas de sensores diferentes (Dexcom G6 y G7) a principios de 2024.
Destino a la vista – con ayuda
En general, el inicio precoz de la terapia con bomba de insulina en los primeros seis meses tras el diagnóstico es superior al uso posterior, dos o tres años después de la manifestación de la diabetes. La comparación de más de 8332 pacientes de 311 centros de diabetes de Alemania, Suiza, Austria y Luxemburgo muestra que el uso precoz de una bomba de insulina en niños y adolescentes condujo a un mejor control metabólico, hipoglucemias menos graves y mejores niveles de presión arterial y colesterol [18]. En la actualidad se ha evaluado ampliamente la eficacia y la seguridad de los sistemas de AID. En comparación con todas las demás formas de terapia, los valores objetivo recomendados internacionalmente son más fáciles de alcanzar con los sistemas de AID. El objetivo es alcanzar valores de HbA1c <7% (53 mmol/mol), tiempo en rango (TiR) >70% (aprox. 16 horas al día), tiempo por debajo del rango (TbR) <4% (<1 hora al día). Se describen valores medios de glucosa más bajos, menor variabilidad en la progresión de la glucosa, mejor calidad del sueño y menor tiempo dedicado al control de la diabetes [19–21].
En resumen, los sistemas de AID, independientemente del sistema con el algoritmo que se utilice, conducen a una mejora significativa de los resultados de la terapia. Esto a su vez significa que se están debatiendo objetivos terapéuticos o valores objetivo más estrechos, como el 50% de tiempo en rango estrecho (TiTR 70-140 mg/dl o 3,9-7,8 mmol/l) [23,24], que ya pueden aplicarse y alcanzarse en Suecia, por ejemplo. En general, los usuarios que ya alcanzan un TiR elevado al inicio de la terapia con AID obtienen los mejores resultados. Por otro lado, los que inicialmente tienen un control metabólico demasiado elevado son los que más se benefician en términos porcentuales [25].
¿Cómo funciona un sistema AID?
Ayuda y corrección
Todos los sistemas de AID pueden corregir las excursiones de glucosa aumentando la administración de insulina. Dependiendo del sistema, la corrección automática tiene lugar mediante bolos de corrección automática (t:slim X2 Control IQ), modulación de la tasa basal adaptativa (MiniMed 780G, OmniPod 5, CamAPS FX) y/o microbolos suministrados adicionalmente (MiniMed 780G, OmniPod 5) (Fig. 1) . Si, por ejemplo, la corrección se efectúa mediante microbolos adicionales o bolos de corrección automáticos, la tasa basal previamente regulada al alza vuelve a reducirse posteriormente, de modo que la insulina basal y la del bolo de corrección no pueden diferenciarse claramente. Esto significa que debe abandonarse la suposición mantenida durante mucho tiempo de una proporción basal/bolso de 50:50 o 60:40. En última instancia, no importa si la insulina entrante es basal o en bolo.
Gestión de comidas con AID
Con todos los sistemas disponibles en el mercado, la insulina de las comidas debe administrarse manualmente. El anuncio de la comida debe introducirse directamente en la bomba de insulina (MiniMed 780G, t:slim X2 Control IQ), en una unidad de control (OmniPod 5) o a través de una aplicación para smartphone (CamAPS FX). Además de introducir los hidratos de carbono al gramo exacto, en algunos sistemas se pueden predefinir comidas semicuantitativas o utilizar factores de cálculo (CamAPS FX). Aunque el cálculo de hidratos de carbono sigue desempeñando un papel, cada vez es menos importante, ya que los objetivos internacionales también pueden alcanzarse con cantidades fijas de hidratos de carbono personalizadas [26]. Por lo general, las desviaciones de cantidad del 10-20% aún pueden ser compensadas fácilmente por el sistema. El bolo de insulina para las comidas se calcula utilizando la relación insulina/carbohidratos (ICR = Insulin Carb Ratio). Esto define cuántos gramos de carbohidratos cubre una unidad de insulina (U). Es importante formar a los usuarios en consecuencia, ya que replantearse la forma en que se ha estado calculando el KE o el BE durante años no es fácil de aplicar y alberga un gran potencial de error. Sigue siendo necesaria una revisión periódica del ICR y, en algunos casos, también una formación de seguimiento.
La tasa basal también debe ajustarse regularmente a las necesidades actuales. Con el sistema “Control IQ”, esto es necesario para la aplicación de la terapia AID, con todos los demás sistemas se requiere como respaldo.
La excursión postprandial de glucosa no debe superar los 60 mg/dl (3,3 mmol/l) respecto al valor basal preprandial 2-3 horas después de comer (Fig. 2 ). Por lo general, se pueden cubrir bien cantidades de carbohidratos de 60-80 g. Para cantidades muy grandes de hidratos de carbono, puede fijarse una administración máxima de bolo si es necesario para protegerse de una administración excesiva de insulina y de una hipoglucemia consecutiva.
Suele necesitarse menos insulina para las comidas copiosas. Además de calcular las cantidades de hidratos de carbono, con las bombas de insulina convencionales resultaba útil calcular las unidades de grasa-proteína (FPE) de las comidas ricas en grasas y proteínas para poder utilizar eficazmente funciones como el “bolo doble” o el “bolo retardado”. Algunos sistemas AID también ofrecen la opción de responder explícitamente a las comidas que contienen grasas y proteínas, por ejemplo introduciendo un bolo “doble” o “retardado” (t:slim X2 Control IQ) o modificando la capacidad de respuesta de la glucosa introduciendo comidas de absorción lenta (CamAPS FX). Otros sistemas reaccionan del mismo modo que una corrección, modulando la tasa basal o emitiendo autocorrecciones adicionales.
Además del aporte casi exacto de hidratos de carbono, el momento del intervalo de ingesta del bolo iniciado manualmente sigue desempeñando un papel importante. El bolo alimenticio debe administrarse al menos 10, preferiblemente 20 minutos antes de la comida. Si la administración se retrasa, el algoritmo aumenta la administración actual de insulina debido al aumento del nivel de glucosa. Un bolo iniciado demasiado tarde durante o después de la comida no se incluye en el cálculo, ya que provocaría un apilamiento de insulina y probablemente una hipoglucemia consecutiva (Fig. 3) . Como regla general se recomienda Si se olvidó administrar un bolo de comida a tiempo, la mitad del bolo de comida debería administrarse aún 30-60 minutos después de la comida, es decir, antes de que el algoritmo intente compensar la comida completa. Si han pasado más de 60 minutos desde la comida, el usuario puede administrar un bolo de corrección recomendado por el sistema. En general, hay que tener en cuenta la hora del día (especialmente del desayuno), el valor actual de la glucosa, la tendencia de la glucosa y la composición de la comida para administrar el bolo alimenticio a tiempo.
AYUDA y actividad física
Adaptar la terapia al deporte es un reto importante, independientemente de la forma de terapia. Deben tenerse en cuenta numerosos factores que influyen, como la hora del día, la intensidad, el tipo y la duración del deporte, el nivel de forma física individual, la actividad física habitual o nuevas formas de ejercicio, el ciclo menstrual, pero también el valor y la tendencia actuales de la glucosa. Aunque se tengan en cuenta todos los factores mencionados y el deporte se realice de forma razonablemente estandarizada, la curva de glucosa siempre variará. No sólo el deporte, sino también la gestión de la actividad física en la vida cotidiana que deliberadamente no se define como deporte, como ir en bicicleta al colegio, correr hacia el autobús o retozar en la guardería o durante el recreo escolar, representa a menudo un desafío individual diario entre la hipo y la hiperglucemia. Los sistemas AID pueden ayudar a mantener estables los niveles de glucosa antes, durante y después de la actividad física y reducir la hipoglucemia incluso hasta 24 horas después del ejercicio.
Mientras que sin AID, la gestión deportiva se consigue reduciendo el porcentaje de insulina basal y/o prandial, los sistemas AID actúan aumentando el valor objetivo de glucosa y la sensibilidad a la insulina. El modo deportivo para “CamAPS FX” “Ease off”, por ejemplo, funciona con estos dos tornillos de ajuste. Puede programarse hasta con 24 horas de antelación. La insulina en bolo permanece inalterada. En “modo actividad”, “Control IQ” aumenta el rango objetivo a 140-160 mg/dl (7,8-8,9 mmol/l) y la sensibilidad a la insulina. Con el sistema “MiniMed 780G”, el objetivo temporal puede aumentarse a 150 mg/dl (8,3 mmol/l). No se emiten autocorrecciones para el aumento temporal del valor objetivo. Cuando se utiliza el OmniPod 5 en modo deporte, el valor objetivo de glucosa también aumenta a 150 mg/dl (8,3 mmol/l) y la administración automática de insulina también se reduce durante un periodo de 1 a 24 horas [27].
Con todos los sistemas, lo ideal es ajustar el modo deporte o actividad al menos 1-2 horas antes del inicio de la actividad física, especialmente el ejercicio aeróbico. Durante una sesión de entrenamiento muy extenuante o larga, por ejemplo el día de una competición, el modo deporte puede permanecer activado hasta 24 horas para reducir la hipoglucemia causada por el efecto de reposición de glucógeno del músculo. Durante las sesiones de entrenamiento anaeróbico y también las de entrenamiento aeróbico intensivo más cortas, se puede intentar dejar inicialmente el sistema de AID en “modo normal”, ya que las hormonas contrainsulinas adrenalina, noradrenalina y cortisol provocan inicialmente un aumento de la glucosa, que puede requerir insulina correctora. Lo ideal es que el valor de la glucosa se sitúe entre 125 y 180 mg/dl (6,9-10 mmol/l) antes del inicio y después del final del entrenamiento [28]. Si se planea un entrenamiento corto e intensivo, un valor de glucosa más bajo es más adecuado para el inicio, mientras que un valor de glucosa más alto es más adecuado para un entrenamiento más largo y moderado. Los sistemas de ayuda facilitan la gestión del deporte y el ejercicio, pero también alcanzan sus límites cuando se trata de una actividad espontánea, muy intensa o prolongada y el modo deportivo no se ajusta a tiempo.
Personalización de la terapia con AID
Debido al uso predominante de los sistemas CGM, el “perfil de glucosa ambulatorio” (AGP) ya ha sustituido al ajuste terapéutico exclusivo mediante protocolos de HbA1c y glucosa en sangre. Además del valor de HbA1c, el análisis de TiR, TbR, GMI, los valores medios de glucosa, el rango de variación y también la duración del sensor ya son estándar en las consultas diabetológicas. Con los sistemas AID, se dispone de datos continuos en tiempo real en la nube. Sólo el “t:slim Control IQ” sigue necesitando que se carguen activamente los datos del sistema. Además de los parámetros estadísticos de la AGP, se puede analizar con precisión el comportamiento individual de los usuarios, como la administración puntual de un bolo alimenticio o el uso de diferentes modos. El ajuste individualizado de los parámetros es teóricamente posible en cualquier momento. Esto también abre nuevas posibilidades para una atención individualizada y de calidad garantizada en el campo de la telemedicina.
La ayuda, ¿un éxito seguro?
¿AID y las cosas van bien? No es tan sencillo, un sistema de ayuda no es un éxito seguro. Cuanto más pequeño sea el niño, mayor será el esfuerzo necesario para alcanzar los objetivos metabólicos. En el caso de los niños pequeños, la responsabilidad de la terapia recae en los cuidadores. Los niños pequeños aún no están preparados para la escuela. Pueden captar y comprender parcialmente algunos aspectos de su terapia, pero no pueden leer ni hacer cálculos matemáticos. La preparación escolar comienza en la edad de la escuela primaria. Sólo cuando alcanzan la edad escolar, normalmente cuando pasan a la escuela secundaria, los niños son capaces de reconocer y realizar cálculos sencillos que son necesarios para tomar la decisión de administrarse insulina. Las exigencias y los retos que los padres tienen que afrontar hasta ese momento son correspondientemente altos [29].
Independientemente de la edad, es importante que se tengan en cuenta las expectativas del sistema de ayuda correspondiente. Antes de tomar una decisión a favor de un sistema u otro, deben demostrarse los sistemas disponibles y homologados correspondientes y explicarse sus ventajas e inconvenientes. Una vez seleccionado un sistema, es esencial una formación cualificada y adecuada a la edad. Sólo se puede lograr un éxito terapéutico sostenible si se comprende el sistema de ayuda y se pueden cumplir los requisitos que impone de forma adecuada y acorde con la situación [30,31]. Si las funciones del sistema no se comunican adecuadamente y no se satisfacen las necesidades y expectativas, esto puede conducir a la interrupción prematura de la terapia [32].
AYUDA y estrés mental
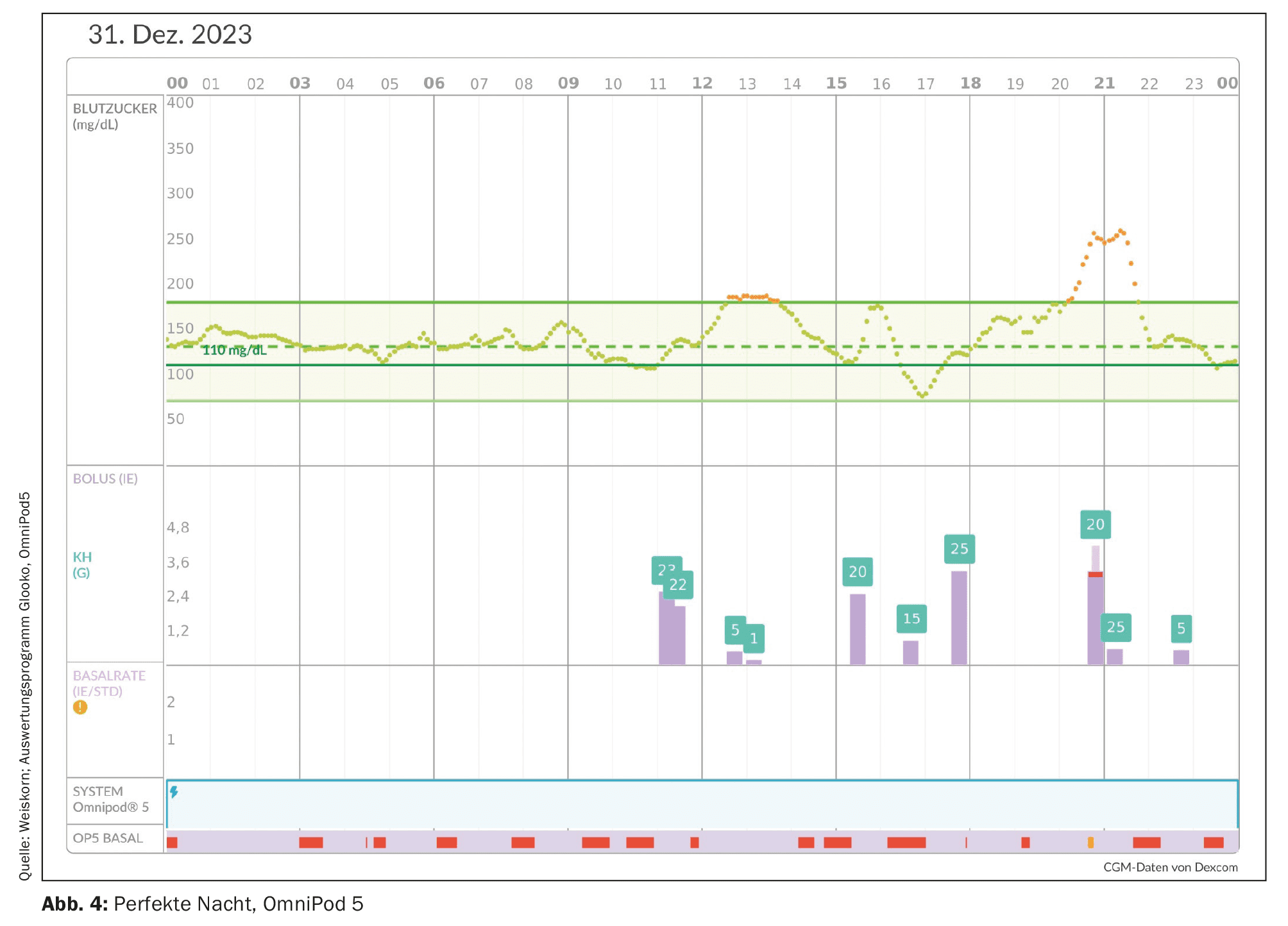
Uno de los argumentos a favor de un sistema de AID suele ser la reducción del estrés psicológico y la mejora de la calidad de vida. Esto es especialmente cierto para los padres que han sufrido trastornos del sueño nocturno debido a las numerosas alarmas nocturnas por hipoglucemia inminente y mediciones de glucosa en sangre. Con los sistemas AID se pueden conseguir buenos valores de glucosa con un rango de fluctuación reducido, especialmente durante la noche. [33] La hipoglucemia nocturna y las alarmas se reducen y la calidad del sueño mejora significativamente (Fig. 4). Una noche de sueño reparador se asocia a una psique más estable y puede reducir las tendencias a la depresión. También se describe una reducción de la “hipoansiedad” [34].
Para las personas para las que las subidas o bajadas de glucosa son difíciles de tolerar y que tienden a hacer correcciones precipitadas, un sistema de ayuda que se encargue de la corrección de forma independiente puede ser un alivio y reducir el estrés. Sin embargo, esta misma fuerza de los sistemas, la dosificación automática de insulina, también puede tener el efecto contrario. Si los usuarios no confían en el sistema, tienen miedo de perder el control o de dejar la terapia en manos del algoritmo, no se alcanzan los objetivos de la terapia y se defraudan las expectativas.
Resumen y perspectivas
En diabetología pediátrica, los sensores de glucosa y las bombas de insulina son la terapia estándar. El acoplamiento de ambos componentes y su combinación con un algoritmo para formar un sistema de identificación automática se utiliza cada vez más en todo el mundo. Los objetivos de la terapia pueden alcanzarse más fácilmente y pueden mejorarse los aspectos psicosociales. Para lograr un éxito terapéutico duradero, la elección de un sistema debe hacerse individualmente, teniendo en cuenta todas las restricciones de autorización, junto con la familia y el equipo de atención diabética. Un requisito previo para un uso rentable es una formación estructurada y adecuada a la edad en la que se enseñe la funcionalidad del sistema y cómo utilizarlo.
En la actualidad, los sistemas AID están sometidos a un continuo perfeccionamiento que culminará en el sistema de “bucle totalmente cerrado”. Para lograr este objetivo, sin duda se necesitan sistemas bi-hormonales, que son objeto de investigación en la actualidad pero que aún no están disponibles comercialmente.
El rápido desarrollo y crecimiento de los sistemas comerciales de AID supone un gran reto para los equipos de diabetología a la hora de garantizar una atención de calidad. Deben crearse estructuras que permitan el asesoramiento, la formación y la comunicación urgentemente necesarios de las funciones detalladas del sistema.
En conclusión, todos los sistemas aprobados en Europa son seguros y eficaces y pueden conducir a un mejor control glucémico. Esto se refleja no sólo en una mayor TiR, sino también en unos valores más bajos de HbA1c y, en última instancia, conlleva un menor riesgo de enfermedades secundarias asociadas a la diabetes y una reducción de la carga que soportan los niños y adolescentes con diabetes tipo 1 y sus familias.
Mensajes para llevar a casa
- En diabetología pediátrica, los sensores de glucosa y las bombas de insulina son la terapia estándar. El acoplamiento de ambos componentes y su combinación con un algoritmo para formar un sistema de AID se utiliza cada vez más en todo el mundo.
- Los objetivos de la terapia pueden alcanzarse más fácilmente y pueden mejorarse los aspectos psicosociales.
- Para lograr un éxito terapéutico duradero, la elección del sistema debe hacerse de forma individual, junto con la familia y el equipo de atención diabética.
- Un requisito previo para un uso rentable es una formación estructurada y adecuada a la edad en la que se enseñe la funcionalidad del sistema y cómo utilizarlo. Los niños pequeños aún no están preparados para la escuela, por lo que la responsabilidad de la terapia recae en los cuidadores.
Conflictos de intereses
- Dra. Jantje Weiskorn, especialista en pediatría y medicina del adolescente, diabetología; obesióloga. Intereses financieros: Honorarios por conferencias: Amryt Pharma
- Dr. Felix Reschke, especialista en pediatría y medicina del adolescente, diabetología y endocrinología, medicina paliativa, asesoramiento genético especializado; intereses financieros: Honorarios por conferencias: Kyowa Kirin
- Dra. Thekla von dem Berge, especialista en pediatría y medicina del adolescente, diabetología; Intereses financieros: Honorarios por conferencias: Medtronic, Ypsomed, Novo Nordisk, VitalAire, Ascensia y Sanofi
- Dra. Mareike Niemeyer, especialista en pediatría y medicina del adolescente, diabetología; Intereses financieros: Ninguno
- PD Dr. Torben Biester, especialista en pediatría y medicina del adolescente, diabetología, medicina de urgencias, asesoramiento genético especializado; intereses financieros: Honorarios por conferencias: AstraZeneca, Insulet, Lilly, Medtronic, NovoNordisk, Roche, Sanofi, Ypsomed. – Junta consultiva: Ascensia, Medtronic, Insulet, Sanofi, Ypsomed
Literatura:
- Rawshani A, et al.: Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: a nationwide, register-based cohort study. Lancet 2018; 392: 477–486; doi: 10.1016/S0140-6736(18)31506-X.
- Arffman M, et al.: Long-term and recent trends in survival and life expectancy for people with type 1 diabetes in Finland. Diabetes Research and Clinical Practice 2023; 198: 110580.
- Diabetes Control and Complications Trial Research Group, N. D., Genuth S, et al.: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 30(14): 977–986.
- Forlenza GP, et al.: Predictive low-glucose suspend reduces hypoglycemia in adults, adolescents and children with type 1 diabetes in an at-home randomized cross-over study: results of the PROLOG Trial. Diabetes Care 2018; 41(10): 2155–2161.
- Biester T, et al.: «Let the Algorithm Do the Work»: Reduction of hypoglycemia using sensor-augmented pump therapy with predictive insulin suspension (smardguard) in pediatric type 1 diabetes patients. Diabetes Technol Ther 2017; 19(03): 173–182.
- Drew L, et al.: DIY «bionic pancreas» is changing diabetes care – what’s next? Nature 2023; 620: 940–941.
- Burnside MJ, et al.: Open-Source Automated Insulin Delivery in Type 1 Diabetes. N Engl J Med 2022; 397(10): 869–881.
- Sherr JL, Schoelwer M, Dos Santos TJ, et al: ISPAD Clinical Practice Consensus Guidelines 2022: Diabetes technologies: Insulin delivery.
Pediatr Diabetes 2022; 23(8): 1406-1431; doi: 10.1111/pedi.13421. - Sundberg F, de Beaufort C, Krogvold L, et al.: ISPAD Clinical Practice Consensus Guidelines 2022: Managing diabetes in preschoolers. Pediatr Diabetes 2022; 23(8): 1496–1511; doi: 10.1111/pedi.13427.
- Directriz S3 Diagnóstico, terapia y seguimiento de la diabetes mellitus en la infancia y la adolescencia(https://register.awmf.org/de/leitlinien/detail/057-016).
- Biester T, Reschke R, et al.: Moderne Insulintherapie durch interaktive Systeme bei Kindern mit Diabetes mellitus Typ 1. Internistische praxis 2023; 66/4.
- Digital Corner AID-Systeme in der Praxis – Status quo und Potenzial der Diabetes Technologie.
- Tauschmann M, et al.: Closed-loop insulin delivery in suboptimally controlled type 1 diabetes: a multicenter, 12-week randomized trial. Lancet 2018; 392: 1321-1329; doi: 10.1016/S0140-6736(18)31947-0.
- Bergenstal RM, et al.: A comparison of two hybrid closed-loop systems in adolescents and young adults with type 1 diabetes (FLAIR): a multicenter, randomized, crossover trial. Lancet 2021; 397: 208-219; doi: 10.1016/S0140-6736(20)32514-9.
- Collyns OJ, et al.: Improved Glycemic Outcomes With Medtronic MiniMed Advanced Hybrid Closed-Loop Delivery: Results From a Randomized Crossover Trial Comparing Automated Insulin Delivery With Predictive Low Glucose Suspend in People With Type 1 Diabetes. Diabetes Care 2021; 44(4): 969-975; doi: 10.2337/dc20-225.
- Sherr JL, et al.: Safety and Performance of the Omnipod Hybrid Closed-Loop System in Adults, Adolescents, and Children with Type 1 Diabetes Over 5 Days under Free-Living Conditions. Diabetes Technol Ther 2020; 22(3): 174-184.
https://health.ec.europa.eu/system/files/2020-07/md_generic_ fs_es_0.pdf.- Kamrath C, et al.: Early versus delayed insulin pump therapy in children with newly diagnosed type 1 diabetes: results from the multicenter, prospective diabetes follow-up DPV registry. The Lancet Child & Adolescent Health 2021; 5(1): 17–25.
- Pease A, et al.: Time in Range for Multiple Technologies in Type 1 Diabetes: A Systematic Review and Network Metaanalysis. Diabetes care 2020; 43: 1967–1975.
- Jiao X, et al: Mejor TIR, HbA1c y menos hipoglucemia en el sistema de bucle cerrado de insulina en pacientes con diabetes tipo 1: un metaanálisis. BMJ Open Diabetes Res Care 2022; 10(2).
- Beck RW, et al.: A Meta-Analysis of Randomized Trial Outcomes for the t:slim X2 Insulin Pump with Control_IQ Technology in Youth and Adults from Age 2 to 72. Diabetes Technol Ther 2023.
- Battelino T, Alexander CM, et al.: Continuous glucose monitoring and metrics for clinical trials: an international consensus statement. Lancet Diabetes Endocrinol 2022; doi: 10.1016/S2213-8587(22)00319-9.
- Passanisi S, et al.: Aiming for the Best Glycemic Control Beyond Time in Range: Time in Tight Range as a new CGM Metric in Children and Adolescents with Type 1 Diabetes using Different Treatment Modalities. Diabetes Technol Ther 2023; doi: 10.1089/dia.2023.0373.
- Beck RW, et al.: A Comparison of Continuous Glucose Monitoring-Measured Time-in-Range 70–180 mg/dl Versus Time-in Tight-Range 70–149 mg/dl. Diabetes Technol Ther 2023; doi: 10.1089/dia.2023.0380.
- Schoelwer MJ, et al.: Predictors of Time-in-Range (70-180 mg/dl) Achievend Using a Closed-Loop Control System. Diabetes Technol Ther 2021; doi: 10.1089/dia20200646.
- Petrovski G, Campbell J, et al.: Simplified Meal Announcement Versus Precise Carbohydrate Counting in Adolescents With Type 1 Diabetes Using the MiniMed 780G Advanced Hybrid Closed Loop System: A Randomized Controlled Trial Comparing Glucose Control. Diabetes Care 2023; 46(3): 544–550; doi: 10.2337/dc22-1692.
- Riddel MC, et al.: Exercise in adults with type 1 diabetes mellitus. Nature Reviews Endocrinology 2023; 19(2): 98–111.
- Moser O, et al.: Glucose management for exercise using continuous glucose monitoring (CGM) and intermittently scanned CGM (isCGM) systems in type 1 diabetes: position statement of the European Association for the Study of Diabetes (EASD) and of the International Society for Pediatric and Adolescent Diabetes (ISPAD) endorsed by JDRF and supported by the American Diabetes Association (ADA). Diabetologie 2020; 63(12): 2501–2520; doi: 10.1007/s00125-020-05263-9.
- Dehn-Hindenberg A, et al.: Long-term Occupational Consequences for Families of Children With Type 1 Diabetes: Mothers Take the Burden. Diabetes Care 2021; 44(12): 2656–2663.
- Messer LH, et al.: A Clinical Guide to Advanced Diabetes Devices and Closed-Loop Systems Using the CARES Paradigm. Diabetes Technol Ther 2019; 21(8): 462–469; doi: 10.1089/dia.2019.0105.
- Berget C, et al.: A Clinical Training Program for Hybrid Closed Loop Therapy in a Pediatric Diabetes Clinic. J Diabetes Sci Technol 2020; 14(2): 290–296; doi: 10.1177/1932296819835183.
- Lal RA, et al.: One Year Clinical Experience of the First Commercial Hybrid Closed-Loop System. Diabetes Care 2019; 42(12): 2190–2196.
- Bisio A, et al.: Sleep and diabetes-specific psycho-behavioral outcomes of a new automated insulin delivery system in young children with type 1 diabetes and their parents. Pediatr Diabetes 2021; 22: 495–502.
- Amigó J, et al.: Switching from treatment with sensor augmented pump to hybrid closed loop system in type 1 diabetes: Impact on glycemic control and neurophysiological testes in the real world. Diabetes Research and Clinical Practice 2023; 201: 110730.
HAUSARZT PRAXIS 2024; 19(5): 7–15