Con l’aumento delle persone con diabete di tipo 2 (T2D) che assumono farmaci per controllare i livelli di zucchero nel sangue e perdere peso, sono emerse preoccupazioni sulla sicurezza. I dati reali del database FAERS (Adverse Event Reporting System ) della Food and Drug Administration statunitense mostrano ora un profilo di sicurezza rassicurante per la tirzepatide (TZP).
Il doppio agonista del recettore GIP (glucose-dependent insulinotropic polypeptide)/glucagon-like peptide 1 (GLP1) ha dimostrato un’elevata efficacia nel ridurre i livelli di glucosio nel sangue e il peso corporeo nelle persone con diabete di tipo 2 e/o obesità. Gli agonisti del recettore GLP1 riducono l’appetito e rallentano lo svuotamento gastrico e sono quindi sempre più utilizzati nel trattamento dell’obesità.
Gli studi controllati randomizzati hanno dimostrato che il profilo di sicurezza di TZP è simile a quello di altri GLP1 RA ed è caratterizzato principalmente da eventi avversi gastrointestinali. Tuttavia, sono state sollevate preoccupazioni su una possibile associazione tra TZP e retinopatia diabetica, disturbi pancreatobiliari e cancro midollare della tiroide, ma non sono ancora state fornite prove chiare.
Per saperne di più, la dottoressa Irene Caruso del Dipartimento di Medicina Interna, Endocrinologia, Andrologia e Malattie Metaboliche dell’Università di Bari, Italia, e i suoi colleghi hanno cercato nel database di sorveglianza post-marketing FAERS, che contiene le segnalazioni di produttori, pazienti e operatori sanitari. Volevano scoprire se dall’esperienza reale sono emersi problemi di sicurezza simili [1].
I ricercatori hanno recuperato le segnalazioni di eventi avversi relativi al TZP che erano associati a disturbi gastrointestinali, pancreatite, colecistite e colelitiasi, retinopatia diabetica e neoplasie della tiroide. È stato calcolato un rapporto di probabilità di segnalazione (ROR) per valutare la sproporzione di segnalazione di alcuni eventi avversi associati al TZP rispetto ad altri farmaci. L’analisi è stata poi filtrata in base alle segnalazioni di età, sesso e al farmaco designato come sospetto primario. Il verificarsi di eventi avversi con TZP è stato anche confrontato separatamente con altri trattamenti per il diabete, tra cui l’insulina, gli inibitori SGLT2, la metformina e GLP1-RA (sia individualmente che come classe).
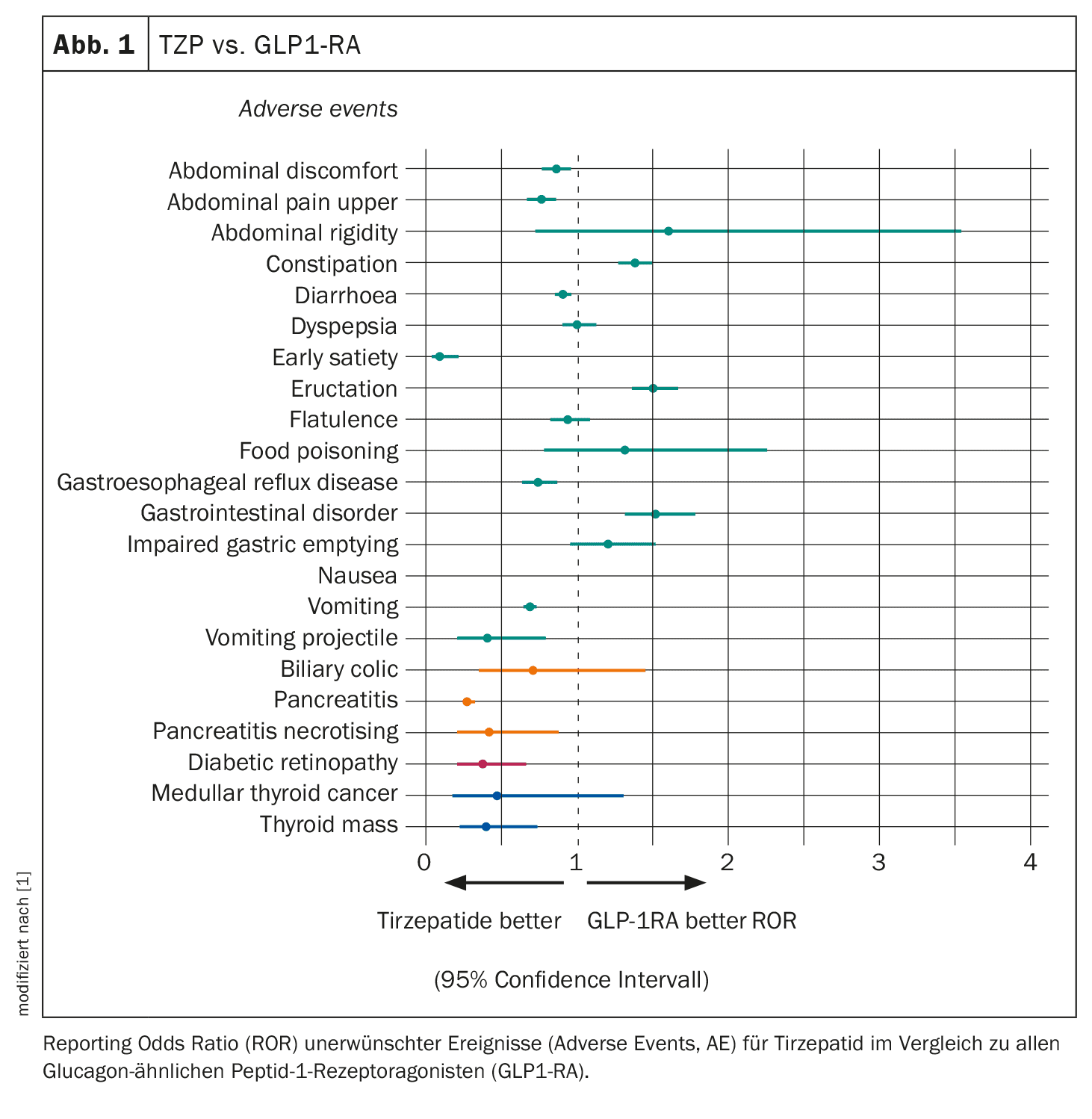
Su un totale di 20.409 rapporti su 1432 eventi avversi, i ricercatori hanno analizzato 7460 rapporti relativi a 286 eventi avversi selezionati (tumore del tratto gastrointestinale, del pancreas, della cistifellea, degli occhi e della tiroide), 22 dei quali hanno mostrato un segnale di sproporzionalità.
Rischio inferiore di nausea, ma rischio più elevato di costipazione
Le segnalazioni di rigurgito erano 30 volte più probabili con TZP rispetto ad altri farmaci, mentre nausea, dispepsia, costipazione e pancreatite erano quattro volte più probabili con TZP rispetto a tutti gli altri farmaci. Tuttavia, TZP è stato associato a un rischio di eventi avversi gastrointestinali simile a quello di altri GLP-1RA, con alcune differenze, tra cui un rischio inferiore di nausea e un rischio superiore di costipazione (Fig. 1). Come previsto, il TZP presentava un rischio più elevato della maggior parte degli eventi avversi gastrointestinali rispetto all’insulina e agli inibitori SGLT2. Non è stata osservata una segnalazione sproporzionata di pancreatite con TZP rispetto a SGLT2i, ma è stato descritto un rischio maggiore rispetto all’insulina e un rischio minore rispetto a GLP1-RA.
I ricercatori hanno anche riscontrato un rapporto sproporzionatamente elevato di cancro midollare della tiroide con TZP, con una probabilità 13 volte superiore rispetto a tutti gli altri farmaci (sulla base di tre eventi). Tuttavia, TZP è stato associato a un rischio simile di cancro midollare della tiroide rispetto agli altri inibitori GLP1-RA e SGLT2 e a un rischio più elevato rispetto all’insulina.
Allo stesso modo, il TZP aveva una probabilità più che tripla di causare retinopatia diabetica (sulla base di 12 casi) rispetto a qualsiasi altro farmaco. Tuttavia, il farmaco presentava un rischio simile a quello degli inibitori SGLT2 e un rischio costantemente inferiore a quello di GLP1-RA e insulina. Non è stato osservato un numero sproporzionatamente elevato di eventi avversi correlati alla cistifellea e ai dotti biliari, ad eccezione di un aumento del rischio di colica biliare rispetto a tutti gli altri farmaci e all’insulina. Rispetto a GLP1-RA e SGLT2i, il rischio di colica biliare era paragonabile.
Questi risultati hanno dimostrato che la tirzepatide ha una tollerabilità gastrointestinale (GI) simile a quella della classe GLP1-RA, senza un aumento del rischio di pancreatite, retinopatia diabetica e cancro midollare della tiroide, ha concluso il dottor Caruso. Il profilo di sicurezza della tirzepatide è quindi rassicurante, anche se con delle limitazioni.
Fonte: Caruso I: Il profilo di sicurezza reale della tirzepatide: analisi di farmacovigilanza del database FDA Adverse Events Reporting System (FAERS). Presentazione orale #753, Sessione SO 063: Più combo meno insulina! EASD, 11/09/2024.
Letteratura:
- Caruso I, et al: Il profilo di sicurezza reale della tirzepatide: analisi di farmacovigilanza del database FDA Adverse Event Reporting System (FAERS). J Endocrinol Invest 2024; 47: 2671-2678; doi: 10.1007/s40618-024-02441-z.
InFo DIABETOLOGIE & ENDOKRINOLOGIE 2024; 1(4): 18–20 (pubblicato il 29.11.24, prima della stampa)
HAUSARZT PRAXIS 2024; 19(12): 50–51