Alors que de plus en plus de personnes atteintes de diabète de type 2 (DT2) prennent des médicaments pour contrôler leur glycémie et perdre du poids, des inquiétudes se sont fait jour quant à leur sécurité. Des preuves réelles issues de la base de données FAERS (FDA Adverse Event Reporting System) de l’Agence américaine des médicaments montrent désormais un profil de sécurité rassurant pour le tirazépatide (TZP).
Le trizépatide, un agoniste du récepteur du peptide 1 de type glucose-dépendant de l’insulinotropine (GIP)/glucagon-like (GLP1), a montré une grande efficacité dans la réduction de la glycémie et du poids corporel chez les personnes souffrant de diabète de type 2 et/ou d’obésité. Les agonistes des récepteurs GLP1 réduisent l’appétit et ralentissent la vidange gastrique et sont donc de plus en plus utilisés pour traiter l’obésité.
Des études randomisées et contrôlées ont montré que le profil de sécurité du TZP est similaire à celui des autres GLP1-RA et se caractérise principalement par des événements gastro-intestinaux indésirables. Toutefois, des inquiétudes ont été exprimées quant à un lien possible entre le TZP et la rétinopathie diabétique, les troubles pancréatobiliaires et le cancer médullaire de la thyroïde, mais aucune preuve formelle n’a été fournie.
Pour en savoir plus, le Dr Irene Caruso du département de médecine interne, endocrinologie, andrologie et maladies métaboliques de l’université de Bari, en Italie, et ses collègues ont consulté la base de données de surveillance post-marketing FAERS, qui contient des rapports de fabricants, de patients et de professionnels de la santé. Ils ont voulu savoir si les expériences du monde réel avaient révélé des préoccupations similaires en matière de sécurité [1].
Les chercheurs ont récupéré les rapports d’événements indésirables liés au TZP et associés à des troubles gastro-intestinaux, à la pancréatite, à la cholécystite et à la cholélithiase, à la rétinopathie diabétique et aux néoplasmes thyroïdiens. Un rapport de cotes de déclaration (ROR) a été calculé afin d’évaluer le caractère disproportionné de la déclaration de certains événements indésirables liés au TZP par rapport à d’autres médicaments. L’analyse a ensuite été filtrée en fonction des rapports sur l’âge, le sexe et le médicament désigné comme principal suspect. La survenue d’événements indésirables liés au TZP a également été comparée séparément uniquement avec d’autres traitements du diabète, notamment l’insuline, les inhibiteurs du SGLT2, la metformine et le GLP1-RA (à la fois individuellement et en tant que classe).
Sur un total de 20 409 rapports concernant 1 432 événements indésirables, les chercheurs ont analysé 7 460 rapports portant sur 286 événements indésirables sélectionnés (tractus gastro-intestinal, pancréas, bile, yeux et cancer de la thyroïde), dont 22 présentaient un signal de disproportionnalité.
Risque plus faible de nausées, mais plus élevé de constipation
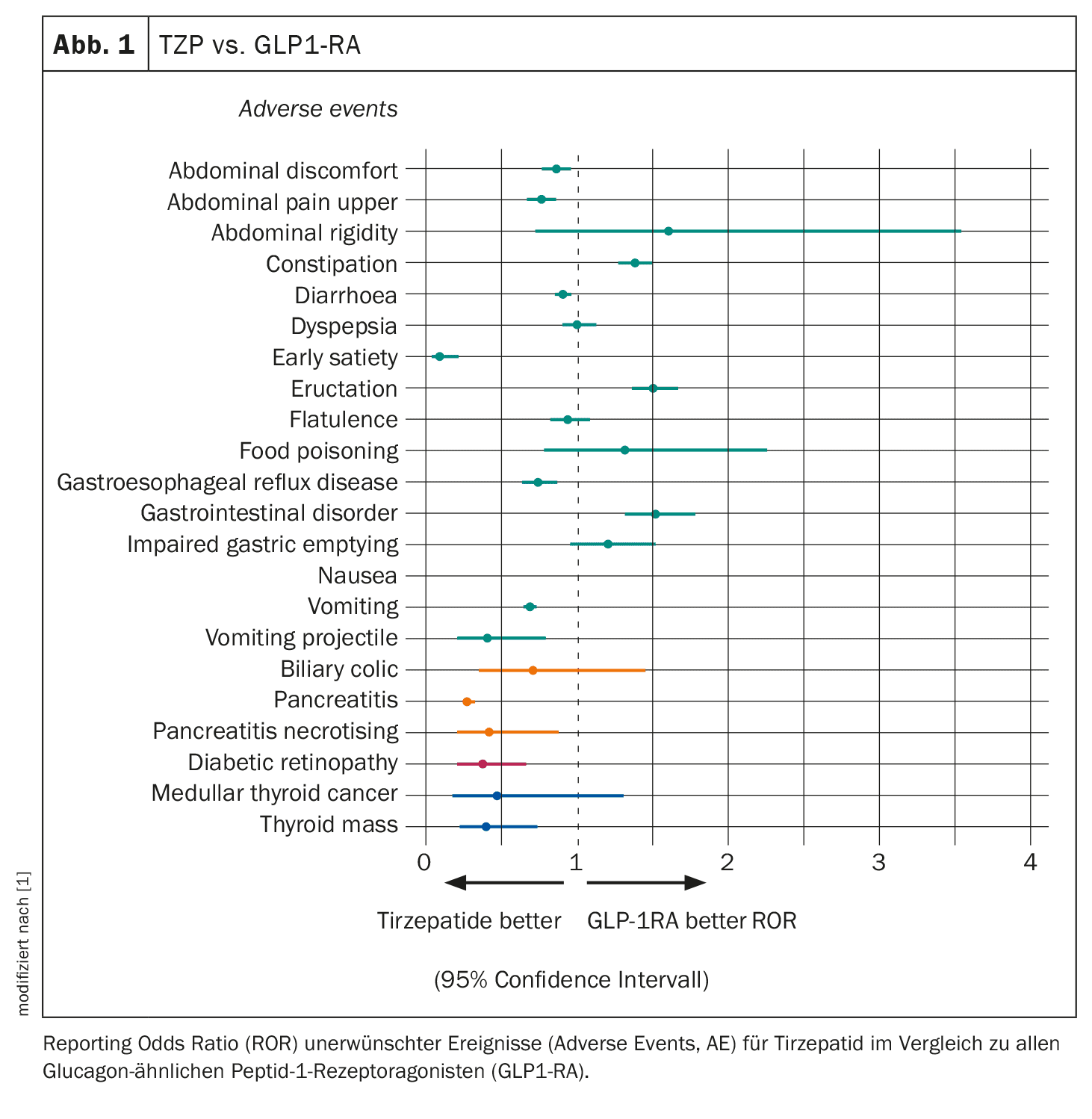
Les rapports de régurgitation étaient 30 fois plus probables avec le TZP qu’avec les autres médicaments, tandis que les nausées, la dyspepsie, la constipation et la pancréatite étaient quatre fois plus probables avec le TZP qu’avec tous les autres médicaments. Cependant, le TZP était associé à un risque d’événements indésirables gastro-intestinaux similaire à celui des autres GLP-1RA, avec quelques différences, notamment un risque plus faible de nausées et un risque plus élevé de constipation (Fig. 1). Comme prévu, le TZP présentait un risque plus élevé de la plupart des événements indésirables gastro-intestinaux par rapport à l’insuline et aux inhibiteurs de SGLT2. Par rapport au SGLT2i, aucune déclaration disproportionnée de pancréatite n’a été observée avec le TZP, mais un risque plus élevé a été décrit par rapport à l’insuline et un risque plus faible a été signalé par rapport au GLP1-RA.
Les chercheurs ont également constaté une déclaration disproportionnée de cancer médullaire de la thyroïde avec le TZP, avec une probabilité 13 fois plus élevée par rapport à tous les autres médicaments (sur la base de trois événements). Cependant, le TZP était associé à un risque de cancer médullaire de la thyroïde similaire à celui des autres inhibiteurs du GLP1-RA et du SGLT2, et à un risque plus élevé par rapport à l’insuline.
De même, la probabilité que le TZP entraîne une rétinopathie diabétique (sur la base de 12 cas) était plus de trois fois supérieure à celle de tous les autres médicaments. Cependant, la substance active présentait un risque similaire à celui des inhibiteurs du SGLT2 et systématiquement inférieur à celui du GLP1-RA et de l’insuline. Aucun nombre disproportionné d’événements indésirables liés à la vésicule biliaire et aux voies biliaires n’a été observé, à l’exception d’un risque accru de coliques biliaires par rapport à tous les autres médicaments et à l’insuline. Par rapport au GLP1-RA et au SGLT2i, le risque de coliques biliaires était comparable.
Ces résultats ont montré que le tirazépatide a une tolérance gastro-intestinale (GI) similaire à celle de la classe des GLP1-RA, sans risque accru de pancréatite, de rétinopathie diabétique et de cancer médullaire de la thyroïde, a conclu le Dr Caruso. Le profil d’innocuité du tirazépatide est donc rassurant, même s’il est limité.
Source : Caruso I : The real-world safety profile of tirzepatide : pharmacovigilance analysis of the FDA Adverse Events Reporting System (FAERS) database. Oral Presentation #753, Session SO 063 : More combo’s less insulin ! EASD, 11.09.2024.
Littérature :
- Caruso I, et al : The real-world safety profile of tirzepatide : pharmacovigilance analysis of the FDA Adverse Event Reporting System (FAERS) database. J Endocrinol Invest 2024 ; 47 : 2671-2678 ; doi : 10.1007/s40618-024-02441-z.
InFo DIABETOLOGIE & ENDOKRINOLOGIE 2024; 1(4): 18–20 (publié le 29.11.24, ahead of print)
HAUSARZT PRAXIS 2024; 19(12): 50–51