A medida que más personas con diabetes tipo 2 (T2D) toman medicación para controlar los niveles de azúcar en sangre y perder peso, han surgido preocupaciones sobre su seguridad. Las pruebas reales de la base de datos del Sistema de Notificación de Efectos Adversos (FAERS) de la Administración de Alimentos y Medicamentos de EE.UU. muestran ahora un perfil de seguridad tranquilizador para la tirzepatida (TZP).
El agonista dual de los receptores del polipéptido insulinotrópico dependiente de la glucosa (GIP)/péptido similar al glucagón 1 (GLP1), la triazepatida, ha demostrado una gran eficacia para reducir los niveles de glucosa en sangre y el peso corporal en personas con diabetes de tipo 2 y/o obesidad. Los agonistas de los receptores GLP1 reducen el apetito y ralentizan el vaciado gástrico, por lo que se utilizan cada vez más en el tratamiento de la obesidad.
Los ensayos controlados aleatorios han demostrado que el perfil de seguridad de la TZP es similar al de otros AR GLP1 y se caracteriza principalmente por acontecimientos gastrointestinales adversos. Sin embargo, se han planteado inquietudes sobre una posible asociación entre la TZP y la retinopatía diabética, los trastornos pancreatobiliares y el cáncer medular de tiroides, pero aún no se han aportado pruebas claras.
Para saber más, la Dra. Irene Caruso, del Departamento de Medicina Interna, Endocrinología, Andrología y Enfermedades Metabólicas de la Universidad de Bari (Italia), y sus colegas buscaron en la base de datos de vigilancia poscomercialización FAERS, que contiene informes de fabricantes, pacientes y profesionales sanitarios. Querían averiguar si habían surgido problemas de seguridad similares a partir de la experiencia en el mundo real [1].
Los investigadores recuperaron informes de acontecimientos adversos asociados a la TZP relacionados con trastornos gastrointestinales, pancreatitis, colecistitis y colelitiasis, retinopatía diabética y neoplasias tiroideas. Se calculó una odds ratio de notificación (ROR) para evaluar la desproporcionalidad de la notificación de determinados acontecimientos adversos asociados a la TZP en comparación con otros fármacos. A continuación, el análisis se filtró por informes de edad, sexo y el fármaco designado como principal sospechoso. La aparición de acontecimientos adversos con la TZP también se comparó por separado con otros tratamientos de la diabetes únicamente, incluyendo la insulina, los inhibidores SGLT2, la metformina y los GLP1-RA (tanto individualmente como en su conjunto).
Del total de 20.409 informes sobre 1.432 acontecimientos adversos, los investigadores analizaron 7.460 informes relativos a 286 acontecimientos adversos seleccionados (cáncer del tracto gastrointestinal, páncreas, vesícula biliar, ojos y tiroides), 22 de los cuales mostraban una señal de desproporcionalidad.
Menor riesgo de náuseas, pero mayor riesgo de estreñimiento
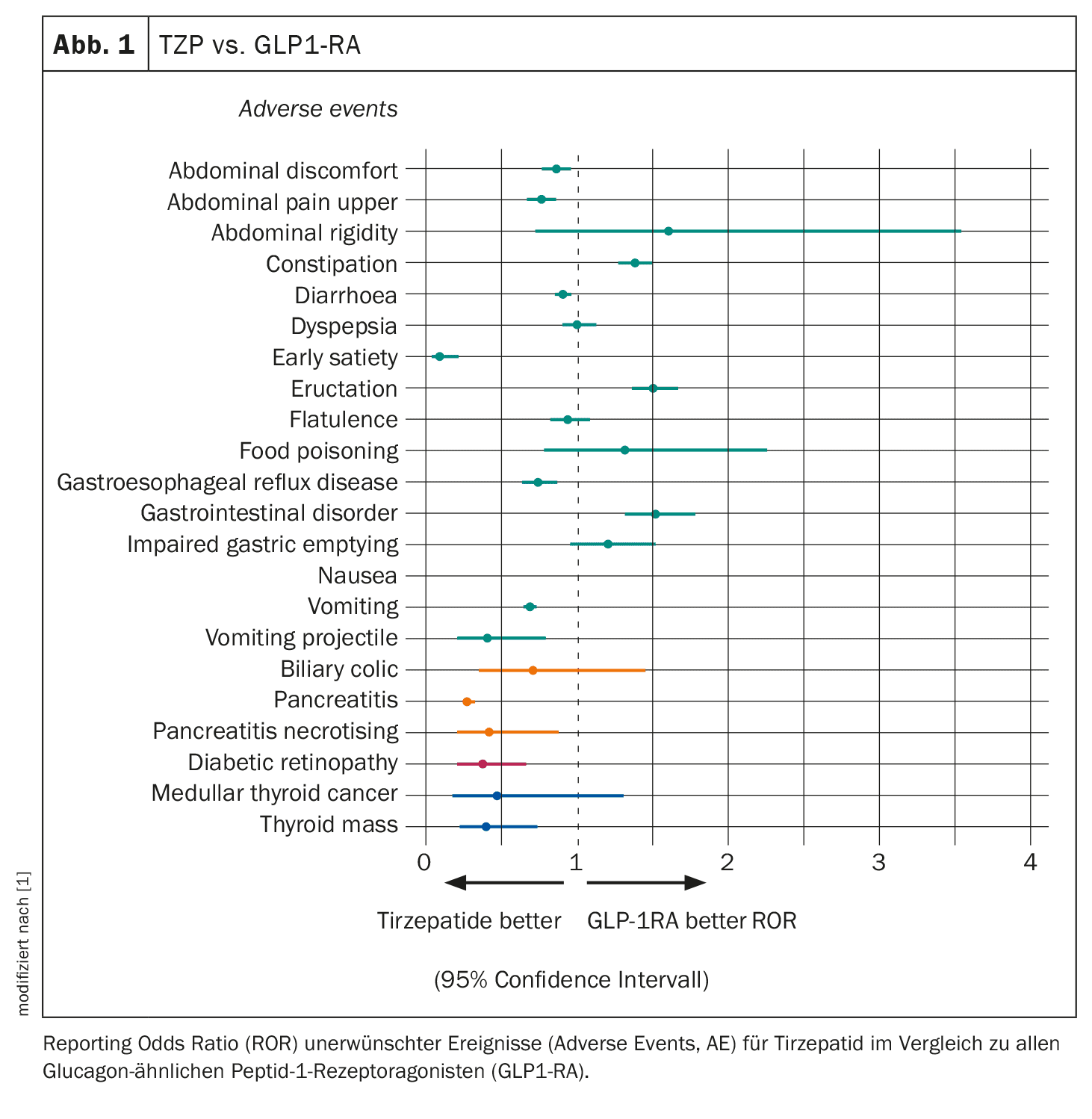
Los informes de regurgitación fueron 30 veces más probables con la TZP que con otros fármacos, mientras que las náuseas, la dispepsia, el estreñimiento y la pancreatitis fueron cuatro veces más probables con la TZP que con todos los demás fármacos. Sin embargo, la TZP se asoció a un riesgo de acontecimientos adversos gastrointestinales similar al de otros GLP-1RA, con algunas diferencias, como un menor riesgo de náuseas y un mayor riesgo de estreñimiento (Fig. 1). Como era de esperar, las TZP presentaban un mayor riesgo de la mayoría de los acontecimientos adversos gastrointestinales en comparación con la insulina y los inhibidores de SGLT2. No se observó una notificación desproporcionada de pancreatitis con la TZP en comparación con los SGLT2i, pero se describió un riesgo mayor en comparación con la insulina y un riesgo menor en comparación con los GLP1-RA.
Los investigadores también hallaron un informe desproporcionadamente alto de cáncer medular de tiroides con la TZP, con una probabilidad 13 veces mayor en comparación con todos los demás fármacos (basado en tres acontecimientos). Sin embargo, la TZP se asoció a un riesgo de cáncer medular de tiroides similar al de otros GLP1-RA e inhibidores de SGLT2 y a un riesgo mayor en comparación con la insulina.
Del mismo modo, el TZP tenía más del triple de probabilidades de causar retinopatía diabética (basándose en 12 casos) que cualquier otro fármaco. Sin embargo, el fármaco presentaba un riesgo similar al de los inhibidores de SGLT2 y un riesgo sistemáticamente inferior al de los GLP1-RA y la insulina. No se observó un número desproporcionado de acontecimientos adversos relacionados con la vesícula biliar y los conductos biliares, con la excepción de un mayor riesgo de cólico biliar en comparación con todos los demás fármacos y la insulina. En comparación con los GLP1-RA y los SGLT2i, el riesgo de cólico biliar fue comparable.
Estos resultados mostraron que la tirzepatida tiene una tolerabilidad gastrointestinal (GI) similar en comparación con la clase GLP1-RA, sin un mayor riesgo de pancreatitis, retinopatía diabética y cáncer medular de tiroides, concluyó el Dr. Caruso. El perfil de seguridad de la tirzepatida es, por tanto, tranquilizador, aunque con limitaciones.
Fuente: Caruso I: The real-world safety profile of tirzepatide: pharmacovigilance analysis of the FDA Adverse Events Reporting System (FAERS) database. Presentación oral nº 753, Sesión SO 063: ¡Más combo’s menos insulina! EASD, 11/09/2024.
Literatura:
- Caruso I, et al: The real-world safety profile of tirzepatide: pharmacovigilance analysis of the FDA Adverse Event Reporting System (FAERS) database. J Endocrinol Invest 2024; 47: 2671-2678; doi: 10.1007/s40618-024-02441-z.
InFo DIABETOLOGIE & ENDOKRINOLOGIE 2024; 1(4): 18–20 (publicado el 29.11.24, antes de impresión)
HAUSARZT PRAXIS 2024; 19(12): 50–51