La enfermedad del hígado graso no alcohólico (HGNA) es la enfermedad hepática más común en el mundo occidental. A diferencia de la enfermedad del hígado graso alcohólico, el consumo de alcohol en la NAFLD debe situarse en un nivel generalmente seguro, es decir, <20 gramos/día para las mujeres y <30 gramos/día para los hombres. Con el aumento de la prevalencia de la obesidad y de afecciones asociadas como la diabetes mellitus de tipo 2, la dislipidemia, la hipertensión y la apnea obstructiva del sueño, la prevalencia de la NAFLD también ha aumentado significativamente en los últimos años.
Etiología y factores de riesgo
La enfermedad del hígado graso no alcohólico (HGNA) es la enfermedad hepática más común en el mundo occidental. A diferencia de la enfermedad del hígado graso alcohólico, el consumo de alcohol en la NAFLD debe situarse en un nivel generalmente seguro, es decir, <20 gramos/día para las mujeres y <30 gramos/día para los hombres. En los países con una elevada proporción de personas obesas y con sobrepeso, entre un cuarto y un tercio de los adultos padecen HGNA. (Fig.1). Con el aumento de la prevalencia de la obesidad y de afecciones asociadas como la diabetes mellitus de tipo 2, la dislipidemia, la hipertensión y la apnea obstructiva del sueño, la prevalencia de la NAFLD también ha aumentado significativamente en los últimos años. Por ejemplo, mientras que la NAFLD afectaba al 6% de los adultos en Estados Unidos en 2003, esta cifra aumentó al 18% en 2011 y actualmente se sitúa justo por debajo del 25% [1]. En las poblaciones de riesgo, es decir, los pacientes con obesidad y diabetes mellitus de tipo 2, la prevalencia de la NAFLD es incluso superior al 50% [2]. El aumento global del consumo de bebidas dulces, especialmente las ricas en fructosa, también ha contribuido al incremento de las tasas de prevalencia de la NAFLD. Debido a estos claros factores de riesgo metabólico, la NAFLD también se denomina la manifestación hepática del síndrome metabólico. Hay que distinguir otras causas que pueden provocar esteatosis hepática, como la pérdida rápida de peso, la nutrición parenteral total, la infección por el genotipo 3 de la hepatitis C, la enfermedad de Wilson y determinados fármacos (por ejemplo, el metotrexato). Las pruebas de los factores de riesgo genéticos proceden de estudios con gemelos monocigóticos y estudios en familias, que demostraron que el riesgo de que los familiares de primer grado también desarrollen HGNA es de hasta el 50%. Los pacientes de origen asiático y sudamericano se ven especialmente afectados [3]. Además, existen genes de riesgo como el que contiene el dominio 3 de la fosfolipasa similar a la patatina (PNPLA3), el miembro 2 de la superfamilia 6 transmembrana (TM6SF2), la 17-beta hidroxiesteroide deshidrogenasa 13 (HSD17B13), el que contiene el dominio 7 de la O-aciltransferasa unida a la membrana (MBOAT7) o el canal transmembrana similar al 4 (TMC4) que influyen en el desarrollo de la esteatosis hepática y la fibrosis en algunos pacientes con HGNA. Es posible que la determinación de variantes genéticas de riesgo pueda utilizarse para la estratificación del riesgo en el futuro, pero aún no desempeñan ningún papel en la práctica clínica.
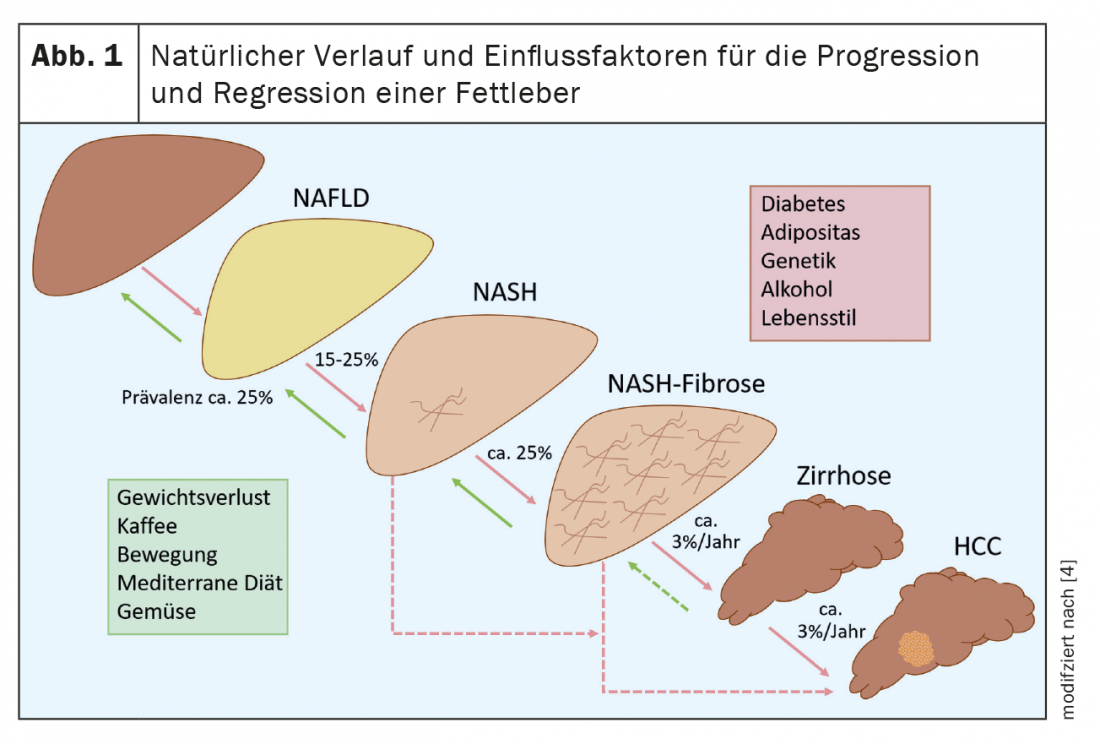
La mayoría de los pacientes con HGNA presentan esteatosis hepática pura y alrededor del 15-25% de estos casos pueden evolucionar a esteatohepatitis no alcohólica (EHNA) [4]. (Fig.1). Algunos de estos pacientes desarrollan una fibrosis hepática relevante y hasta un 12% de los pacientes con EHNA desarrollan posteriormente cirrosis hepática [2]. Esto aumenta el riesgo de descompensación hepática y de carcinoma hepatocelular (CHC), cada uno de los cuales incrementa significativamente la morbilidad y la mortalidad de la HGNA. Por lo tanto, es importante identificar a los pacientes con riesgo de enfermedad progresiva o con fibrosis avanzada para tratarlos precozmente y examinarlos para detectar un CHC. Con una terapia adecuada, es posible la estabilización o incluso la regresión de la enfermedad. Esto ilustra una vez más la importancia del diagnóstico. Sin embargo, datos recientes de una gran base de datos sanitaria alemana muestran que la HGNA está significativamente infradiagnosticada [5].
La mortalidad de los pacientes con HGNA viene determinada en gran medida por las enfermedades cardiovasculares, por lo que el riesgo cardiovascular de estos pacientes debe revisarse anualmente, por ejemplo utilizando la calculadora de riesgo AGLA de la Asociación Suiza para la Prevención de la Aterosclerosis. La NAFLD es también un factor de riesgo independiente de las enfermedades cardiovasculares.
Cribado, diagnóstico y vigilancia
La sospecha diagnóstica de HGNA se realiza tras la exclusión de otras causas de enfermedad hepática (especialmente hepatitis vírica crónica, enfermedad hepática alcohólica o autoinmune) y en presencia de un perfil de riesgo metabólico con evidencia concomitante de esteatosis en el examen ecográfico. Las directrices actuales enumeran una biopsia hepática para la detección de la esteatosis, aunque debido a lo invasiva que resulta y al elevado número de pacientes en la práctica clínica, se ha impuesto el procedimiento antes mencionado mediante ecografía [6]. Ecográficamente, la esteatosis sólo puede detectarse a partir de un 20% de degeneración grasa. El siguiente paso diagnóstico es evaluar si ya existe fibrosis hepática, ya que esto determinará el pronóstico del paciente. Independientemente de la presencia de actividad inflamatoria (EHNA), los pacientes con fibrosis hepática existente presentan una mortalidad general y relacionada con el hígado a largo plazo significativamente mayor que los pacientes sin fibrosis [7].
La biopsia hepática es el patrón oro para el diagnóstico de la fibrosis. Histológicamente, se distinguen 5 estadios de fibrosis: F0 = sin fibrosis a F4 = cirrosis. Además, la histología es la única forma de distinguir entre la presencia de HGNA y EHNA. En la NAFLD, más del 5% de los hepatocitos están afectados por esteatosis [6]. En la EHNA también se encuentran hepatocitos abombados e infiltrados con células inflamatorias [8]. El alcance de estos cambios se resume en la denominada puntuación de actividad de la NAFLD (NAS). Si esta puntuación es igual o superior a 5 puntos, se cumplen los criterios diagnósticos de la EHNA. Estos cambios favorecen entonces también la formación de fibrosis e incluso de cirrosis. La biopsia hepática suele realizarla un especialista en gastroenterología y hepatología para cuestiones específicas. Puede realizarse si se sospecha una fibrosis de mayor grado en el diagnóstico no invasivo de la fibrosis (Fig. 2) o para el diagnóstico diferencial en caso de una posible otra causa concurrente de enfermedad hepática, ya que es relevante para la terapia y el seguimiento del paciente.
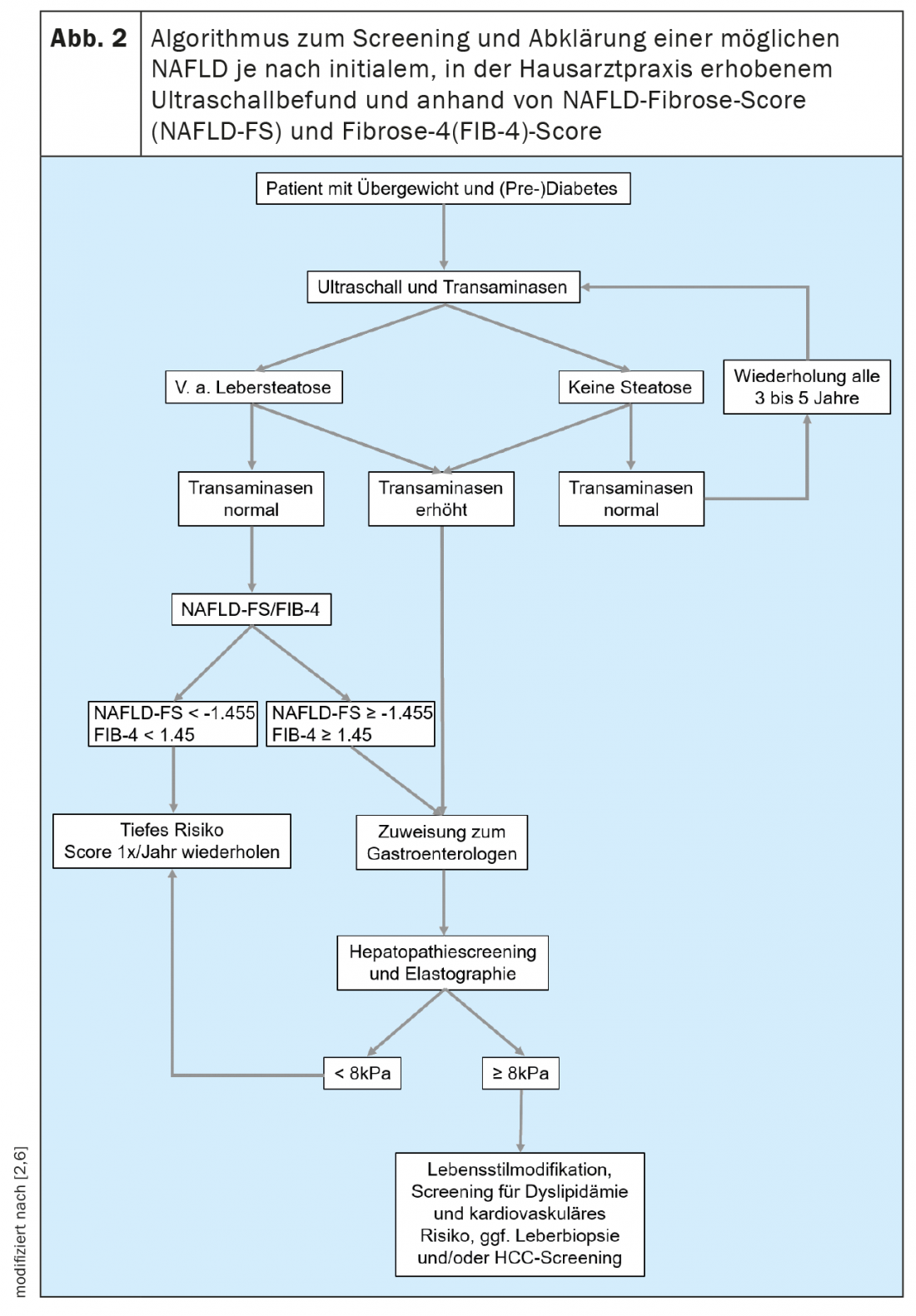
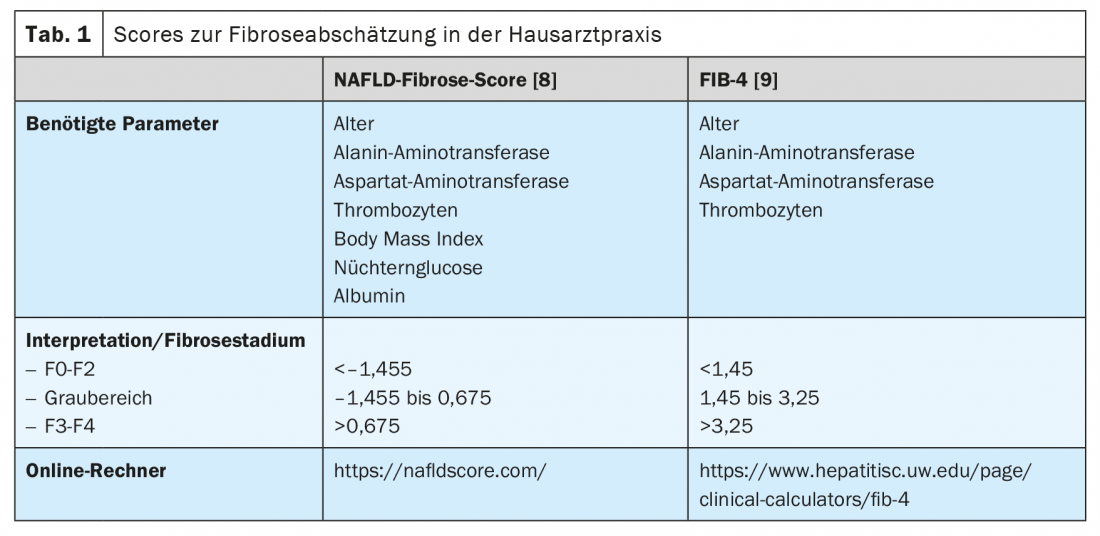
Además, existen formas no invasivas de evaluar la presencia y el alcance de la fibrosis hepática. Esto permite a los colegas que tratan con frecuencia a pacientes de las poblaciones de riesgo de NAFLD, como médicos de cabecera, endocrinólogos y cardiólogos, realizar un cribado sencillo. En general, se recomienda iniciar el cribado de NAFLD en todos los pacientes que pertenezcan a una de las poblaciones de riesgo mediante un examen ecográfico (Fig. 2). Si existe la sospecha de esteatosis hepática, debe evaluarse el riesgo de que exista una enfermedad hepática de mayor grado mediante la determinación de las transaminasas y otros parámetros clínicos, como el índice de masa corporal, la edad y el hemograma. Existen muchas puntuaciones basadas en valores clínicos o séricos que pueden utilizarse principalmente para descartar una enfermedad hepática avanzada. De ellos, el NAFLD Fibrosis Score -(NAFLD-FS) y el Fibrosis-4 (FIB-4) están suficientemente validados para recomendarlos aquí (Tabla 1) [9,10]. Los valores de NAFLD-FS y FIB-4 en el rango de fibrosis F0 a F2 casi excluyen una enfermedad hepática grave. Si, sobre la base de estas puntuaciones, existe la sospecha de una fibrosis hepática de mayor grado (puntuaciones en la gama de grises, o en la gama de fibrosis F3 o F4), se recomienda la derivación a un gastroenterólogo para un diagnóstico ampliado mediante elastografía transitoria (FibroScan®) o elastografía de ondas de cizallamiento y, si es necesario, se puede realizar una biopsia hepática (Fig. 2). Utilizando la velocidad de propagación de un pulso de ultrasonidos en el hígado, se puede estimar de forma no invasiva el grado de fibrosis hepática con ayuda de la elastografía transitoria o de onda de cizallamiento, y también se puede realizar un diagnóstico de progresión durante la terapia. En general, los pacientes con obesidad, diabetes tipo 2 o prediabetes y transaminasas elevadas deben ser remitidos a un especialista en gastroenterología y hepatología para que les realice una ecografía abdominal con elastografía debido a la elevada prevalencia de NAFLD en esta población [11,6]. En el contexto de la elastografía transitoria, también se determina al mismo tiempo un sustituto de la esteatosis hepática mediante el parámetro de atenuación controlada (PAC). Este valor de PAC puede indicar esteatosis si se eleva por encima de 275 dB/m, pero este método no se recomienda actualmente para el único diagnóstico inicial de esteatosis hepática debido a la insuficiencia de datos [12].
Los pacientes con cirrosis corren un mayor riesgo de desarrollar un CHC y, por lo tanto, deben someterse a un cribado semestral de CHC. Si la visibilidad ecográfica es buena, se realiza mediante ecografía, y también debe determinarse la alfafetoproteína (AFP) como marcador tumoral. Si la visibilidad es difícil, por ejemplo debido a la obesidad concomitante, puede realizarse una resonancia magnética del hígado (alternativamente si es necesario). En una proporción de pacientes, el CHC se produce antes de que se desarrolle la cirrosis, pero el cribado general del CHC en pacientes con HGNA sin cirrosis no se considera rentable debido al gran número de pacientes. En general, el cribado del CHC se recomienda a partir de la presencia de fibrosis F3 (“fibrosis puente”).
Opciones terapéuticas
La terapia de la NAFLD/NASH tiene como objetivo prevenir la progresión de la enfermedad o lograr la regresión de la fibrosis y también reducir el riesgo cardiovascular de los pacientes. En los últimos años se han realizado numerosos estudios sobre terapias farmacológicas, incluidos estudios de fase 3, pero aún no se ha aprobado una terapia específica. Las sustancias estudiadas incluyen enfoques terapéuticos metabólicos, antiinflamatorios y antifibróticos. El ácido obetichólico, un agonista del receptor X farnesoide (FXR), ha demostrado mejorar la fibrosis hepática en el único ensayo positivo de fase 3 realizado hasta la fecha (REGENERATE) [13]. Esta sustancia ya está en el mercado para el tratamiento de la colangitis biliar primaria (Ocaliva®), y está pendiente su aprobación con la indicación EHNA. Los estudios actuales también investigan la combinación de diferentes preparados. La prevención de la progresión de la enfermedad parece más fácil de conseguir que la regresión de la fibrosis hepática. Especialmente para los pacientes con la enfermedad avanzada, la terapia farmacológica podría ser útil, pero hasta ahora todavía no es posible una cura farmacológica [6].
El objetivo de la terapia para la NAFLD es, por tanto, la pérdida de peso con cambios en el estilo de vida. Los estudios han demostrado efectos significativos en el grado de degeneración grasa e inflamación del hígado y, en algunos casos, regresión de la fibrosis. Este enfoque terapéutico también tiene un efecto positivo sobre las comorbilidades relevantes, como la diabetes, el síndrome de apnea del sueño o el aumento del riesgo cardiovascular. La Sociedad Alemana de Enfermedades Digestivas y Metabólicas y la Sociedad Europea de Enfermedades Hepáticas recomiendan una reducción de peso del 7 al 10%, que debe conseguirse mediante cambios en la dieta (evitando los alimentos que favorecen el desarrollo de HGNA) y aumentando la actividad física, véase también la tabla 2 [6,14]. Tanto el entrenamiento de resistencia como el de fuerza son eficaces, por lo que puede diseñarse según las preferencias del paciente. Por lo tanto, se dispone de una terapia eficaz para la NAFLD, pero la aplicación de las recomendaciones y el logro de una reducción de peso permanente suele ser difícil para el paciente en la vida cotidiana. Un enfoque multidisciplinar, especialmente para pacientes con riesgo de enfermedad progresiva o ya avanzada, que incluya asesoramiento nutricional y endocrinología con una consulta sobre obesidad, tiene sentido.

En este sentido, la cirugía bariátrica también figura como una posible opción terapéutica si existe una indicación quirúrgica con respecto a una obesidad presente. Se ha demostrado que tras la cirugía bariátrica se produce una disminución significativa de la actividad inflamatoria en una mayoría de pacientes y también es posible la regresión de la fibrosis [15].
Si existen comorbilidades, deben tratarse según las recomendaciones actuales de las respectivas sociedades profesionales. Actualmente no existen recomendaciones para el uso de hipolipemiantes, estatinas, biguanidas, inhibidores de SGLT2 o agonistas de GLP1 en pacientes con NAFLD sin la comorbilidad correspondiente, pero hay datos que demuestran un beneficio, es decir, una regresión de la esteatosis y la inflamación, en pacientes con NAFLD [16,17]. Si la administración de estatinas está indicada en función del perfil lipídico, también pueden utilizarse en pacientes con HGNA sin riesgo aumentado siempre que exista una función hepática compensada. Si ya existe cirrosis infantil A, puede haber un aumento significativo de la biodisponibilidad en función del preparado, por lo que debe evaluarse un ajuste de la dosis y realizar un seguimiento regular de la creatina nasa, ya que el riesgo de rabdomiólisis aumenta ligeramente.
Los pacientes con hígado graso y síndrome metabólico suelen presentar también niveles elevados de ferritina sérica en presencia de una saturación normal de transferrina o la ausencia de una mutación genética compatible con la hemocromatosis. En estos pacientes, el beneficio de la flebotomía para agotar las reservas de hierro es controvertido y no puede recomendarse debido a la escasez de datos [6]. La hiperferritinemia en estos pacientes es una expresión de esteatohepatitis.
En caso de progresión de la EHNA a cirrosis descompensada, existe la posibilidad de evaluar un trasplante de hígado. Mientras tanto, la cirrosis NASH es ya la causa más frecuente de trasplante de hígado en EE UU.
MAFLD– ¿qué es?
La distinción entre la enfermedad del hígado graso alcohólico y no alcohólico suele ser difícil. Como ya se ha mencionado, el HGNA es un diagnóstico de exclusión. Sin embargo, a menudo no es posible distinguir el papel del consumo de alcohol o de otra enfermedad hepática coexistente del HGNA, por ejemplo en un paciente con obesidad, diabetes y hepatitis B crónica. Por este motivo, se está intentando utilizar el término enfermedad del hígado graso asociada al metabolismo (MAFLD) Introducir nueva terminología haciendo hincapié en la etiología. Esta definición tiene en cuenta las enfermedades metabólicas concomitantes y la presencia de otras enfermedades hepáticas no es una contraindicación para el diagnóstico [18]. La MAFLD puede diagnosticarse cuando existe esteatosis hepática (imagen o biopsia) con obesidad adicional (índice de masa corporal
≥
25 kg/m²) o diabetes de tipo 2. En individuos de peso normal, deben considerarse 2 factores adicionales del síndrome metabólico (perímetro de la cadera >101 y 87 cm en hombres y mujeres, respectivamente). Mujeres, hipertensión >130/85 mmHg, hipertrigliceridemia >1,7 mmol/l, colesterol HDL <1,0 y 1,3 mmol/l en hombres y mujeres respectivamente, prediabetes con HbA1c de 5,7 a 6,4%, PCR >2 mg/l) deben estar presentes. Esta definición se utiliza en cierta medida, pero aún no se ha establecido en las directrices vigentes de las sociedades profesionales ni en la práctica clínica diaria.
Mensajes para llevarse a casa
- La prevalencia de la NAFLD ha aumentado significativamente en los últimos años.
- Los pacientes con obesidad y síndrome metabólico tienen un alto riesgo de desarrollar HGNA.
- El cribado de estas poblaciones de riesgo por parte de sus médicos de atención primaria para detectar la presencia de HGNA y estimar el estadio de la enfermedad es importante para detectar precozmente la enfermedad hepática avanzada e iniciar el tratamiento.
- La puntuación de fibrosis NAFLD y el FIB-4 son métodos de cribado para la evaluación de la fibrosis y pueden realizarse sin necesidad de equipamiento.
- Los pacientes con HGNA deben someterse regularmente a pruebas de detección de enfermedades cardiovasculares.
- La base de la terapia es un cambio en el estilo de vida con un aumento de la actividad física y un cambio en la dieta con el objetivo de reducir el peso entre un 7 y un 10%.
- Se están investigando terapias farmacológicas en ensayos, pero hasta ahora no hay ningún fármaco aprobado para el tratamiento de la NAFLD.
Literatura:
- Arshad T, Golabi P, Henry L, Younossi ZM: Epidemiología de la enfermedad del hígado graso no alcohólico en Norteamérica. Curr Pharm Des 2020; 26: 993-997.
- Vieira Barbosa J, Lai M: Detección de la enfermedad del hígado graso no alcohólico en pacientes con diabetes mellitus tipo 2 en el ámbito de la atención primaria. Hepatol Commun 2021; 5: 158-167.
- Eslam M, Valenti L, Romeo S: Genética y epigenética de la NAFLD y la NASH: Impacto clínico. J Hepatol 2018; 68: 268-279.
- Tacke F, Weiskirchen R: Fibrosis hepática relacionada con la enfermedad del hígado graso no alcohólico (EHGNA)/esteatohepatitis no alcohólica (EHNA): mecanismos, tratamiento y prevención. Ann Transl Med 2021; 9(8): 729.
- Canbay A, Kachru N, Haas JS, et al: Patrones y predictores de mortalidad y progresión de la enfermedad entre los pacientes con enfermedad del hígado graso no alcohólico. Aliment Pharmacol Ther 2020; 52: 1185-1194.
- Asociación Europea para el Estudio de la L, Asociación Europea para el Estudio de la D y Asociación Europea para el Estudio de la O. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64: 1388-1402.
- Angulo P, Kleiner DE, Dam-Larsen S, et al: La fibrosis hepática, pero no otras características histológicas, se asocia con los resultados a largo plazo de los pacientes con enfermedad del hígado graso no alcohólico. Gastroenterología 2015; 149: 389-397.
- Kleiner DE, Brunt EM, Van Natta M, et al: Diseño y validación de un sistema de puntuación histológica para la enfermedad del hígado graso no alcohólico. Hepatología 2005; 41: 1313-1321.
- Angulo P, Hui JM, Marchesini G, et al: La puntuación de fibrosis NAFLD: un sistema no invasivo que identifica la fibrosis hepática en pacientes con NAFLD. Hepatología 2007; 45: 846-854.
- Sterling RK, Lissen E, Clumeck N, et al: Desarrollo de un índice no invasivo sencillo para predecir la fibrosis significativa en pacientes con coinfección por VIH/VHC. Hepatología 2006; 43: 1317-1325.
- American Diabetes A. 4. Evaluación médica integral y valoración de comorbilidades: Normas de atención médica en diabetes-2021. Diabetes Care 2021; 44: 40-52.
- European Association for the Study of the L, List of panel m, Berzigotti A, Boursier J, Castera L, et al: Easl Clinical Practice Guidelines (Cpgs) On Non-Invasive Tests For Evaluation Of Liver Disease Severity And Prognosis – 2020 Update. J Hepatol 2021.
- Younossi ZM, Ratziu V, Loomba R, et al: Ácido obetichólico para el tratamiento de la esteatohepatitis no alcohólica: análisis provisional de un ensayo de fase 3 multicéntrico, aleatorizado y controlado con placebo. Lancet 2019; 394: 2184-2196.
- Roeb E, Steffen HM, Bantel H, et al: [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol 2015; 53: 668-723.
- Lassailly G, Caiazzo R, Ntandja-Wandji LC, et al: La cirugía bariátrica proporciona una resolución a largo plazo de la esteatohepatitis no alcohólica y una regresión de la fibrosis. Gastroenterología 2020; 159: 1290-1301.
- Lai LL, Vethakkan SR, Nik Mustapha NR, et al: Empagliflozina para el tratamiento de la esteatohepatitis no alcohólica en pacientes con diabetes mellitus tipo 2. Dig Dis Sci 2020; 65: 623-631.
- Newsome PN, Buchholtz K, Cusi K, et al: Ensayo controlado con placebo de semaglutida subcutánea en la esteatohepatitis no alcohólica. N Engl J Med 2021; 384: 1113-1124.
- Eslam M, Sanyal AJ, George J, International Consensus P: MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterología 2020; 158: 1999-2014.
PRÁCTICA GP 2021; 16(10): 4-8