Los fármacos con un estrecho margen terapéutico, como suelen utilizarse en oncología, requieren un conocimiento básico de las posibles interacciones con otros preparados. Farmacodinámica y farmacocinética no deben ser palabras extrañas.
El uso seguro de los medicamentos incluye el conocimiento de las interacciones farmacológicas potencialmente graves. Especialmente en oncología, a menudo se utilizan sustancias con un estrecho margen terapéutico. Tanto las concentraciones subterapéuticas, con el riesgo de fracaso del tratamiento, como las supraterapéuticas, con posibles efectos adversos, deben evitarse cuidadosamente. Un conocimiento básico de la farmacodinámica y la farmacocinética de los fármacos de uso frecuente -especialmente en relación con las terapias oncológicas orales de administración diaria, como los inhibidores de la tirosina quinasa o de los puntos de control- es un requisito previo para anticipar o reconocer las interacciones clínicamente relevantes e indeseables. La gestión de las interacciones farmacológicas incluye la reducción de la dosis, el retraso en la administración o la interrupción de al menos uno de los socios de la interacción, en función de la evaluación beneficio-riesgo. En este artículo de formación, se ilustra una visión general de las interacciones farmacológicas relevantes con estudios de casos clínicos seleccionados y una especial atención a las sustancias oncológicas.
Antecedentes farmacológicos
El uso seguro de los medicamentos incluye el conocimiento de las interacciones farmacológicas potencialmente graves. Especialmente en oncología, se utilizan con frecuencia sustancias con un perfil farmacológico complejo, una curva dosis-respuesta/toxicidad pronunciada, diferencias farmacocinéticas y farmacodinámicas en función de la población (variabilidad entre pacientes) y escasa amplitud terapéutica. Todo esto significa que el margen entre las concentraciones terapéuticas y los niveles potencialmente tóxicos del fármaco suele ser pequeño.
Uno “de más” ya puede provocar efectos adversos graves. Se presentan los mismos efectos que en la intoxicación. ¡No es la dosis sino la concentración en el cuerpo lo que hace el veneno! Por lo tanto, todos los procesos que conducen a un aumento correspondiente también pueden dar lugar a síntomas del efecto aumentado, de forma análoga al envenenamiento. Las interacciones adversas pueden tener incluso consecuencias fatales, como ha demostrado, por ejemplo, la combinación de sustancias antivirales como la sorivudina con análogos orales del fluorouracilo (por ejemplo, la capecitabina).
Un “demasiado poco puede” significar una pérdida de actividad, lo que puede asociarse a un peor pronóstico. Especialmente en este caso, los factores que influyen son clínicamente difíciles de captar – diagnóstico diferencial: ¡no responde! Un paciente muere antes de su enfermedad oncológica que la media estadística. Sin embargo, la administración de un inductor también conlleva una reducción de los efectos secundarios asociados a la quimioterapia, que dependen principalmente de la dosis.
Los pacientes multimórbidos y polifarmacéuticamente tratados ya muestran una mayor vulnerabilidad a las interacciones farmacológicas. Otros factores de riesgo son la disfunción orgánica, especialmente la insuficiencia renal, el uso de inductores o inhibidores enzimáticos y las constelaciones de riesgo con muchos médicos implicados. El grupo de pacientes geriátricos es especialmente susceptible a las interacciones debido a algunas peculiaridades, en términos de farmacocinética (biodisponibilidad alterada, aclaramiento y funciones orgánicas reducidas, hipalbuminemia, reducción del volumen extracelular, aumento de la fracción de tejido adiposo), polifarmacia y cumplimiento farmacológico. Especialmente en los pacientes de edad avanzada, la función renal basada en la tasa de filtración glomerular calculada (eGFR) puede parecer mejor de lo que es si la inmovilidad y la masa muscular reducida provocan concentraciones bajas de creatinina en la sangre. Especialmente en el caso de sustancias de eliminación renal, se recomienda entonces una reducción de la dosis.
En principio, las interacciones entre medicamentos pueden dividirse en interacciones farmacocinéticas o farmacodinámicas.
La farmacocinética describe el efecto del organismo sobre la sustancia – relacionado con la absorción, distribución, metabolismo y excreción de un fármaco.
Las interacciones farmacocinéticas pueden producirse en cualquier nivel del ADME (absorción, distribución, metabolismo, eliminación), por ejemplo
Absorción: Interferencia de sustancias en el tracto intestinal con complejación y absorción consecuentemente reducida.
Enfoque especial: sustancias oncológicas y grupos de sustancias: Interacciones con medicamentos supresores de la acidez (inhibidores de la bomba de protones, antagonistas H2, antiácidos): Ex. Inhibidores de la tirosina quinasa: crizotinib, dasatinib, erlotinib, gefitinib, lapatinib, pazopanib. Es mejor evitar estas combinaciones o utilizarlas a intervalos.
- Distribución: Interferencia debida al desplazamiento de la unión a proteínas plasmáticas con aumento del volumen de distribución con relevancia clínica cuestionable. La fracción libre, no unida, de un fármaco se considera la parte farmacológicamente activa.
- Metabolismo: Interferencia en el metabolismo con inducción o inhibición de las enzimas correspondientes con consecuente aceleración o inhibición del metabolismo.
Enfoque especial: sustancias oncológicas y grupos de sustancias: Un ejemplo de sustratos del citocromo (CYP) sería la clase de los inhibidores de la tirosina quinasa (ITK), que se metabolizan todos en cierta medida a través del CYP3A4. Interacciones con inhibidores potentes del CYP3A4 (por ejemplo, ketoconazol, voriconazol, itraconazol) e inductores potentes del CYP3A4 (por ejemplo, rifampicina, enzalutamida). Rifampicina, enzalutamida) y TKIs: axitinib, crizotinib, dasatinib, erlotinib, gefitinib, imatinib, lapatinib, nilotinib, pazopanib, regorafenib, ruxolitinib, sunitinib, vemurafenib. El uso concomitante debe evitarse o ir acompañado de ajustes de dosis de los sustratos (TKIs).
- Eliminación: Interferencia en la eliminación con competencia por los mecanismos de transporte con el consiguiente retraso en la excreción y posible acumulación en el organismo.
Enfoque especial: sustancias oncológicas y grupos de sustancias: Ejemplos de sustancias oncológicas de eliminación renal serían la bendamustina, la bleomucina, el carboplatino, el cisplatino, el oxaliplatino, la ciclofosfamida, el metotrexato, el pemetrexed y el topotecán. Los salicilatos, el probenecid o las sulfonamidas pueden competir por la secreción tubular renal cuando se utilizan simultáneamente con el metotrexato, dando lugar a una eliminación reducida y, por tanto, a un aumento de la concentración de metotrexato.
Las interacciones farmacocinéticas provocan un cambio en el nivel plasmático de las sustancias, lo que puede dar lugar a un efecto reducido o aumentado. A menudo, están implicados representantes de la familia enzimática del citocromo P450, transportadores de fármacos como la glicoproteína P o transportadores de iones orgánicos. La tabla 1 muestra sustancias ejemplo de inductores e inhibidores del CYP3A4 utilizados con frecuencia.
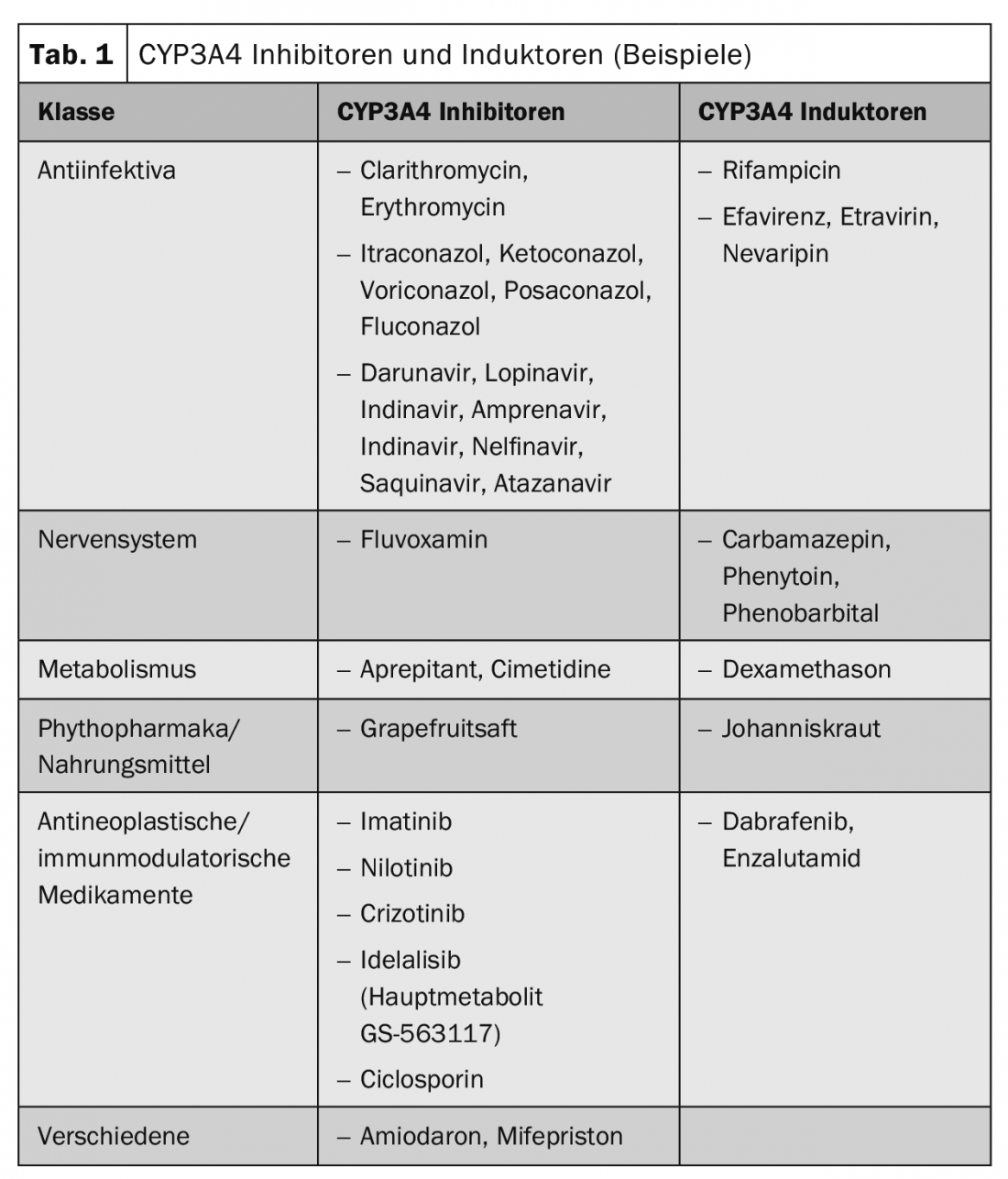
Enfoque especial: sustancias oncológicas y grupos de sustancias: El tamoxifeno es en sí mismo un profármaco que se activa a través del CYP2D6. Por lo tanto, se requiere especial precaución con los inhibidores de esta isoenzima. El tamoxifeno se metaboliza a su metabolito activo endoxifeno con la participación del CYP2D6. Además, el CYP3A4 y, en menor medida, el CYP2C9 y el CYP2C19 están implicados en el metabolismo del tamoxifeno. Por lo tanto, los inhibidores del CYP2D6 pueden influir en el metabolismo del tamoxifeno de forma clínicamente relevante y provocar así una reducción o pérdida de eficacia del tamoxifeno. La administración simultánea de inhibidores del CYP2D6 como la paroxetina provocó una reducción de las concentraciones plasmáticas del metabolito activo endoxifeno de hasta el 75% en estudios publicados. Por lo tanto, debe evitarse el uso simultáneo de inhibidores de CYP2D6 (como paroxetina, fluoxetina) junto con tamoxifeno. Por otro lado, el antidepresivo venlafaxina no sería un inhibidor del CYP2D6.
Por el contrario, los propios fármacos oncológicos no sólo pueden ser sustratos de las enzimas CYP, sino también inhibidores o inductores de las isoenzimas.
Enfoque especial: sustancias oncológicas y grupos de sustancias: El idelalisib, un inhibidor de la fosfatidilinositol 3-cinasa, se convierte en el metabolito principal GS-563117, que es un fuerte inhibidor del CYP3A. La reacción del marcador CYP3A4 con el midazolam mostró un aumento de la Cmax del midazolam del 140% y del AUC del 440%. Por lo tanto, también existe la posibilidad de interacción con otros fármacos que se metabolizan a través del CYP3A4, por ejemplo. Ciclosporina, sirolimus, tacrolimus, amlodipino, carbamazepina, colchicina, diltiazem, felodipino, fentanilo, ketoconazol, itraconazol, posaconazol, voriconazol, lidocaína, metadona, nifedipino, nicardipino, trazodona, warfarina, fenprocumón, boceprevir, telaprevir, claritromicina, telitromicina, atorvastatina, tadalafilo, buspirona, clorazepato, diazepam, estazolam, flurazepam, zolpidem o inhibidores de la tirosina quinasa como el erlotinib. Una combinación con idelalisib, por ejemplo, requiere una reducción de la dosis de erlotinib, que deberá entonces reducirse en pasos de 50 mg según la información de los expertos. La dosis recomendada de erlotinib suele ser de 150 mg una vez al día al menos una hora antes o dos horas después de comer.
También se conocen otras vías de degradación o conversión independientes del citocromo P450. De nuevo, son posibles algunas interacciones clínicamente relevantes.
Enfoque especial: sustancias oncológicas y grupos de sustancias: El fluorouracilo se metaboliza principalmente en el hígado a productos inactivos, incluyendo dióxido de carbono, urea y α-fluoro-β-alanina (FBAL). La enzima dihidropirimidina deshidrogenasa (DPD), para la que se conoce un polimorfismo genético, está implicada en el metabolismo. La metabolización del fluorouracilo se ralentiza en los pacientes con insuficiencia de dihidropirimidina deshidrogenasa (DPD). Este es también el tema de un procedimiento en curso de la Agencia Europea del Medicamento (EMA), en el que se están examinando los métodos de detección existentes para la deficiencia de DPD. Pero ciertas sustancias también pueden inhibir la DPD de forma irreversible. Medicamentos que contienen fluorouracilo, como La capecitabina o el Tegafur (profármacos del 5-FU), no deben utilizarse junto con la brivudina o sustancias químicamente relacionadas como la sorivudina. La inhibición enzimática puede provocar un aumento de la toxicidad de los productos de 5-FU, que puede ser potencialmente mortal. Debe observarse un intervalo de al menos 4 semanas entre el tratamiento con brivudina, sorivudina o análogos y el inicio de la terapia con productos de 5-FU.
La farmacodinámica, por su parte, describe el efecto de la sustancia en el organismo.
En este tipo de interacción, la actividad farmacológica de la sustancia respectiva se ve influida sin cambiar la concentración en el lugar de acción por la combinación con una sustancia con un efecto similar u opuesto, lo que resulta en una potenciación o atenuación del efecto terapéutico. Esto no modifica las concentraciones en la sangre. Por lo tanto, la monitorización terapéutica de fármacos (TDM) con determinaciones de niveles plasmáticos no aporta ninguna información adicional en este caso. Por ejemplo, diversas sustancias, así como las sustancias oncológicas clásicas (por ejemplo, las antraciclinas) pueden prolongar el tiempo QTc. Estos cambios en el ECG también se notifican con frecuencia en el caso de los inhibidores de la tirosina cinasa. El potencial depende de la estructura química y de la concentración plasmática de la sustancia. Por lo tanto, la prolongación del QTc puede aumentar aún más en combinación con inhibidores del CYP, pero también el uso simultáneo de diferentes fármacos que influyen en el tiempo QTc.
Enfoque especial: sustancias oncológicas y grupos de sustancias: Ejemplos de inhibidores de la tirosina quinasa que interactúan con sustancias que prolongan el QTc: Crizotinib, gefitinib, lapatrinib, nilotinib, pazopanib, sorafenib, sunitinib, vandetanib, vemurafenib. Si las combinaciones especiales son clínicamente necesarias, se recomiendan controles de ECG ya antes del inicio de la terapia y después en el curso posterior.
Las interacciones entre fármacos revisten especial importancia, ya que pueden predecirse mediante informes de casos anteriores, estudios clínicos o la comprensión de los principios farmacológicos. Las interacciones adversas entre medicamentos pueden tener consecuencias hasta mortales, lo que puede llevar a que las sustancias establecidas también tengan que ser retiradas del mercado.
Las interacciones farmacéuticas como incompatibilidades fisicoquímicas de dos sustancias fuera del organismo pueden dar lugar a complejación, degradación o precipitación. Sin embargo, éstos no son objeto de esta visión general.
Además de las interacciones fármaco-fármaco, también existen interacciones fármaco-hierba (por ejemplo, con el ginkgo, el ginseng, el ajo), interacciones fármaco-alimento (por ejemplo, con la leche, el zumo de pomelo), interacciones fármaco-alcohol (por ejemplo, con las benzodiacepinas y muchas otras sustancias sedantes), o interacciones fármaco-enfermedad (por ejemplo, la metoclopramida y la enfermedad de Parkinson). También son posibles las interacciones con otras sustancias y sustancias exógenas como el tabaco. Los ingredientes del tabaco provocan la inducción de CYP1A1 y CYP1A2 en los fumadores.
Enfoque especial: sustancias oncológicas y grupos de sustancias: Caso práctico tabaco y erlotinib: Por ejemplo, el erlotinib se metaboliza en el hígado a través de las isoenzimas CYP3A4 y CYP1A2 y en los pulmones posiblemente a través de la CYP1A1. Esto se traduce en una reducción del 50-60% de la exposición al erlotinib en los fumadores. En un estudio farmacocinético, la exposición fue de la mitad a un tercio de la encontrada en no fumadores o ex fumadores como resultado de la inducción del CYP1A1 en el pulmón y del CYP1A2 en el hígado. Por esta razón, debe recomendarse además a los fumadores que dejen de fumar.
Por otro lado, las interacciones, especialmente en oncología con muchas terapias combinadas, también son deseables. Sin embargo, dependiendo del estudio, las interacciones entre medicamentos también son responsables del 20-30% de las reacciones adversas a medicamentos, la mayoría de las cuales llegan a ser clínicamente relevantes. A medida que aumenta el número de medicamentos administrados, también lo hace el potencial de interacciones farmacológicas adversas. Se asocian a una mayor morbilidad y mortalidad, a una hospitalización prolongada de los pacientes afectados y a un aumento de los costes sanitarios. Aunque algunas de las reacciones adversas a los medicamentos y los efectos secundarios no pueden predecirse, muchos pueden anticiparse y prevenirse.
Casos prácticos
Interacción farmacocinética: quimioterapia y terapia antirretrovírica: Un hombre de 63 años con infección por VIH de larga duración con terapia antirretrovírica adecuada y enfermedad coronaria de 3 vasos se presenta con nuevas masas indistintas en la cabeza del páncreas. En los casos de sospecha de carcinoma de la cabeza del páncreas, la quimioterapia con gemcitabina y nab-paclitaxel debe someterse a pruebas para detectar interacciones con la terapia existente (tab. 2).
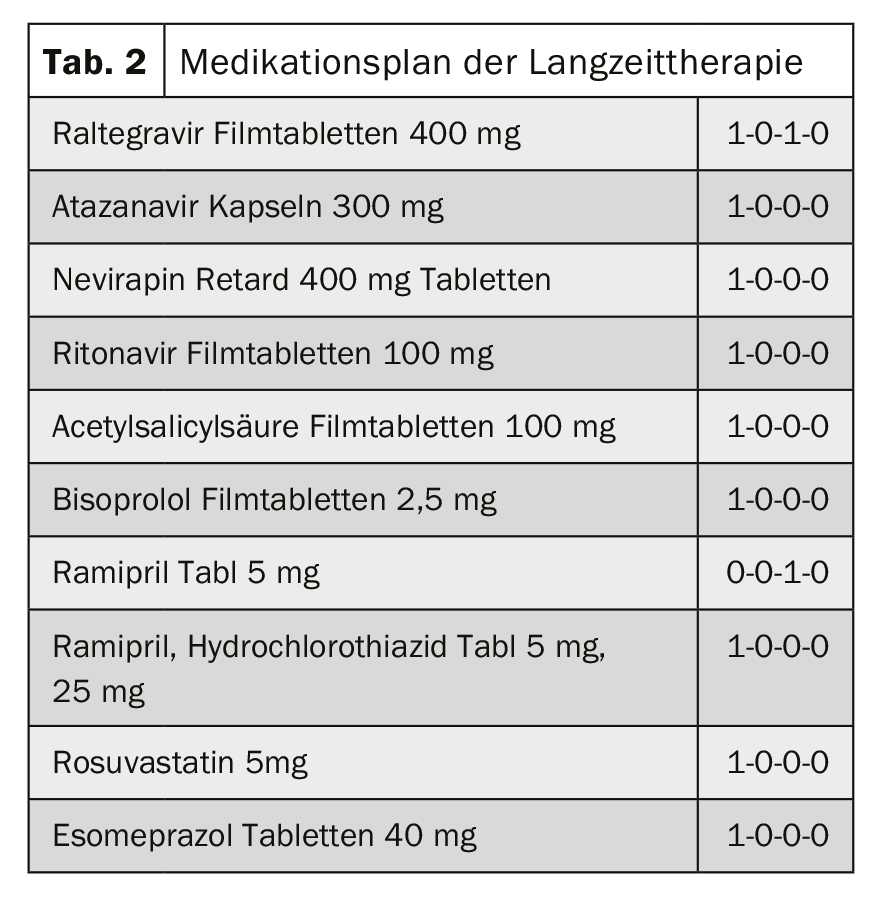
Evaluación y antecedentes: El nab-paclitaxel es un agente antimicrotúbulos. El nab-paclitaxel se metaboliza a través de CYP2C8 y CYP3A4. Por tanto, los fármacos que inducen o inhiben el sistema enzimático CYP (CYP2C8 y/o CYP3A4) pueden afectar a los niveles plasmáticos de nab-paclitaxel y, por tanto, a su eficacia.
- Interacción Nab-paclitaxel y ritonavir: El ritonavir es un fuerte inhibidor de CYP2C8 y CYP3A4. La fuerte inhibición de estas enzimas también puede conducir a un aumento de los niveles plasmáticos de nab-paclitaxel.
- Interacción paclitaxel y atazanavir: El atazanivir es un fuerte inhibidor del CYP3A4 y un débil inhibidor del CYP2C8. Una fuerte inhibición del CYP3A4 puede dar lugar a un aumento de los niveles plasmáticos de nab-paclitaxel. Es probable que la débil inhibición del CYP2C8 desempeñe un papel menor, pero podría sumarse a otras interacciones. Aunque estas interacciones no se han demostrado formalmente mediante estudios farmacocinéticos, puede suponerse un aumento del efecto y del riesgo de efectos secundarios en función de la dosis sobre la base de derivaciones teóricas.
Basándose en derivaciones teóricas, las interacciones farmacocinéticas del atazanavir y el ritonavir con el nab-paclitaxel conducen a un aumento de los niveles plasmáticos del agente antimicrotúbulos. En la terapia combinada, cabría esperar efectos adversos del fármaco nab-paclitaxel dependientes de la concentración, como depresión de la médula ósea, mucositis y neuropatía periférica. Debido al estrecho margen terapéutico de la quimioterapia, a la mielotoxicidad como complicación potencialmente mortal y a varias vías de degradación del paclitaxel que estarían inhibidas, se recomienda el cambio de las combinaciones atazanavir/ritonavir y nab-paclitaxel.
La interacción farmacodinámica: inhibidor de puntos de control e “inmunomoduladores”/inmunosupresores [7]: Una paciente de 53 años con antecedentes de trasplante hepático hace 36 meses por carcinoma hepatocelular debido a cirrosis hepática con infección crónica por hepatitis C está recibiendo prednisona, micofenolato y everolimus como terapia inmunosupresora. Debido a la recidiva del CHC con metástasis dos años después del trasplante, se administra sorafenib. Debido a los efectos secundarios y también a la progresión de la enfermedad subyacente, se interrumpe de nuevo al cabo de dos meses. Se inicia el tratamiento con nivolumab a una dosis de 200 mg (3 mg/kg de peso corporal). A continuación, los parámetros de la función hepática aumentan al cabo de una semana. Se realiza una biopsia hepática que muestra signos de rechazo celular agudo. A continuación, se trata al paciente con tacrolimus y metilprednisona 500 mg/día. Se produce un mayor deterioro de la función hepática, del estado clínico, depresión del SNC en la hemorragia intracerebral con cuidados médicos intensivos y, en última instancia, un desenlace fatal.
Evaluación y antecedentes: Los inhibidores del punto de control inmunitario, como el nivolumab, han revolucionado el tratamiento de diversas enfermedades tumorales. El nivolumab (Opdivo®) es un anticuerpo monoclonal IgG4 humano que bloquea los receptores PD-1 de las células T activadas, las células B y las células T asesinas naturales, los monocitos y las células dentríticas. Los receptores PD-1 tienen 2 ligandos, PD-L1 y PD-L2, que se expresan en las células tumorales y en las células presentadoras de antígenos. La unión del receptor a los ligandos conduce a una regulación negativa de las células T y a la prevención de la respuesta de las células T. La prevención de la unión provoca una respuesta de las células T y un efecto antitumoral. Por otro lado, la tolerancia inmunológica en el trasplante de órganos es esencial para este paciente. La transducción de señales PD-1 y CTLA-4 conducen a la tolerancia inmunológica. Por lo tanto, la inhibición puede desencadenar un fallo orgánico inmunomediado en estos pacientes.
Según el SmPC suizo, “el tratamiento con nivolumab o nivolumab en combinación con ipilimumab no debe reanudarse mientras el paciente esté recibiendo dosis de corticosteroides inmunosupresores u otra terapia inmunosupresora”. Asimismo, “debe evitarse el uso de corticosteroides sistémicos y otros inmunosupresores antes de iniciar el tratamiento con nivolumab debido a su posible interferencia con la actividad farmacodinámica”. Basándose en consideraciones farmacodinámicas, esta interacción puede llegar a ser relevante en ambas direcciones: Una reducción del efecto inmunosupresor de los importantes fármacos postrasplante, pero también una reducción del efecto antitumoral de los inhibidores de los puntos de control.
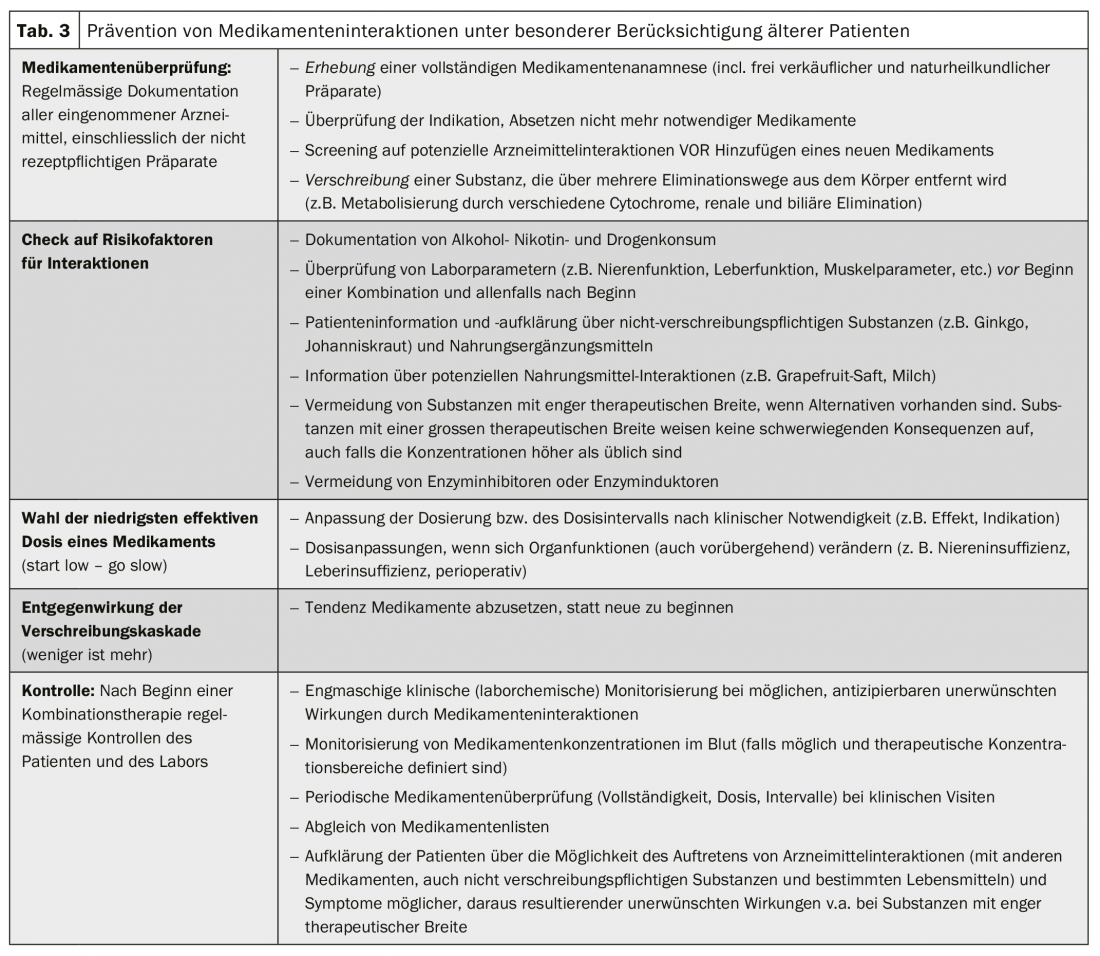
Enfoque clínico de las interacciones farmacológicas
Las interacciones entre medicamentos pueden causar problemas clínicos en diversos grados. Lo ideal es anticiparse a ellas antes de que se produzcan. Especialmente en caso de polifarmacia, deben observarse ciertas reglas (tab. 3). Las interacciones y los efectos secundarios no reconocidos también pueden acabar en la llamada cascada de prescripción: Los efectos secundarios no se reconocen como tales y se administran nuevas terapias contra los nuevos “síntomas” en lugar de reconocer el desencadenante farmacológico. Cuando se producen interacciones con efectos adversos, la gestión consiste en la interrupción o reducción de la dosis de la(s) sustancia(s) sospechosa(s), la vigilancia continuada, los controles clínicos o las mediciones del nivel terapéutico. (Tab. 4). La detección y prevención de interacciones farmacológicas indeseables y clínicamente relevantes es un trabajo de equipo e implica no sólo al paciente, sino también a todos los médicos, enfermeras y farmacéuticos implicados.

Podría demostrarse que las hospitalizaciones relacionadas con la interacción podrían evitarse mediante controles adecuados y una selección racional de la medicación más apropiada en cada situación. Los libros de texto actuales, los programas sobre interacciones o las páginas web sobre interacciones (recuadro ) proporcionan ayuda sobre las interacciones de los medicamentos. Sin embargo, los programas informáticos diseñados para ayudar a detectar combinaciones peligrosas fallan hasta en un tercio de las interacciones, mientras que, por otro lado, a menudo advierten innecesariamente de interacciones triviales y clínicamente irrelevantes. Por ello, a menudo resulta útil consultar más de una base de datos de interacciones.
|
Páginas web para comprobar la interacción
|
Las consideraciones de principio sobre la interacción potencial proporcionan un apoyo adicional:
- ¿Está completa la lista de medicamentos, incl. ¿preparados a base de plantas?
- ¿Hay alguna sustancia que sea especialmente susceptible de interactuar?
- ¿Existen alternativas potenciales a estas sustancias?
- ¿Cómo pueden controlarse los efectos?
- ¿Se trata de una interacción farmacocinética en la que podría ser útil la monitorización terapéutica del fármaco con determinación de niveles?
- ¿Cuál es la gravedad del efecto adverso? ¿Cuál es la relevancia clínica de la terapia? (evaluación de riesgos y beneficios)
- ¿La interacción depende de la dosis o de la concentración? ¿Se puede esperar una mejora de los síntomas con una reducción de la dosis?
- ¿Existen otros factores específicos del paciente que favorezcan la reacción adversa (por ejemplo, insuficiencia renal)? ¿Se pueden optimizar?
Resumen
En resumen, es importante pensar desde el principio en las posibles interacciones entre medicamentos. Esto es especialmente relevante cuando se añade un nuevo fármaco a un régimen terapéutico ya de por sí complejo. Las nuevas sustancias oncológicas, como las terapias dirigidas, suelen tomarse a diario. La amplitud terapéutica suele ser estrecha. Los pacientes oncológicos de edad avanzada y con una capacidad de eliminación alterada -como la disfunción renal- son especialmente susceptibles a los efectos adversos debidos a las interacciones farmacológicas.
Mensajes para llevarse a casa
- Especialmente en oncología, se utilizan predominantemente sustancias con un estrecho margen terapéutico.
- Antes de añadir una nueva sustancia (fármaco, pero también fitofármaco) a un plan terapéutico ya existente, debe comprobarse si existen posibles interacciones.
- Existen programas especiales de interacción y páginas web de interacción con mayor o menor precisión para comprobar las interacciones de los medicamentos.
- Las opciones para las interacciones adversas de los medicamentos varían según el tipo y la gravedad o la relación riesgo-beneficio. Puede ser necesaria una reducción de la dosis, un cambio en el tiempo de aplicación o incluso la interrupción de la(s) sustancia(s) sospechosa(s).
- Si se sospechan interacciones farmacológicas o no pueden evitarse, se aconseja una estrecha vigilancia clínica o de laboratorio y, si es necesario, la medición de las concentraciones del fármaco en la sangre (en el caso de interacciones farmacocinéticas).
Literatura:
- Wilkinson GR: Metabolismo de los fármacos y variabilidad entre pacientes en la respuesta al fármaco. N Engl J Med 2005; 352: 2211-2221.
- van Leeuwen RW, et al: Interacciones medicamentosas con los inhibidores de la tirosina cinasa: una perspectiva clínica. Lancet Oncol 2014; 15: e315-e326.
- van Leeuwen RW, et al: Prevalencia de posibles interacciones medicamentosas en pacientes con cáncer tratados con anticancerígenos orales. Br J Cancer 2013; 108: 1071-1078.
- Mallet L, Spinewine A, Huang A: El reto de gestionar las interacciones farmacológicas en los ancianos. Lancet. 2007 Jul 14;370(9582): 185-191.
- Beijnen JH, Schellens JHM: Interacciones farmacológicas en oncología. Lancet Oncol. 2004 Ago;5(8): 489-496.
- Van Meerten E, Verweij J, Schellens JHM: Agentes antineoplásicos: interacciones farmacológicas de importancia clínica. Seguridad de los medicamentos 1995; 12: 168-182.
- Gassmann D, et al: Fallo del aloinjerto hepático tras el tratamiento con nivolumab: informe de un caso con investigación bibliográfica sistemática. Trasplante Directo. 2018 Jul 20;4(8): e376.
- Weiler S, et al. Consejos para la práctica: Interacciones farmacológicas adversas clínicamente relevantes. Foro Suiza Med 2015. 15: 152-156.
InFo ONcOLOGíA & HEMATOLOGíA 2019; 7(2-3): 5-10.