Las queratosis actínicas (QA) están asociadas al carcinoma de células escamosas, pero se sabe poco sobre el riesgo de progresión de las lesiones individuales. Sin embargo, la carcinogénesis de campo o un mayor número de lesiones y la extensión de la hiperproliferación de células queratinocíticas atípicas parecen ser factores relevantes. Una herramienta buena y factible para evaluar la gravedad de la QA y valorar el éxito del tratamiento es la puntuación AKASI. El diagnóstico de la QA puede confirmarse hoy en día mediante modernos procedimientos no invasivos.
Las queratosis actínicas (QA) se encuentran entre las dermatosis más comunes de la piel dañada crónicamente por el sol. Se trata de lesiones cutáneas precancerosas resultantes de la proliferación de queratinocitos atípicos en la piel dañada por los rayos UV, que afectan sobre todo a la cara, el cuero cabelludo sin pelo y las extremidades. Según datos epidemiológicos, la prevalencia de la QA en personas mayores de 60 años se sitúa entre el 20 y el 35% [1–3].
La QA es una afección precancerosa facultativa
Un estudio de cohortes con un periodo de seguimiento de 5 años demostró que el 65% de los carcinomas de células escamosas (CCE) surgieron de lesiones de QA preexistentes [4]. En otro estudio, se informó de que la probabilidad de progresión a CCE en un plazo de 10 años en pacientes con una media de 7,7 AK era de alrededor del 10% [19].
“Los estudios de secuenciación del genoma confirman que las queratosis actínicas son lesiones precancerosas”, afirma la Prof. Dra. Nicole Kelleners-Smeets, del Centro Médico de la Universidad de Maastricht (Países Bajos) [5]. La conclusión de un amplio estudio genético molecular que utilizó la secuenciación del exoma fue que la QA se caracteriza por alteraciones genómicas que también se producen en el CCE, incluidas anomalías en la vía de transducción de señales del TGF-β [6]. En consonancia con otros estudios, también se detectaron mutaciones en TP53 y NOTCH. La inactivación mutacional temprana de NOTCH1 en la QA puede facilitar la progresión de QA a CCE [6]. El TP53 es un gen supresor de tumores cuyo producto génico (la proteína p53) funciona como factor de transcripción. Se activa por el estrés celular, por ejemplo el daño al ADN inducido por los rayos UV. Aunque cada vez hay más pruebas sobre los factores que favorecen la progresión a CCE, sigue siendo difícil evaluar qué lesiones de QA presentan un riesgo elevado y cuáles remitirán. El ponente hizo hincapié en que el tratamiento de la QA puede prevenir el desarrollo del CCE.
| Se calcula que el riesgo de progresión de una QA a un CCE es del 0,025% al 16% para una única lesión al año. Según esto, las tasas de transformación para un paciente con 6-8 lesiones son del 0,15-80% al año [9]. En la actualidad, la base de pruebas sobre los factores pronósticos que determinan la transición de una QA a un CCE sigue siendo insuficiente [9]. Estudios recientes indican que la estadificación previa de la QA y la estimación del riesgo de progresión deberían reconsiderarse [13,14]. En relación con la aparición de la QA en el contexto de la cancerización del campo y una correlación positiva entre el número de lesiones y la probabilidad de progresión, se proponen nuevos criterios de evaluación para los estadios de la QA [9]. El AKASI (índice de área y gravedad de la queratosis actínica) es actualmente una herramienta significativa para evaluar la gravedad de la QA, pero también para valorar el éxito del tratamiento [12]. |
Utilizar métodos no invasivos para diagnosticar la QA
Según la actual directriz S3, la indicación del tratamiento de la QA debe hacerse en sinopsis del cuadro clínico y los factores de riesgo (por ejemplo, inmunosupresión, exposición acumulada a los rayos UV, número de lesiones) [9]. Histológicamente, una característica de la QA es la acumulación de queratinocitos atípicos en el estrato basal de la epidermis, desde donde pueden progresar con el tiempo al estrato granuloso y al estrato córneo [16,17]. Los queratinocitos alterados de la QA muestran núcleos agrandados, pleomórficos, hipercrómicos y una elevada relación núcleo-citoplasma [9]. Mientras que en el pasado se requerían exámenes histopatológicos para identificar cambios precancerosos en la piel, hoy en día se dispone de varias técnicas de diagnóstico no invasivas, en particular la dermatoscopia, la microscopía confocal de reflexión (MCR) y la tomografía de coherencia óptica (OCT) o la OCT de campo lineal, explicó el Prof. Dr. Giuseppe Micali, de la Universidad de Catania (I) [7]. La dermatoscopia tiene una alta sensibilidad (aprox. 98%) y especificidad (aprox. 95%) para la detección de la QA, según el ponente [7]. Sin embargo, la QA pigmentada es a veces difícil de diferenciar clínica y dermatoscópicamente de otras lesiones cutáneas, como el lentigo maligno. Además de la dermatoscopia, la MCR es otra técnica de diagnóstico no invasiva. La MCR permite visualizar el sustrato citomorfológico de las estructuras dermatoscópicas sospechosas a nivel celular [8]. La piel dañada por la luz muestra a menudo un patrón de panal atípico en una carcinización de campo como signo de QA subclínica [9]. Una nueva técnica de imagen no invasiva es la LC-OCT. La obtención de imágenes de células individuales con una alta resolución y una profundidad de penetración de hasta 500 μm permite aumentar considerablemente la precisión del diagnóstico.
AKASI como herramienta de evaluación de la gravedad
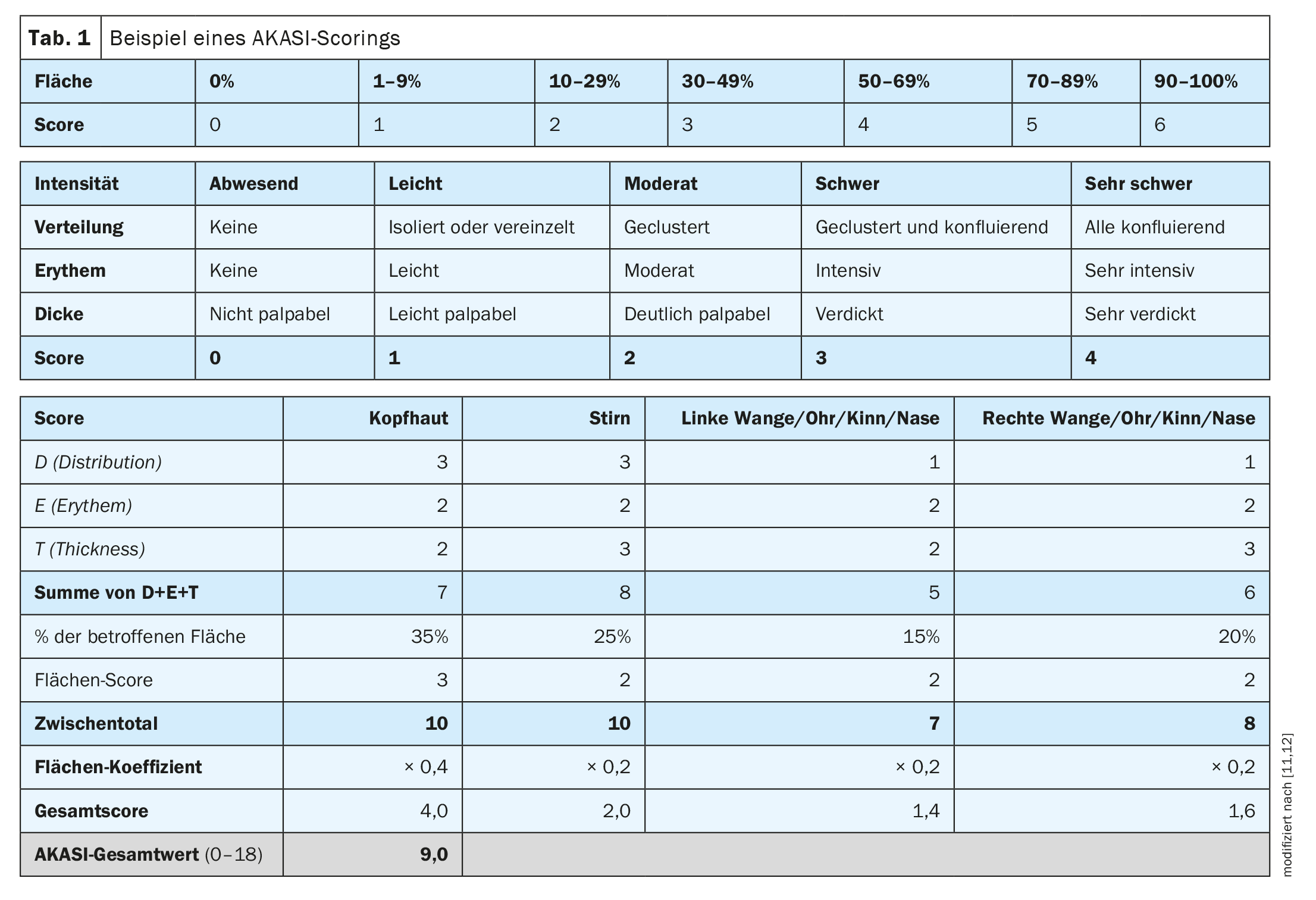
En la práctica clínica, también es importante evaluar la gravedad de las queratosis actínicas como base para la toma de decisiones terapéuticas, afirma el Dr. Girish Gupta, dermatólogo y profesor clínico titular de la Universidad de Edimburgo (Reino Unido) [10]. “Sabemos que el carcinoma de células escamosas está asociado a la QA”, explicó el ponente [10]. El AKASI (“Actinic keratoses activity and severity index”, índice de actividad y gravedad de las queratosis actínicas) se desarrolló para evaluar y controlar la gravedad [12]. “Quizá podamos utilizar la puntuación AKASI para evaluar el riesgo”, afirma el Dr. Gupta. Que el AKASI es una herramienta muy buena para evaluar objetivamente la gravedad de la QA también se corresponde con la opinión del Prof. Dr. Thomas Dirschka, Centroderm Klinik Wuppertal (D) [11,12]. El AKASI permite una cuantificación sencilla de las lesiones (Tab. 1) [11,12]. En un estudio publicado en 2018 por Schmitz et al. investigó si la puntuación AKASI está asociada a los tumores queratinocíticos y cómo lo está [18]. La conclusión fue que los pacientes con una pantalla AKASI >7 tienen probablemente un mayor riesgo de desarrollar un CCE invasivo en comparación con los pacientes con una puntuación más baja.
En cuanto a los métodos no invasivos descritos, el Prof. Dirschka destacó la LC-OCT como un método de diagnóstico muy bueno para detectar lesiones potencialmente peligrosas. Tanto las secciones horizontales y verticales como los aspectos histológicos se muestran en tiempo real.
El riesgo de transformación maligna se correlaciona con el número de lesiones
“El objetivo más importante es evitar la progresión a CCE”, afirmó el profesor Dirschka, y añadió: “Necesitamos terapias para los pacientes de alto riesgo” [11]. Cuanto mayor sea el número de lesiones, mayor será el riesgo de que una de ellas se convierta en un CCE. Por lo tanto, el número de lesiones y la carcinización del campo desempeñan un papel importante en el riesgo de progresión, afirmó el ponente. En este contexto, cuestiona la limitación de la zona a tratar (25 cm2). El riesgo de que una sola QA se convierta en un CCE en el plazo de un año se cifra en la literatura en un 0,025-16%, aunque se sabe poco sobre el riesgo de progresión en ese momento [9]. Pero el riesgo es mayor con un mayor número de lesiones, afirma el Prof. Dirschka. Suponiendo que el riesgo de progresión de una sola lesión de QA sea del 16% al año, esto significaría que con 40 lesiones el riesgo correspondiente es superior al 99% [11].
Enfoque pragmático: ¿a qué objetivos terapéuticos se dirige?
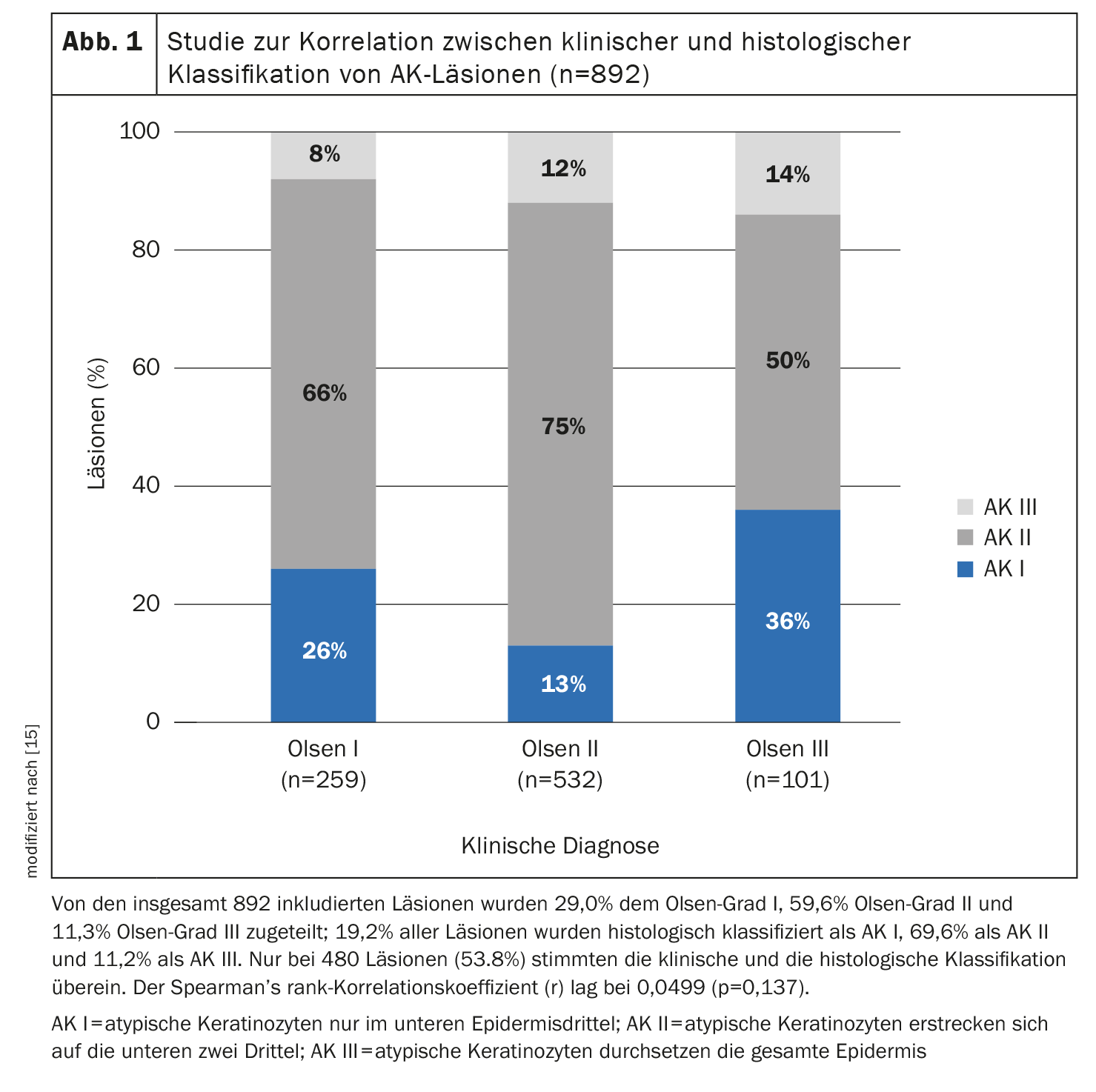
El grado de proliferación basal de las células queratinocíticas atípicas es un criterio importante, afirma el Prof. Dirschka [11]. No considera que las restricciones de tratamiento basadas en la clasificación de Olsen, que se han introducido en el contexto de los ensayos clínicos, sean útiles para la práctica clínica diaria. Por un lado, en un estudio la clasificación de Olsen sólo se correlacionaba relativamente poco con la clasificación histopatológica de las lesiones de QA (grosor de la lesión) (Fig. 1) y, por otro, había lesiones Olsen I con mucha hiperproliferación y lesiones Olsen III con poca hiperproliferación. Desde su punto de vista, una localización de las zonas también está desfasada. Es importante no centrarse exclusivamente en la cara y el cuero cabelludo, sino también en las extremidades. Por último, el ponente señala que la ausencia total de lesiones es un objetivo de tratamiento poco realista en la cancerización de campo y que, en su lugar, es mejor aspirar a una reducción de la puntuación AKASI. Además, hay que vigilar de cerca las lesiones resistentes al tratamiento, ya que son potencialmente peligrosas.
Literatura:
- Ferrándiz C, et al.: EPIQA Study Group; Prevalence of actinic keratosis among dermatology outpatients in Spain. Actas Dermosifiliogr 2016; 107(8): 674–680.
- Flohil SPC, et al.: Prevalence of actinic keratosis and its risk factors in the general population: the Rotterdam Study. J Invest Dermatol 2013; 133(8): 1971–1978
- Eder J, et al.: Prevalence of actinic keratosis among dermatology outpatients in Austria. Br J Dermatol 2014; 171(6): 1415–1421.
- Criscione VD, et al.: Actinic keratoses: natural history and risk of malignant transformation in the veterans affairs topical tretinoin chemoprevention trial. Cancer 2009; 115(11): 2523–2530.
- «Biology of AK», Symposium 8: Management of actinic keratosis and field cancerization, Prof. Dr. Nicole Kelleners-Smeets, EADO Annual Meeting, 20–22 April 2023.
- Thomson J, et al.: The Genomic Landscape of Actinic Keratosis. J Invest Dermatol 2021; 141(7): 1664–1674.e7.
- «Imaging technologies as diagnostic tools for AK», Symposium 8: Management of actinic keratosis and field cancerization, Dr. Giuseppe Micali, EADO Annual Meeting, 20–22 April 2023.
- Ahlgrimm-Siess V, et al.: Diagnostischer Nutzen der Konfokalmikroskopie als weiterführende Untersuchungsmethode von Gesichtsläsionen. JDDG 2019; 17(3): 266–274.
- AWMF: S3-Leitlinie Aktinische Keratose und Plattenepithelkarzinom der Haut. Register-Nr. 032-022OL, Version 2.0: https://register.awmf.org, (letzter Abruf 04.07.2023)
- «Treatment Update – AK», Dr. Girish Gupta, Symposium 8: Management of actinic keratosis and field cancerization, EADO Annual Meeting, 20–22 April 2023.
- «New approaches to study design in AK», Prof. Dr. Thomas Dirschka, Symposium 8: Management of actinic keratosis and field cancerization, EADO Annual Meeting, 20–22 April 2023.
- Dirschka T, et al; Athens AK Study Group: Una propuesta de sistema de puntuación para evaluar la gravedad de la queratosis actínica en la cabeza: índice de área y gravedad de la queratosis actínica. J Eur Acad Dermatol Venereol 2017; 31(8): 1295–1302.
- Dirschka T, et al.: A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index. J Eur Acad Dermatol Venereol 2017; 31(8): 1295–1302.
- Dreno B, et al.: A Novel Actinic Keratosis Field Assessment Scale for Grading Actinic Keratosis Disease Severity. Acta dermato-venereologica 2017; 97(9): 1108–1113.
- Schmitz L, et al.: Actinic keratosis: correlation between clinical and histological classification systems. J Eur Acad Dermatol Venereol 2016; 30(8): 1303–1307.
- Babilas P, Landthaler M, Szeimies RM: Die aktinische Keratose. Hautarzt 2003; 54: 551–562.
- Fu W, Cockerell CJ: The actinic (solar) keratosis: a 21st-century perspective. Arch Dermatol 2003; 139: 66–70.
- Schmitz L, et al.: Actinic keratosis area and severity index (AKASI) is associated with the incidence of squamous cell carcinoma. J Eur Acad Dermatol Venereol 2018; 32(5): 752–756.
- Marks R, Rennie G, Selwood TS: Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet 1988; 1: 795–797.
DERMATOLOGIE PRAXIS 2023; 33(4): 28–30