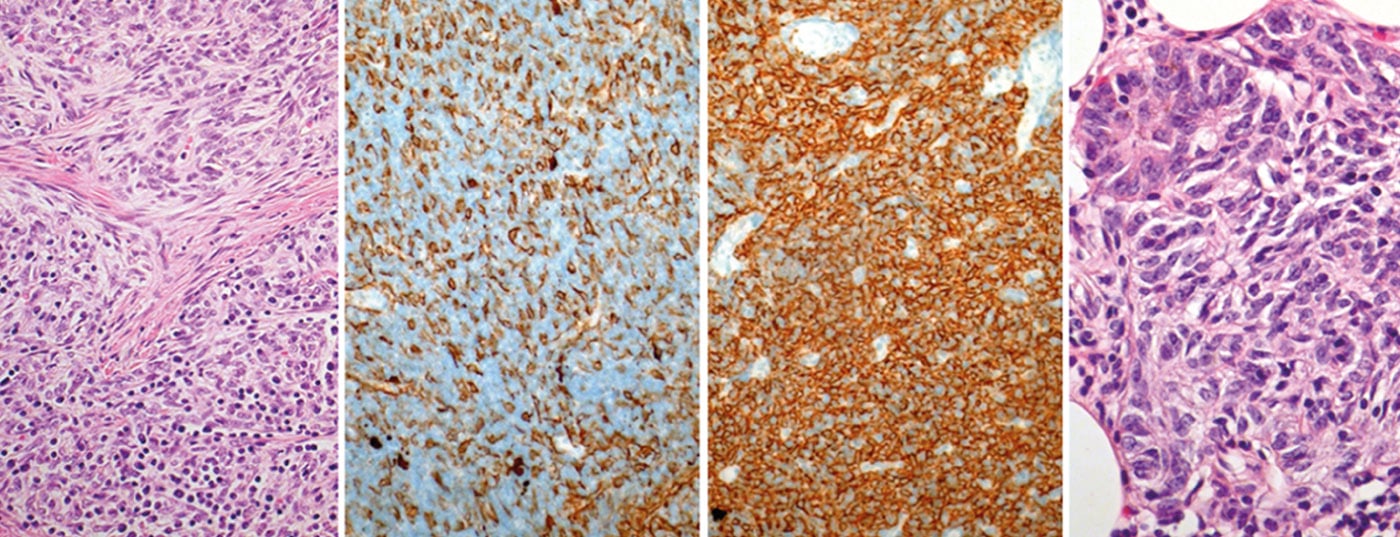
Los tumores tímicos son poco frecuentes y pertenecen a las denominadas “neoplasias huérfanas”. La incidencia anual es de alrededor de 0,15 por cada 100.000 personas. La clasificación más reciente distingue tres grandes grupos: Timomas, carcinomas tímicos y tumores neuroendocrinos del timo. Debido a su rareza, la mayor parte de los conocimientos sobre el diagnóstico y la terapia proceden de series de casos y estudios monocéntricos. No fue hasta 2010 cuando se fundó una sociedad internacional e interdisciplinar (International Thymic Malignancy Interest Group, ITMIG) para promover la colaboración mundial e iniciar la investigación científica clínica y básica sobre los tumores tímicos.
Los tumores tímicos son poco frecuentes: Su incidencia es de 0,15/100.000/año [1]. Pueden aparecer a cualquier edad, pero muestran una acumulación a la edad de 30 – 40 años para los timomas con miastenia gravis manifiesta resp. de 60-70 años sin miastenia [2]. Las mujeres y los hombres se ven afectados con la misma frecuencia. Aproximadamente un tercio de los pacientes con un timoma son asintomáticos, mientras que cerca de dos tercios de los pacientes con un carcinoma tímico o un tumor neuroendocrino del timo presentan predominantemente síntomas locales.
Presentación clínica
Los síntomas más comunes, como el dolor torácico, la tos y la dificultad para respirar, están causados por el crecimiento local. En el caso de los tumores invasivos, también puede haber un síndrome de la vena cava superior o parálisis del nervio frénico con elevación diafragmática o ronquera debido a la constricción del nervio laríngeo recurrente. Además, los tumores tímicos se asocian con frecuencia a síndromes paraneoplásicos (Tab. 1).

La miastenia grave es, con diferencia, el síndrome paraneoplásico más frecuente. Las series clínicas informan de que alrededor del 30-50% de todos los pacientes con timoma, sobre todo del tipo B2, presentan miastenia. Por el contrario, puede detectarse un timoma en el 10-15% de los pacientes con miastenia. Alrededor del 5% de los pacientes con miastenia asociada al timoma presentan otros síndromes paraneoplásicos, por ejemplo tiroiditis autoinmune, aplasia pura de eritrocitos, encefalopatía límbica, etc. La miastenia grave es mucho más rara en los carcinomas tímicos – se observa casi exclusivamente en carcinomas con un componente de timoma. Los tumores neuroendocrinos del timo se asocian ocasionalmente a endocrinopatías.
Diagnóstico
El diagnóstico de los tumores tímicos se basa en las características clínicas, las técnicas de diagnóstico por imagen y el procesamiento histopatológico de las biopsias o muestras de biopsia. resecciones o cortes congelados. El diagnóstico por imagen se centra en la tomografía computarizada (TC) como modalidad para la evaluación inicial y el seguimiento [3]. La IRM puede utilizarse para evaluar la sospecha de invasión del corazón y los grandes vasos sanguíneos [4]. La PET permite comparar la sospecha diagnóstica de hiperplasia tímica con la de un timoma o tumor tímico. de un tumor menos agresivo frente a un tumor muy agresivo. La confirmación histológica preoperatoria ha perdido parte de su importancia, ya que los métodos radiológicos más recientes tienen ahora una mayor fiabilidad diagnóstica y se pretende una resección completa de los tumores correspondientes, independientemente de la entidad exacta. En general, debe realizarse una biopsia si los hallazgos radiológicos no son claros y no puede descartarse un linfoma, o en caso de hallazgo no resecable antes de iniciar la quimioterapia de inducción o la radioquimioterapia definitiva [5].
Estadificación y clasificación histológica
El sistema de estadificación más utilizado para los timomas es la clasificación de Masoaka, revisada por última vez en 1994 (tabla 2 ) [6].

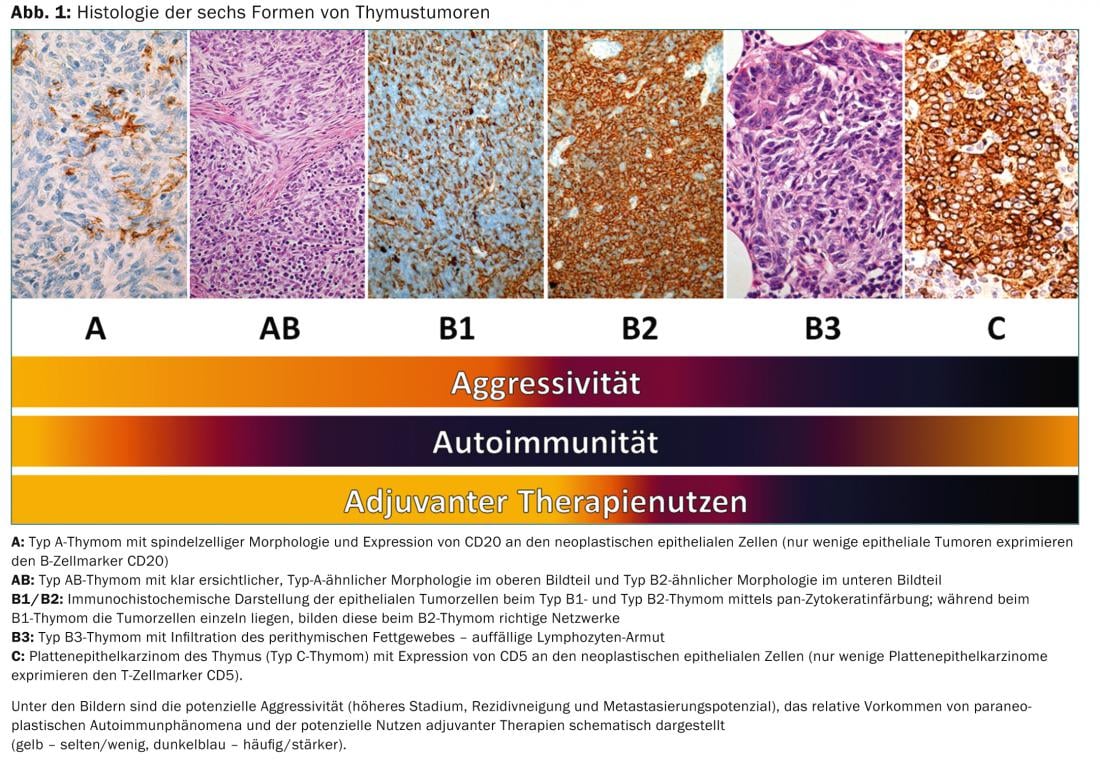
En los próximos años se establecerá un sistema de estadificación basado en el TNM. Solía haber diferentes clasificaciones para la clasificación histológica. En 1999, la OMS introdujo una clasificación histológica basada en la morfología y la relación entre los linfocitos y las células epiteliales. Esta clasificación se revisó en 2004 (Tab. 3) .
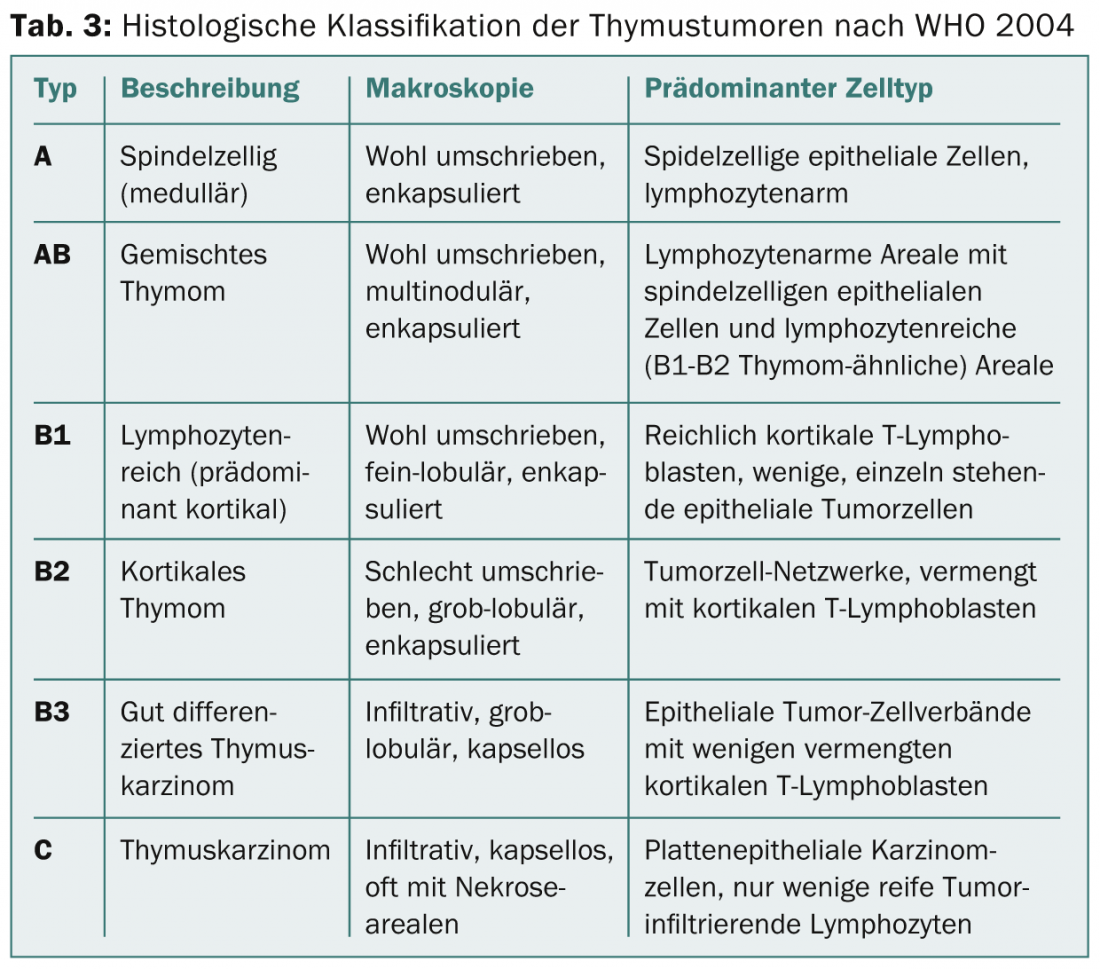
Por un lado, refleja la biología tumoral de los tumores tímicos (por ejemplo, diferente origen celular, diferente agresividad, diferente acumulación de autoinmunidad paraneoplásica), pero también tiene importancia para las decisiones terapéuticas (Fig. 1).
Terapia de los tumores tímicos
Varias series y estudios han investigado los factores pronósticos potenciales en los tumores tímicos. Los únicos factores pronósticos validados para la supervivencia y la probabilidad de recidiva son (en orden descendente de importancia) el estadio en el momento del diagnóstico, la extensión de la resección tumoral y el subtipo histológico [7,8].
Cirugía
La resección quirúrgica es la piedra angular del tratamiento y siempre debe aspirarse a una resección completa. El International Thymic Malignancy Interest Group (ITMIG) recomienda la resección en bloque con extirpación completa del timo y resección del tejido adiposo circundante debido a la posible infiltración de tejido adiposo macroscópicamente invisible. La supervivencia después de diez años depende del estadio y es del 90, 70, 55 y 35% para los estadios I, II, III y IVa, respectivamente. Las tasas de recidiva correspondientes tras la resección completa son del 3, 11, 30 y 43% [9].
Radioterapia
Los tumores tímicos tienden a recidivar localmente, de ahí la importancia de la radioterapia postoperatoria. Para la irradiación, se pretende una dosis total de 50-54 Gy.
Se recomiendan dosis más altas (hasta 60 Gy) para la resección incompleta. No se ha demostrado ningún beneficio de la radioterapia en los estadios masoaka I y II [7,10]; esto también parece ser cierto para los subtipos histológicos A, AB y B1 [11]. No obstante, en el estadio II, la radioterapia postoperatoria se realiza en muchos centros, como muestra una encuesta publicada recientemente en Europa [12]. En el estadio III, la radioterapia adyuvante se ha consolidado y también se recomienda en las directrices internacionales, a pesar de que existen pocas pruebas a su favor en los ensayos clínicos [7,13,14]. Para los pacientes inoperables en primer lugar o tras la quimioterapia de inducción, la radioterapia definitiva es una opción de tratamiento, en la que se aplica una dosis de hasta 70 Gy. La tasa de respuesta se sitúa en torno al 70% y la probabilidad de seguir con vida al cabo de cinco años es del 70-80%, lo que es comparable a la tasa de supervivencia de la resección incompleta [15,16].
Quimioterapia
La quimioterapia tiene cabida en el tratamiento primario, en la situación de recaída y en las metástasis [17]. Para los tumores principalmente no resecables en estadio III y IV, según Masoaka, la quimioterapia neoadyuvante o la radioquimioterapia combinada es la terapia de elección. En general, cabe esperar una tasa de respuesta en torno al 70% (29-100%). La resección posterior también es completamente posible en cerca del 70% de los casos [2]. En todos los estudios se investigaron las quimioterapias combinadas.
En la situación postoperatoria, el valor de la quimioterapia está menos establecido. El control local del tumor es el objetivo terapéutico más importante porque los timomas raramente metastatizan (10-15%). Por lo tanto, la radioterapia postoperatoria o, en caso necesario, la radioquimioterapia combinada (para tumores no resecables, pacientes inoperables o para tumores resecados de forma incompleta) tiene prioridad sobre la quimioterapia sola. En la situación metastásica o en el caso de recidivas no resecables y ya irradiadas, la quimioterapia puede utilizarse con intención paliativa. Suelen utilizarse quimioterapias combinadas con una antraciclina y un derivado del platino, con tasas de respuesta de entre el 50 y el 90% [18]. No existen terapias estándar probadas para los tumores refractarios al platino; diversas monosustancias y combinaciones sin platino muestran tasas de respuesta del 20-40% [19]. La terapia local (cirugía / radioterapia) también es importante para el control de los síntomas en los tumores localmente avanzados o en presencia de metástasis.
Terapias dirigidas
En los últimos años, al igual que en otros tumores sólidos, se han investigado cada vez más las terapias dirigidas en los tumores tímicos [19]. Se encuentra una elevada expresión de receptores de somatostatina en aproximadamente la mitad de los tumores tímicos. Estos pacientes parecen beneficiarse de la terapia dirigida con octreotida, con mayor beneficio en los timomas que en los carcinomas tímicos.
La sobreexpresión de la tirosina quinasa c-KIT está presente en aproximadamente el 2% de los timomas y el 80% de los carcinomas tímicos. Las mutaciones activadoras, como las que se encuentran en los tumores del estroma gastrointestinal (GIST), rara vez se dan en los tumores tímicos. La terapia con el inhibidor multicinasa imatinib (Gleevec®), dirigido contra c-KIT entre otras dianas, condujo a la estabilización de la enfermedad en tumores avanzados, especialmente en aquellos con mutaciones en c-KIT.
En el 70% de los timomas y alrededor del 50% de los carcinomas tímicos, el receptor del factor de crecimiento epitelial (EGFR) está sobreexpresado. Sin embargo, las mutaciones activadoras, tal y como se producen en el adenocarcinoma de pulmón, son poco frecuentes. La terapia con inhibidores de la tirosina quinasa EGFR sólo ha mostrado un beneficio modesto. El anticuerpo EGFR cetuximab se está investigando actualmente en un ensayo clínico.
Al igual que en otros tumores, la neoangiogénesis también desempeña un papel en los tumores tímicos. Las sustancias antiangiogénicas (bevacizumab, sunitinib) fueron capaces de inducir una respuesta tumoral en pequeños estudios. El receptor 1 del factor de crecimiento similar a la insulina (IGFR-1) se sobreexpresa en aproximadamente el 20% de los tumores tímicos. La terapia con el anticuerpo IGFR-1 cixutumumab condujo a una alta tasa de estabilización de la enfermedad.
Mensajes para llevar a casa
- Los tumores tímicos son enfermedades raras del mediastino anterior y se dividen en timomas con diferentes subgrupos histológicos, carcinomas tímicos y tumores neuroendocrinos del timo.
- Los timomas se asocian a menudo con síndromes paraneoplásicos, entre los que destaca con mayor frecuencia la miastenia gravis, mientras que los carcinomas tímicos y los tumores neuroendocrinos del timo se manifiestan con mayor frecuencia por síntomas locales.
- La base del tratamiento es la resección quirúrgica completa; dependiendo del estadio y posiblemente del subtipo, puede valorarse la radioterapia postoperatoria.
- La quimioterapia se utiliza para los tumores localmente avanzados (si es necesario en combinación con la radiación) como terapia de inducción antes de la cirugía programada.
- En caso de tumores inoperables o recidivas locales, se administra radioquimioterapia.
- En los tumores metastásicos, la quimioterapia combinada con una antraciclina y una sustancia que contenga platino puede dar lugar a una tasa de respuesta elevada.
- En el futuro, la mejor comprensión biológica molecular de los tumores tímicos permitirá una terapia dirigida a determinados subgrupos.
Literatura:
- Engels EA, Pfeiffer RM: Timoma maligno en Estados Unidos: patrones demográficos en la incidencia y asociaciones con neoplasias subsiguientes. Int J Cancer 2003; 105(4): 546-551. doi:10.1002/ijc.11099.
- Venuta F, et al:Timoma y carcinoma tímico.Eur J Cardiothorac Surg 2010; 37(1): 13-25. doi:10.1016/j.ejcts.2009.05.038.
- Marom EM: Avances en la obtención de imágenes de timomas. J Thorac Imaging 2013; 28(2): 69-80. Cuestionario 81-83. doi:10.1097/RTI.0b013e31828609a0.
- Sadohara J, et al.: Tumores epiteliales tímicos: comparación de los hallazgos en TC y RM de timomas de bajo riesgo, timomas de alto riesgo y carcinomas tímicos. Eur J Radiol 2006; 60(1): 70-79. doi:10.1016/j.ejrad.2006.05.003.
- Detterbeck FC, Parsons AM: Tumores tímicos. Ann Thorac Surg 2004; 77(5): 1860-1869. doi:10.1016/j.athoracsur.2003.10.001.
- Koga K, et al: Revisión de 79 timomas: modificación del sistema de estadificación y reevaluación de la división convencional en timoma invasivo y no invasivo. Pathol Int 1994; 44(5): 359-367. www.ncbi.nlm.nih.gov/pubmed/8044305. Consultado el 2 de diciembre de 2014.
- Kondo K, Monden Y: Terapia de los tumores epiteliales tímicos: estudio clínico de 1.320 pacientes de Japón. Ann Thorac Surg 2003; 76(3): 878-884; discusión 884-885. www.ncbi.nlm.nih.gov/pubmed/12963221. Consultado el 2 de diciembre de 2014.
- Ströbel P, et al.: Recidiva tumoral y supervivencia en pacientes tratados por timomas y carcinomas tímicos de células escamosas: un análisis retrospectivo. J Clin Oncol 2004; 22(8): 1501-1509. doi:10.1200/JCO.2004.10.113.
- Koppitz H, et al: Clasificación actualizada y tratamiento multimodal del timoma maligno. Cancer Treat Rev 2012; 38(5): 540-548. doi:10.1016/j.ctrv.2011.11.010.
- Ruffini E, et al: Recurrencia del timoma: análisis de las características clinicopatológicas, el tratamiento y los resultados. J Thorac Cardiovasc Surg 1997; 113(1): 55-63. www.ncbi.nlm.nih.gov/pubmed/9011702. Consultado el 2 de diciembre de 2014.
- Chen G, et al: La nueva clasificación histológica de la OMS predice el pronóstico de los tumores epiteliales tímicos: un estudio clinicopatológico de 200 casos de timoma de China. Cáncer 2002; 95(2): 420-429. doi:10.1002/cncr.10665.
- Ruffini E, et al: Tratamiento de los tumores tímicos: encuesta sobre la práctica actual entre los miembros de la Sociedad Europea de Cirujanos Torácicos. J Thorac Oncol 2011; 6(3): 614-623. doi:10.1097/JTO.0b013e318207cd74.
- Korst RJ, et al: Radioterapia adyuvante para tumores epiteliales tímicos: una revisión sistemática y metaanálisis. Ann Thorac Surg 2009; 87(5): 1641-1647. doi:10.1016/j.athoracsur.2008.11.022.
- Forquer JA, et al.: Radioterapia postoperatoria tras la resección quirúrgica del timoma: papeles diferentes en la enfermedad localizada y regional. Int J Radiat Oncol Biol Phys 2010; 76(2): 440-445. doi:10.1016/j.ijrobp.2009.02.016.
- Loehrer PJ, et al: Cisplatino, doxorrubicina y ciclofosfamida más radioterapia torácica para el timoma irresecable en estadio limitado: un ensayo intergrupos. J Clin Oncol 1997; 15(9): 3093-3099. www.ncbi.nlm.nih.gov/pubmed/9294472. Consultado el 2 de diciembre de 2014.
- Girard N, Mornex F: El papel de la radioterapia en el tratamiento de los tumores tímicos. Thorac Surg Clin 2011; 21(1): 99-105, vii. doi:10.1016/j.thorsurg.2010.08.011.
- Girard N, et al: Definiciones y políticas de quimioterapia para las neoplasias tímicas. J Thorac Oncol 2011; 6(7 Suppl 3): S1749–1755. doi:10.1097/JTO.0b013e31821ea5f7.
- Girard N: Timoma: de la quimioterapia a la terapia dirigida. Am Soc Clin Oncol Educ Book 2012: 475-479. doi:10.14694/EdBook_AM.2012.32.475.
- Berardi R, et al: Neoplasias tímicas: actualización sobre el uso de la quimioterapia y las nuevas terapias dirigidas. Una revisión bibliográfica. Cancer Treat Rev 2014; 40(4): 495-506. doi:10.1016/j.ctrv.2013.11.003.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(2): 16-20