La trombocitemia esencial suele aparecer después de los 50 años, aunque también hay afectados menores de 40 años. Pueden distinguirse varios subtipos basándose en análisis genéticos moleculares. Las complicaciones típicas de la enfermedad son las trombosis y las hemorragias. La estratificación del riesgo es necesaria para proporcionar a los pacientes el tratamiento adecuado a tiempo. En la actualidad existen varios modelos de pronóstico que se han probado en estudios de cohortes a gran escala.
Las neoplasias mieloproliferativas (NMP) son enfermedades de las células madre hematopoyéticas y presentan un espectro diverso de manifestaciones clínicas y anomalías moleculares [1,2]. La trombocitemia esencial (TE) es una NMP que se origina a partir de una célula madre hematopoyética. Se encuentra una mutación JAK2 en aproximadamente la mitad de los pacientes con TE, con menor frecuencia hay una mutación en el gen CALR o MPL y en el 10–15% de todos los pacientes con TE no se detecta ninguna de estas mutaciones. Aunque el TE se considera el NMP más indolente, se asocia a síntomas vasomotores angustiosos y a complicaciones potencialmente mortales como trombosis, hemorragias y progresión de la enfermedad a mielofibrosis y neoplasias mieloides agresivas [3]. La evaluación pronóstica del riesgo es importante para una intervención oportuna adaptada al riesgo con las opciones de tratamiento disponibles. Sin embargo, la predicción del riesgo es difícil, ya que se trata de una enfermedad crónica poco frecuente y clínicamente heterogénea [4].
Se han desarrollado varios modelos de pronóstico para evaluar el riesgo de trombosis y la supervivencia global (SG) en la TE. La mayoría de los sistemas de pronóstico para identificar a los pacientes con riesgo de trombosis y hemorragia se basan en la identificación de factores de riesgo como complicaciones tromboembólicas o hemorragia grave, edad ≥60 años, plaquetas ≥1,5 millones/µl [5]. El IPSET (International Prognostic Score for Thrombosis in Essential Thrombocythemia) y el IPSET-Survival también tienen en cuenta los factores de riesgo cardiovascular y la presencia de una mutación JAK2 V617F [6–8].
Los pacientes con una mutación CALR muestran un menor riesgo de trombosis en comparación con los pacientes con una mutación JAK2 [9]. En el actual modelo de pronóstico “Triple-AAA” para la supervivencia global, la edad, el recuento absoluto de neutrófilos (CNA) y el recuento absoluto de linfocitos (CLA) se utilizan para la estratificación del riesgo en el TE [10]. Incluso las “mutaciones no impulsoras” pueden influir en el pronóstico y se utilizan, por ejemplo, en el MIPSS-ET (sistema pronóstico internacional mejorado por mutaciones para la trombocitopenia esencial) [11].
¿Cuáles son los factores de riesgo más importantes?
Recientemente, investigadores de la Clínica Mayo de EE.UU. (Gangat et al.) y del Centro de Investigación e Innovación de Neoplasias Mieloproliferativas con sede en Italia (Loscocco et al.) publicaron dos grandes cohortes retrospectivas de TE [12,13]. Ambos estudios confirmaron los factores de riesgo previamente identificados de trombosis, progresión y/o muerte en el TE, entre los que se incluyen los siguientes:
- una edad más avanzada (edad ≥60 años),
- género masculino,
- >un aumento del recuento de glóbulos blancos (WBC 11 ×109/L),
- Un aumento del recuento absoluto de neutrófilos (ANC ≥8 ×109/L),
- <Un recuento absoluto de linfocitos bajo (ALC 1,7 ×109/L) en el momento de la presentación.
Erdos et al. analizaron estos parámetros y los modelos de riesgo actuales en una cohorte de 328 pacientes adultos con TE tratados en el Weill Cornell Medicine de Nueva York (EE.UU.) durante un periodo medio de 6 años [14]. Esta cohorte se definió estrictamente según los criterios diagnósticos de la Organización Mundial de la Salud de 2022, de modo que se realizó una biopsia de médula ósea diagnóstica en todos los pacientes y se excluyeron cuidadosamente los diagnósticos alternativos [15]. Como Gangat et al. [12] y Loscocco et al. [13] Erdos et al. también descubrieron que los pacientes con TE con mutación JAK2 tenían una supervivencia libre de trombosis (SLT) significativamente más corta en comparación con los pacientes con TE con mutación CALR. Se produjeron un total de 33 trombosis (15 venosas, 18 arteriales), de las cuales 27 (12 venosas, 15 arteriales) afectaron a pacientes con mutación JAK2. En los modelos multivariables, el mayor riesgo de trombosis en el TE con mutación JAK2 en comparación con el CALR/MPL se debió principalmente a acontecimientos trombóticos venosos. De forma similar al CRIMM, se observó que el IPSET discriminaba la SLT principalmente entre TE de muy bajo y alto riesgo, mientras que la SLT discriminaba mal entre grupos intermedios, con un área bajo la curva (AUC) de la curva receiver operating characteristic (ROC ) de sólo 0,63.
Conclusión de varios estudios independientes
El estudio de Erdos et al. publicado en 2023 es coherente con los principales hallazgos de las dos grandes cohortes de Gangat et al. y Loscocco et al. y confirma que el riesgo a largo plazo de acontecimientos relacionados con la TE puede estratificarse basándose en información clínica fácilmente disponible como la edad, las mutaciones del conductor y el hemograma [12–15].
En conjunto, estos estudios independientes demuestran lo siguiente:
- La ET con mutación JAK2 se asocia a un mayor riesgo de trombosis en comparación con otros tipos de ET
- Los eventos trombóticos ocurren raramente en pacientes con ET con mutación CALR
- Las mutaciones CALR y MPL aumentan significativamente el riesgo de progresión de la mielofibrosis
- la mutación del conductor no es pronóstico para la SG
- la puntuación de trombosis IPSET revisada estratifica el riesgo de trombosis a largo plazo muy bajo y alto, pero obtiene peores resultados en general que los datos reales
- El AAA y, en menor medida, la supervivencia IPSET son pronósticos de la supervivencia global (SG), siendo la edad la que más influye en el riesgo.
En resumen, estos estudios subrayan la necesidad de modelos dinámicos de trombosis, progresión y supervivencia en la TE que incluyan factores modificables a los que pueda dirigirse la reducción del riesgo.
Objetivo terapéutico primario: profilaxis de la trombosis adaptada al riesgo
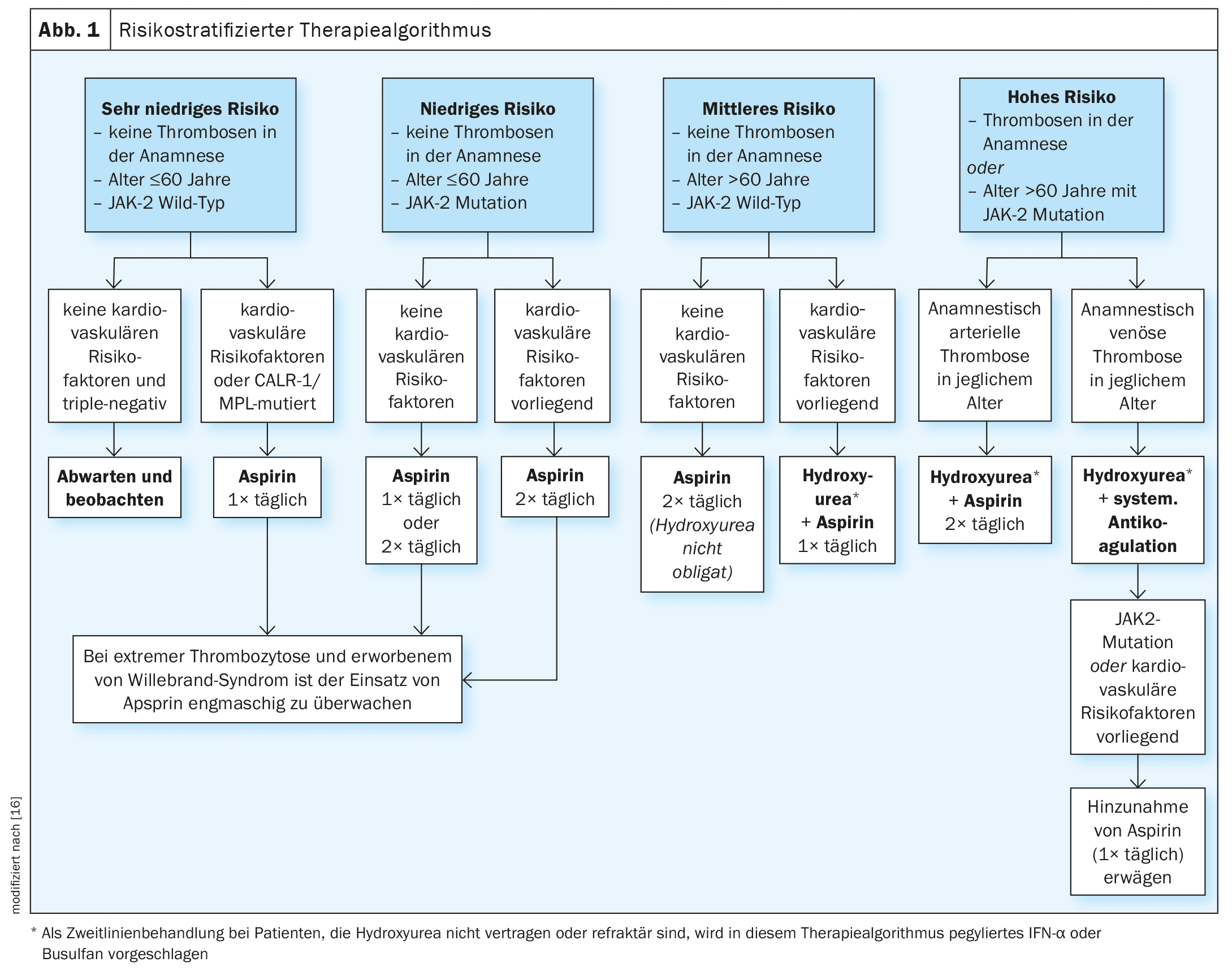
Actualmente no existe una terapia curativa para la ET. Los principales objetivos del tratamiento son reducir los síntomas y complicaciones relacionados con la enfermedad y disminuir el riesgo de tromboembolia y los factores de riesgo cardiovascular. Una publicación de Tefferi et al. publicada en 2024 esboza una estrategia de tratamiento estratificada por riesgos para la TE (Fig. 1), que se clasifica en cuatro niveles de riesgo [16].
- Muy bajo (edad ≤60 años, sin antecedentes de trombosis, tipo JAK2 salvaje)
- bajo (como muy bajo, pero mutación JAK2 presente)
- media (edad >60 años, sin antecedentes de trombosis, tipo JAK2 salvaje)
- alta (antecedentes de trombosis o edad >60 años con mutación JAK2).
El riesgo de trombosis en pacientes con un riesgo muy bajo y un estado de mutación triple negativo es demasiado bajo para justificar cualquier forma de terapia. Sin embargo, en presencia de factores de riesgo cardiovascular o mutaciones CALR/MPL, se recomienda el uso de ácido acetilsalicílico (aspirina, una vez al día) [12,13]. En pacientes de bajo riesgo, la aspirina se recomienda tanto en ausencia como en presencia de factores de riesgo cardiovascular. Para los pacientes de riesgo intermedio, actualmente se recomienda la aspirina dos veces al día, aunque la combinación de un fármaco citorreductor (hidroxiurea) con aspirina una vez al día ha demostrado ser eficaz en pacientes de riesgo intermedio con factores de riesgo cardiovascular. Se trata de recomendaciones de tratamiento basadas en pruebas. En la cohorte de la Clínica Mayo, la aspirina tuvo un efecto favorable sobre los episodios trombóticos arteriales y venosos, mientras que se observaron efectos protectores similares para el tratamiento citorreductor en la cohorte de Florencia [12,13]. En pacientes con tendencia hemorrágica, el uso de aspirina debe vigilarse estrechamente o aclararse hematológicamente.
Congreso: EHA2024
Literatura:
- Onkopedia: Neoplasias mieloproliferativas, www.onkopedia.com/de/onkopedia/guidelines/myeloproliferative-neoplasien-mpn-frueher-chronische-myeloproliferative-erkrankungen-cmpe/@@guideline/html/index.html, (última consulta: 22 de octubre de 2024).
- Mahmud M, et al: Neoplasias mieloproliferativas: revisión contemporánea y panorama molecular. Int J Mol Sci 2023; 24(24): 17383.
- Abu-Zeinah G, et al: ¿Son predecibles la trombosis, la progresión y la supervivencia en el TE? Blood Cancer J 2024; 14: 103, https://doi.org/10.1038/s41408-024-01079-7.
- Tefferi A, et al: Supervivencia a largo plazo y transformación blástica en la trombocitemia esencial, la policitemia vera y la mielofibrosis anotadas molecularmente. Blood 2014; 124: 2507-2513.
- “Trombocitemia esencial”, www.mll.com/myeloproliferative-neoplasien-mpn/essentielle-thrombozythaemie-et,(último acceso 22.10.2024)
- Barbui T, et al: Desarrollo y validación de una puntuación pronóstica internacional de trombosis en la trombocitemia esencial de la Organización Mundial de la Salud (IPSET-trombosis). Blood 2012; 120(26): 5128-5133.
- Haider M, et al: Validación de la puntuación pronóstica internacional revisada de trombosis para la trombocitemia esencial (IPSET-trombosis) en 585 pacientes de la Clínica Mayo. Am J Hematol 2016; 91(4): 390-394.
- Barbui T, et al: Practice-relevant revision of IPSET-thrombosis based on 1019 patients with WHO-defined essential thrombocythemia. Blood Cancer J 2015; 5: e369-e36.
- Torregrosa JM et al: El deterioro de la activación leucocitaria subyace al menor riesgo trombótico de los pacientes con trombocitopenia esencial con mutaciones CALR en comparación con los que presentan la mutación JAK2. Br J Haematol 2016; 172(5): 813-815.
- Tefferi A et al: Modelo de riesgo “triple A” aplicable globalmente para la trombocitemia esencial basado en la edad, el recuento absoluto de neutrófilos y el recuento absoluto de linfocitos. Am J Hematol 2023; 98(12): 1829-1837.
- Tefferi A, et al: Sistemas pronósticos internacionales mejorados por mutaciones para la trombocitemia esencial y la policitemia vera. Br J Haematol 2020; 189: 291-302.
- Gangat N, et al: Mil pacientes con trombocitemia esencial: la experiencia de la Clínica Mayo. Blood Cancer J 2024; 14: 1-11.
- Loscocco GG, et al: Mil pacientes con trombocitemia esencial: la experiencia Florence-CRIMM. Blood Cancer J 2024; 14: 1-12.
- 14 Erdos K, et al: Las mutaciones CALR de bajo riesgo de trombosis confieren un mayor riesgo de progresión de la trombocitemia esencial. Blood 2023; 142: 1819-1819.
- Abu-Zeinah G, et al: El interferón alfa para el tratamiento de la policitemia vera produce una mejora de la supervivencia libre de mielofibrosis y de la supervivencia global. Leucemia 2021; 35: 2592-2601.
- Tefferi A, Vannucchi AM, Barbui T: Trombocitemia esencial: actualización 2024 sobre diagnóstico, estratificación del riesgo y tratamiento. Am J Hematol 2024; 99(4): 697-718.
HAUSARZT PRAXIS 2024; 19(11): 32-33 (publicado el 22.11.24, antes de impresión)