En los pacientes con asma insuficientemente controlada bajo terapia inhalatoria máxima, debe cuestionarse críticamente si el diagnóstico de asma está realmente presente y si se están aplicando adecuadamente todas las medidas de tratamiento. Si es así, es importante centrarse en los productos biológicos disponibles para el tratamiento del asma grave. La determinación de biomarcadores puede ayudar a seleccionar la clase de sustancia más adecuada en cada caso.
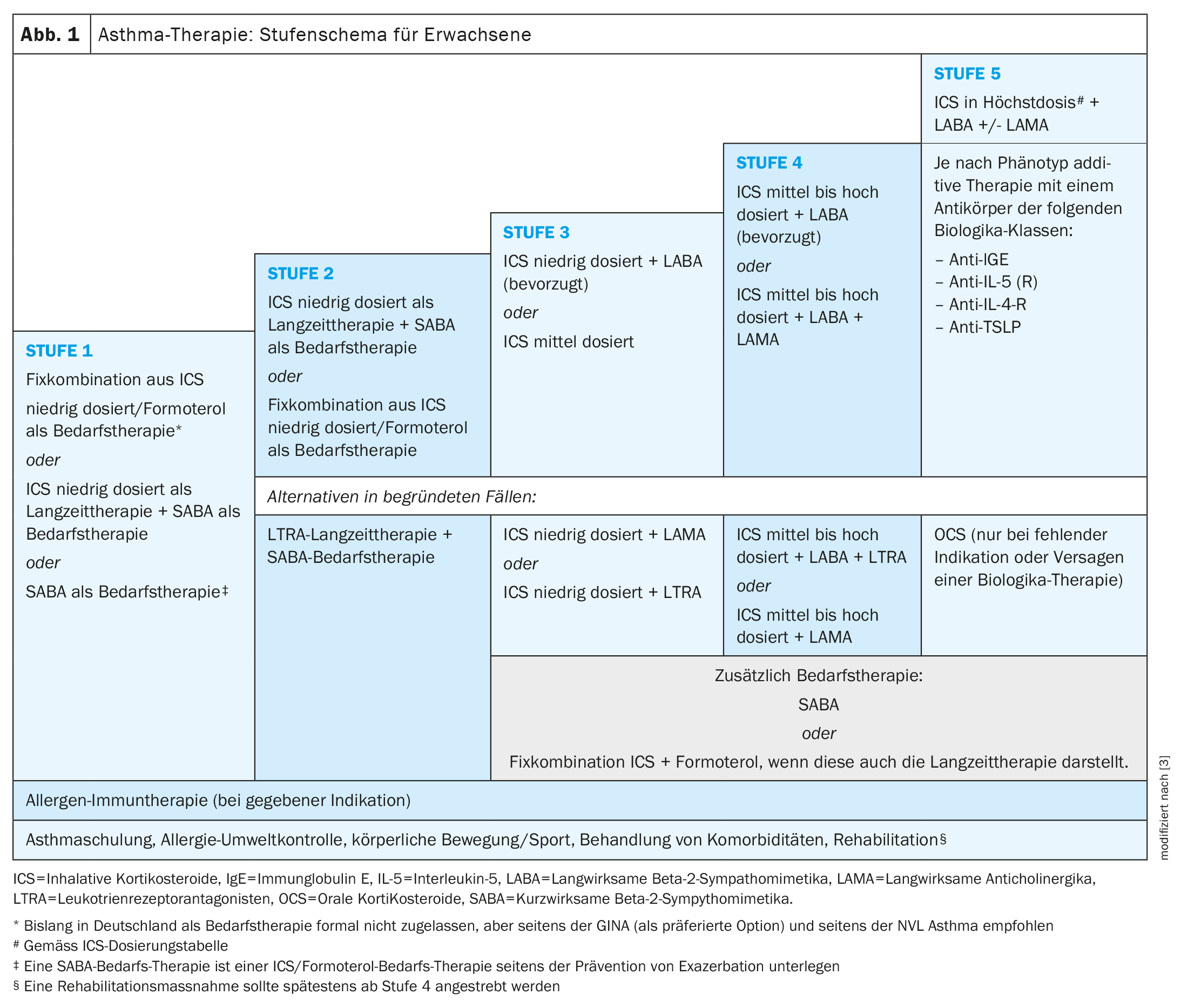
El asma suele aparecer en la infancia y la adolescencia, pero también puede manifestarse por primera vez en la edad adulta [1]. “El asma de inicio en la edad adulta tiende a ser más grave y a presentar tasas de exacerbación más elevadas, informó el Prof. Christophe von Garnier, MD, Médico Jefe del Departamento de Neumología del Hospital Universitario de Lausana (CHUV) [2–4]. “El asma de inicio en la edad adulta se asocia con menor frecuencia a las alergias, pero con mayor frecuencia a la rinosinusitis crónica con pólipos nasales (RSCPN) y otras comorbilidades. “El asma de aparición precoz suele corresponder al asma alérgica clásica. Se utilizan medicamentos a largo plazo y a demanda para controlar los síntomas del asma según el esquema escalonado (Fig. 1). Según la nueva definición de la GINA**, el asma se considera grave si resulta refractaria a la triple terapia inhalada máxima (CSI en dosis máxima y LABA más posiblemente LAMA) [5]. Si, por ejemplo, no se consigue un control suficiente de la enfermedad en un periodo de un mes con la terapia de inhalación máxima, deberán realizarse primero diversas investigaciones:
- ¿Es realmente asma o se trata en cambio de EPOC, por ejemplo?
- ¿Pone en práctica el paciente las medidas de tratamiento propuestas?
- ¿Se está utilizando la técnica de inhalación correcta?
- ¿Existen desencadenantes del asma evitables (por ejemplo, alérgenos)?
- ¿Existen comorbilidades no tratadas?
Si se concluye que el asma es realmente grave, el siguiente paso será probar el tratamiento con biológicos específicos del fenotipo como opción terapéutica añadida [2,3]. El objetivo a largo plazo es lograr y mantener la remisión del asma, es decir, un asma bien controlada a largo plazo.
** Directrices de la Iniciativa Global para el Asma (GINA) 2022
Eosinófilos en sangre y FeNO como biomarcadores
Los procesos inflamatorios subyacentes al asma grave son complejos, heterogéneos y dinámicos [6]. La diátesis atópica es el factor que más predispone al desarrollo del asma identificado hasta la fecha. Sin embargo, en el 30-50 % de los adultos con asma, las alergias a los alérgenos ambientales no son detectables ni por los antecedentes ni por las pruebas cutáneas o la determinación de IgE específica en suero, por lo que esta forma también se denomina asma no alérgica o intrínseca [3]. El asma alérgica y no alérgica se resumen en la literatura bajo el término genérico de asma “tipo 2” o “tipo 2-alto” [7]. Esto se basa en la constatación de que ciertas citocinas pueden ser liberadas no sólo por las células T helper específicas de alérgenos (células Th2) del sistema inmunitario adaptativo, sino también por las células ILC2 no específicas de alérgenos del sistema inmunitario innato, y dar lugar a patrones inflamatorios similares.
Los biomarcadores de tipo 2 incluyen los eosinófilos en sangre y el FeNO [3,8,9]. Para poder acotar el fenotipo, las recomendaciones de la GINA aconsejan medir estos dos biomarcadores al menos tres veces, ya que están sujetos a fuertes fluctuaciones individuales. Por ejemplo, el número de eosinófilos en sangre está influido por el momento del último contacto con alérgenos y la época del año, y los niveles de FeNO están influidos por las infecciones o la exposición a contaminantes [3,10]. Además, ambos biomarcadores se ven influidos significativamente por las terapias con CSI y CSO [3,11,12].
Una eosinofilia elevada provoca daños en el tejido pulmonar, hiperreactividad y remodelación de las vías respiratorias debido a la activación de las células eosinófilas [13]. El diagnóstico de asma eosinofílica grave requiere al menos dos detecciones de más de 300 eosinófilos/µl en sangre fuera de las exacerbaciones y sin medicación con corticosteroides sistémicos.
Biológicos como terapia añadida de mantenimiento
Las sustancias activas con interleucinas (anti-IL-5-(R), anti-IL-4-R) o IgE como diana se dirigen a la vía inflamatoria de tipo 2. La eosinofilia en sangre (≥300 células/μl) se considera un factor predictivo de la respuesta a los anticuerpos monoclonales contra la IL-5 (mepolizumab, reslizumab) o contra la IL-5-R (benralizumab) [20]. La eosinofilia en sangre (≥300 células/μl) o una concentración de FeNO >25 ppb también son factores predictivos de una respuesta al tratamiento con el anticuerpo anti-IL4R dupilumab. Por otro lado, los pacientes con asma alérgica grave y niveles elevados de IgE tienen más probabilidades de responder al omalizumab. Si el valor basal de IgE es inferior a 76 U.I./ml, es menos probable que se produzca un beneficio clínico del anticuerpo anti-IgE [19]. El anticuerpo monoclonal tezepelumab, que se autorizará en Suiza en 2022, tiene un modo de acción diferente al de las sustancias mencionadas. La diana de este biológico es la TSLP (linfopoyetina del estroma tímico). Al unirse a la TSLP, el tezepelumab impide su interacción con el receptor heterodimérico de la TSLP. La TSLP es una citocina de la familia de las alarminas que liberan principalmente las células epiteliales en respuesta a diversos estímulos (por ejemplo, virus, alérgenos y contaminantes), está implicada en la cascada inflamatoria del asma y desempeña un papel en el inicio y la persistencia de la inflamación asmática de las vías respiratorias [15]. En el asma, tanto los desencadenantes alérgicos como los no alérgicos inducen la producción de TSLP. El bloqueo del TSLP con tezepelumab afecta a un amplio espectro de biomarcadores y citocinas asociados a la inflamación (por ejemplo, eosinófilos en sangre, IgE, FeNO, IL-5 e IL-13) [15–17]. En consecuencia, la TSLP desempeña un importante papel patogenético en varios subtipos de asma [16,17]. Un artículo de revisión publicado en 2022 demostró que el tezepelumab es una opción de tratamiento adecuada para el asma grave no controlada y <1500 eosinófilos/μl independientemente del FeNO y del estado alérgico [18]. Además, el tezepelumab demostró reducir la tasa de exacerbación en pacientes con asma grave no controlada, independientemente del recuento de eosinófilos al inicio del estudio.
Congreso: Actualización en alergia e inmunología
Literatura:
- Akar-Ghibril N, et al: Endotipos alérgicos y fenotipos del asma. J Allergy Clin Immunol Pract 2020; 8(2): 429-440.
- “Cómo reconocer y tratar el asma grave (Th2)”, Prof. Dr. Christophe von Garnier, Allergy & Immunology Update, Grindelwald, 27.01.2024.
- Lommatzsch M, et al: S2k guideline for the specialist diagnosis and treatment of asthma 2023, Sociedad Alemana de Neumología y Medicina Respiratoria e.V. (ed.), https://register.awmf.org,(última consulta: 07.03.2024)
- Baan EJ, et al: Caracterización del asma según la edad de inicio: un estudio de cohortes con múltiples bases de datos. J Allergy Clin Immunol Pract 2022; 10: 1825-1834.e1828.
- Iniciativa Global para el Asma (GINA), 2022, www.ginasthma.com,(último acceso 07/03/2024)
- Busse WW: Tratamientos biológicos para el asma grave: Un gran avance en el cuidado del asma. Allergol Int 2019; 68(2): 158-166.
- Hinks TSC, Levine SJ, Brusselle GG: Opciones de tratamiento en el asma de tipo 2 bajo. Eur Respir J 2021; 57(1).
- Hammad H, Lambrecht BN: La inmunología básica del asma. Cell 2021; 184: 1469-1485.
- Lommatzsch M: Modulación inmunitaria en el asma: conceptos actuales y estrategias futuras. Respiración 2020; 99: 566-576.
- Chipps BE, et al: Un análisis exhaustivo de la estabilidad de los niveles de eosinófilos en sangre. Ann Am Thorac Soc 2021; 18: 1978-1987.
- Lommatzsch M, et al: Impacto de un aumento de la dosis de corticosteroides inhalados en los eosinófilos sanguíneos en el asma. Thorax 2019; 74: 417-418.
- Jackson DJ, et al: Caracterización de los pacientes con asma grave en el Registro de Asma Grave del Reino Unido en la era biológica. Thorax 2021; 76: 220-227.
- Patterson MF, Borish L, Kennedy JL: Pasado, presente y futuro de los anticuerpos monoclonales contra la IL-5 y el asma eosinofílica: una revisión. J Asma Alergia 2015; 8: 125-134.
- Berry M, et al: Características patológicas y respuesta a los corticosteroides inhalados del asma eosinofílica y no eosinofílica. Thorax 2007; 62: 1043-1049.
- Compendio suizo de medicamentos,
https://compendium.ch,(último acceso 07/03/2024) - Menzies-Gow A, Wechsler ME, Brightling CE: Necesidad insatisfecha en el asma grave no controlada: ¿puede la terapia antiTSLP con tezepelumab proporcionar una nueva y valiosa opción de tratamiento? Investigación respiratoria 2020; 21(1): 268.
- Gauvreau GM, et al: Linfopoyetina del estroma tímico: su papel y potencial como diana terapéutica en el asma. Opinión experta sobre dianas terapéuticas 2020; 24(8): 777-792.
- Brusselle GG, Koppelman GH: Terapias biológicas para el asma grave. The New England journal of medicine 2022; 386(2): 157-171.
- Omalizumab, https://ec.europa.eu/health/documents/community-register/2022/20221014157073/anx_157073_de.pdf,(último acceso 07/03/2024)
- Mepolizumab, reslizumab y benralizumab, www.leitlinien.de/themen/asthma/4-auflage/kapitel-4,(última consulta: 07/03/2024).
HAUSARZT PRAXIS 2024; 19(3): 26-28 (publicado el 20.3.24, antes de impresión)