La diabetes de tipo 1 es la enfermedad metabólica más común en niños y adolescentes. Hoy en día, esta enfermedad autoinmune puede diagnosticarse mucho antes de la manifestación clínica. Esto permite disponer de una “ventana de oportunidad” para poder intervenir terapéuticamente antes de que se produzca una pérdida elevada de células beta productoras de insulina y se produzca la cetoacidosis causada por los desequilibrios metabólicos.
Se está observando un aumento de nuevos casos de diabetes tanto a nivel internacional como en Suiza. En el estudio nacional SOPHYA, 3 de los 1.500 sujetos del grupo de edad de 6 a 16 años tenían un diagnóstico de diabetes, lo que corresponde a una frecuencia de 200:100.000 niños y adolescentes en Suiza [1]. La incidencia de la diabetes tipo 1 (DMT1) en Alemania, al igual que en muchos otros países, ha aumentado significativamente a lo largo de los años: mientras que era de 7,9 por 100.000 en el grupo de edad de 0 a 15 años en 1991-1993, se duplicó hasta alcanzar los 13,3 por 100.000 en 2009-2013 [2]. El reconocimiento precoz de los precursores de la T1D es un requisito previo para adoptar medidas terapéuticas preventivas y evitar una cetoacidosis potencialmente mortal. El Prof. Dr. Michael Hummel, del Centro Helmholtz de Múnich, presentó los últimos hallazgos sobre el cribado y la prevención de la T1D en la edición de este año del congreso “Diabetologie grenzenlos” [3].
Conclusiones de estudios prospectivos de cohortes de nacimientos
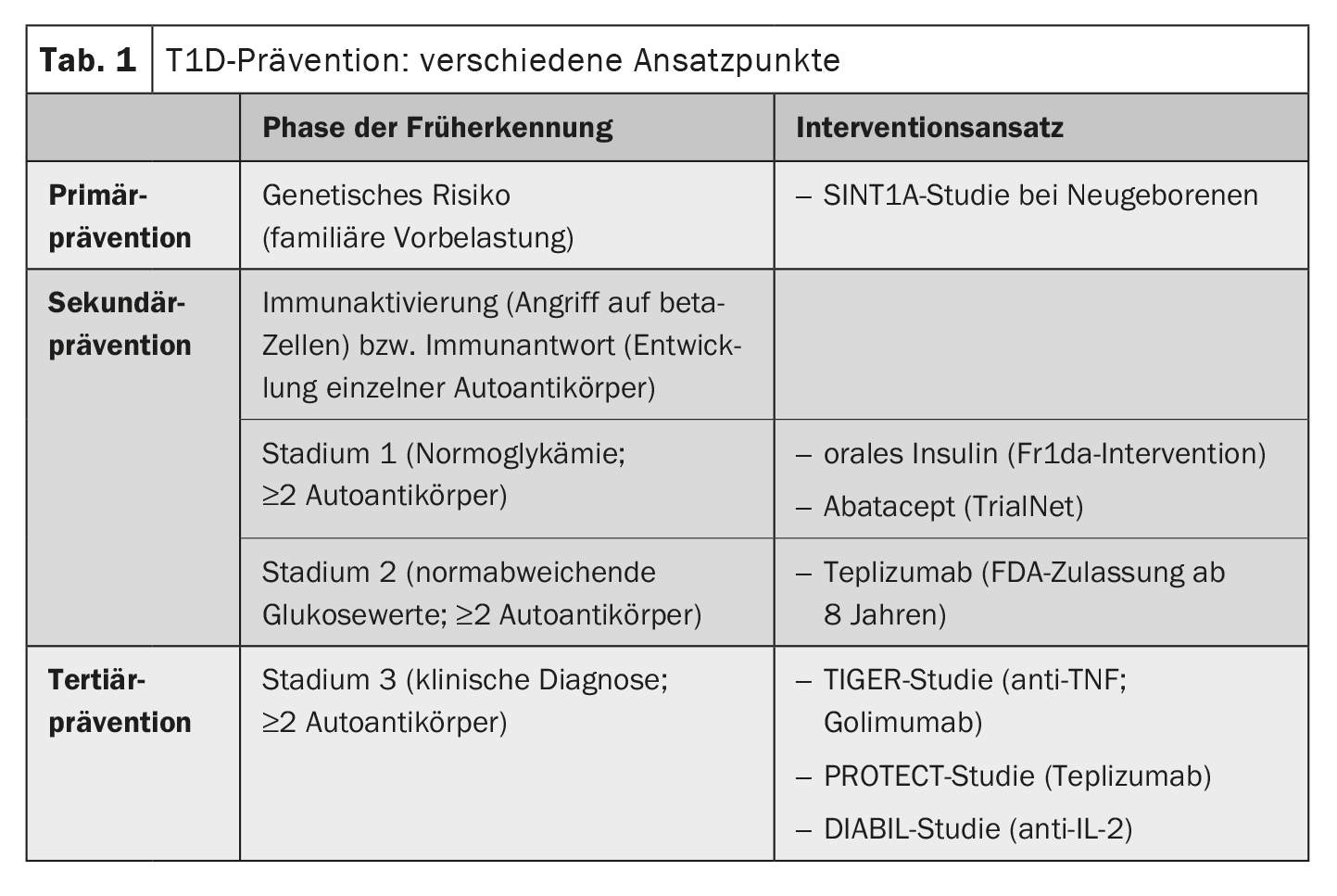
Existen numerosos enfoques diferentes para la prevención de la T1D. “Hay tres momentos potenciales en los que se puede intervenir”, afirma el profesor Hummel [3]. Se trata de la prevención terciaria, la prevención secundaria y la prevención primaria. La mayoría de las intervenciones se están investigando actualmente en ensayos (Tabla 1). En EE.UU., el teplizumab ya ha sido autorizado para el tratamiento de un estadio preliminar de la T1D en niños prediabéticos a partir de los 8 años [3,4]. El teplizumab es un anticuerpo monoclonal que regula el sistema inmunitario [3,4]. Se trata de un hito precedido por años de investigación. Hace muchos años, los estudios prospectivos de cohortes de nacimiento permitieron comprender que la T1D comienza mucho antes de la aparición de los síntomas y que el proceso de desarrollo de la enfermedad puede detectarse precozmente midiendo los autoanticuerpos de los islotes en la sangre [3]. La detección de autoanticuerpos de los islotes en combinación con otros marcadores metabólicos permite predecir la progresión de la enfermedad autoinmune y el momento probable de manifestación de los síntomas [5]. Los datos de los estudios prospectivos de cohortes de nacimiento BABYDIAB y TEDDY muestran que los autoanticuerpos contra los islotes aparecen con mayor frecuencia en la sangre por primera vez entre los 9 meses y los 2 años de edad [5]. Si pueden detectarse dos o más de los anticuerpos, existe una probabilidad de casi el 100% de padecer una T1D, por lo que la intervención en este punto parece sensata y justificada [3]. Si los valores de glucosa en sangre son normales en esta constelación, se habla de estadio 1 de la T1D. Si el proceso de la enfermedad ya está más avanzado y también pueden medirse niveles de glucosa en sangre ligeramente elevados, se habla de estadio 2. El estadio 3 corresponde a la manifestación clásica de la T1D con síntomas clínicos y una cetoacidosis potencialmente mortal; en este punto, alrededor del 80% de las células beta ya han sido destruidas.
Prevención secundaria: el teplizumab retrasa la manifestación de la T1D
El anticuerpo monoclonal anti-CD3 teplizumab fue la primera terapia preventiva e inmunomoduladora aprobada por la Administración de Alimentos y Medicamentos de EE.UU. (FDA) en 2022, con el estatus de fármaco “innovador” (recuadro) [3]. El tratamiento con teplizumab está aprobado actualmente en EE.UU. para niños prediabéticos a partir de 8 años. “Es la primera sustancia que consigue retrasar la aparición de la diabetes unos tres años”, explicó el profesor Hummel [3]. El mecanismo de acción del teplizumab es que la sustancia se dirige contra los linfocitos T activados que tienen el marcador de superficie CD3 [3]. Esto también suprime las células T autorreactivas que se dirigen contra las células beta. Al mismo tiempo, aumenta la proporción relativa de células T reguladoras. El teplizumab se utiliza en personas con un estadio 2 temprano (al menos dos autoanticuerpos positivos en los islotes y primeros signos tempranos de alteración del metabolismo de la glucosa). Un ciclo de terapia intravenosa de 14 días con teplizumab retrasa la manifestación clínica de la T1D una media de casi tres años y estabiliza la función residual de las células beta [3,6].
Aunque la terapia con teplizumab sólo puede retrasar la progresión de la enfermedad, no puede detenerla por completo, es decir, no evita la manifestación de la T1D. Sin embargo, retrasar la progresión de la diabetes en los niños es clínicamente significativo en términos de resultados y de gestión de la enfermedad en la vida diaria [6]. Y a largo plazo, una mejor función residual de las células beta, caracterizada por unos niveles más elevados de péptido C, va de la mano de un mejor control de la glucemia. Los efectos secundarios más comunes del teplizumab que se produjeron de forma transitoria durante la fase de tratamiento incluyeron linfocitopenia transitoria, erupción cutánea y dolor de cabeza [6]. Los efectos secundarios no son dramáticos, resumió el Prof. Hummel. Hasta la fecha no se han producido efectos secundarios graves [4]. También se espera que el agente inmunoterapéutico sea autorizado para Europa. En este contexto, está claro que se necesitan programas de cribado basados en la población para identificar a tiempo a los niños que pueden beneficiarse del tratamiento [3].
Prevención primaria: estudios en curso
Se están realizando esfuerzos incluso antes para intervenir principalmente como medida preventiva antes de la aparición de anticuerpos. Se trata de tratar a los niños en los que un cribado a los pocos días de nacer indica un alto riesgo genético de T1D. En Baviera, este cribado se lleva a cabo dentro del consorcio GPPAD; ya se han realizado pruebas a más de 500.000 niños de la población general [3,8,9]. “Probablemente nunca habrá una única medida de prevención primaria que evite todos los casos de diabetes tipo 1, ya que en cada caso individual intervienen distintos factores ambientales”, afirma el profesor Hummel [3]. En la actualidad, las terapias preventivas primarias se ofrecen principalmente en el marco de estudios. Los niños con un riesgo significativamente mayor de padecer una T1D son tratados con insulina oral (estudio POInt) o probióticos (SINT1A) [7]. En concreto, el estudio SINT1A investiga si la administración del probiótico B. infantis puede prevenir el desarrollo de la T1D en pacientes de alto riesgo mediante la reducción de la disbiosis y la inflamación en el intestino [8]. En el estudio POInT, la administración diaria de insulina en polvo junto con una comida se utiliza para entrenar al sistema inmunitario de forma que no se produzca una respuesta inmunitaria incorrecta [9]. La fase de reclutamiento del estudio POInT ya ha finalizado, se ha incluido a más de 1.000 participantes y el análisis está previsto para 2025. Ya se han reclutado más de 1.000 participantes para el estudio SINT1A. Por ello, se están llevando a cabo numerosos esfuerzos de investigación para hacer más alcanzable el objetivo de retrasar o prevenir la manifestación de la T1D con intervenciones tempranas. Afortunadamente, las opciones de tratamiento de la T1D manifiesta también mejoran constantemente, sobre todo gracias a las innovaciones tecnológicas en diabetes, como la monitorización continua de la glucosa y las bombas de insulina [3]. El tratamiento consecuente de las enfermedades concomitantes y secundarias, como los trastornos lipometabólicos y el daño renal, también mejora significativamente el pronóstico de los afectados. El ponente señala que las personas con T1D siguen teniendo una esperanza de vida reducida en comparación con la población general, sobre todo si enferman antes de los 10 años, como muestran los datos del registro sueco [3,10]. Pero gracias a las modernas opciones de tratamiento, las condiciones mejoran constantemente.
Congreso: Diabetologie grenzenlos
Literatura:
- Bringolf-Isler B, et al: Informe final sobre el estudio SOPHYA. Basilea: Instituto Suizo de Salud Pública y Tropical, 2016, www.bag.admin.ch/dam/bag/de/dokumente/npp/forschungsberichte,(última consulta: 23 de febrero de 2024)
- Patterson CC, et al: Tendencias y variación cíclica en la incidencia de diabetes infantil tipo 1 en 26 centros europeos en el periodo de 25 años 1989-2013: un estudio de registro prospectivo multicéntrico. Diabetologia 2019; 62(3): 408-417.
- “Prevención de la diabetes tipo 1: intervenciones (inmunológicas)”, Prof. Dr. Michael Hummel, Diabetologie grenzenlos, Múnich, 2 – 3 de febrero de 2024.
- Ramos EL, et al; Investigadores del estudio PROTECT. Teplizumab y función de las células β en la diabetes tipo 1 recién diagnosticada. N Engl J Med 2023; 389(23): 2151-2161.
- Ziegler AG: La cuenta atrás hacia la diabetes tipo 1: ¿cuándo, cómo y por qué empieza el reloj? Diabetologia 2023;66(7): 1169-1178.
- Herold KC, et al; Grupo de estudio TrialNet de diabetes tipo 1. Un anticuerpo anti-CD3, teplizumab, en familiares con riesgo de diabetes tipo 1. N Engl J Med 2019; 381(7): 603-613.
- Ziegler AG, et al: GRUPO DE ESTUDIO GPPAD. Suplementación con Bifidobacterium longum subespecie infantis EVC001 para mitigar la autoinmunidad de la diabetes tipo 1: protocolo del ensayo controlado aleatorizado GPPAD-SINT1A. BMJ Open 2021; 11(11): e052449.
- Estudio SINT1A: Prevención de la diabetes de tipo 1, www.gppad.org,(última consulta: 23/02/2024)
- Estudio POInT: Prevención de la diabetes tipo 1, www.gppad.org,(última consulta: 23 de febrero de 2024)
- Rawshani A, et al: Exceso de mortalidad y enfermedad cardiovascular en adultos jóvenes con diabetes tipo 1 en relación con la edad de inicio: un estudio de cohortes a nivel nacional basado en registros. Lancet 2018; 392(10146): 477-486.
HAUSARZT PRAXIS 2024; 19(3): 50-52 (publicado el 20.3.24, antes de impresión)