El mesotelioma pleural maligno es un tumor agresivo que se origina en la pleura. Los pacientes tienen una corta esperanza de vida tras el diagnóstico, debido también a las limitadas opciones de tratamiento. La exposición a las fibras de amianto se considera el principal factor de riesgo para desarrollar un mesotelioma pleural. Dado que la enfermedad progresa insidiosamente durante décadas, a menudo se descubre muy tarde.
Puede realizar el examen CME en nuestra plataforma de aprendizaje después de revisar los materiales recomendados. Haga clic en el siguiente botón:
El mesotelioma pleural maligno es un tumor agresivo que se origina en la pleura. Los pacientes tienen una corta esperanza de vida tras el diagnóstico, debido también a las limitadas opciones de tratamiento. La exposición a las fibras de amianto se considera el principal factor de riesgo para desarrollar un mesotelioma pleural. Dado que la enfermedad progresa insidiosamente durante décadas, a menudo se descubre muy tarde. Por ello, a menudo se diagnostica a los pacientes un mesotelioma pleural inoperable, que ya se encuentra en una fase avanzada. Esto limita las medidas terapéuticas y se refleja también en una baja esperanza de vida de unos 12 meses tras el diagnóstico.
Desarrollo del mesotelioma pleural
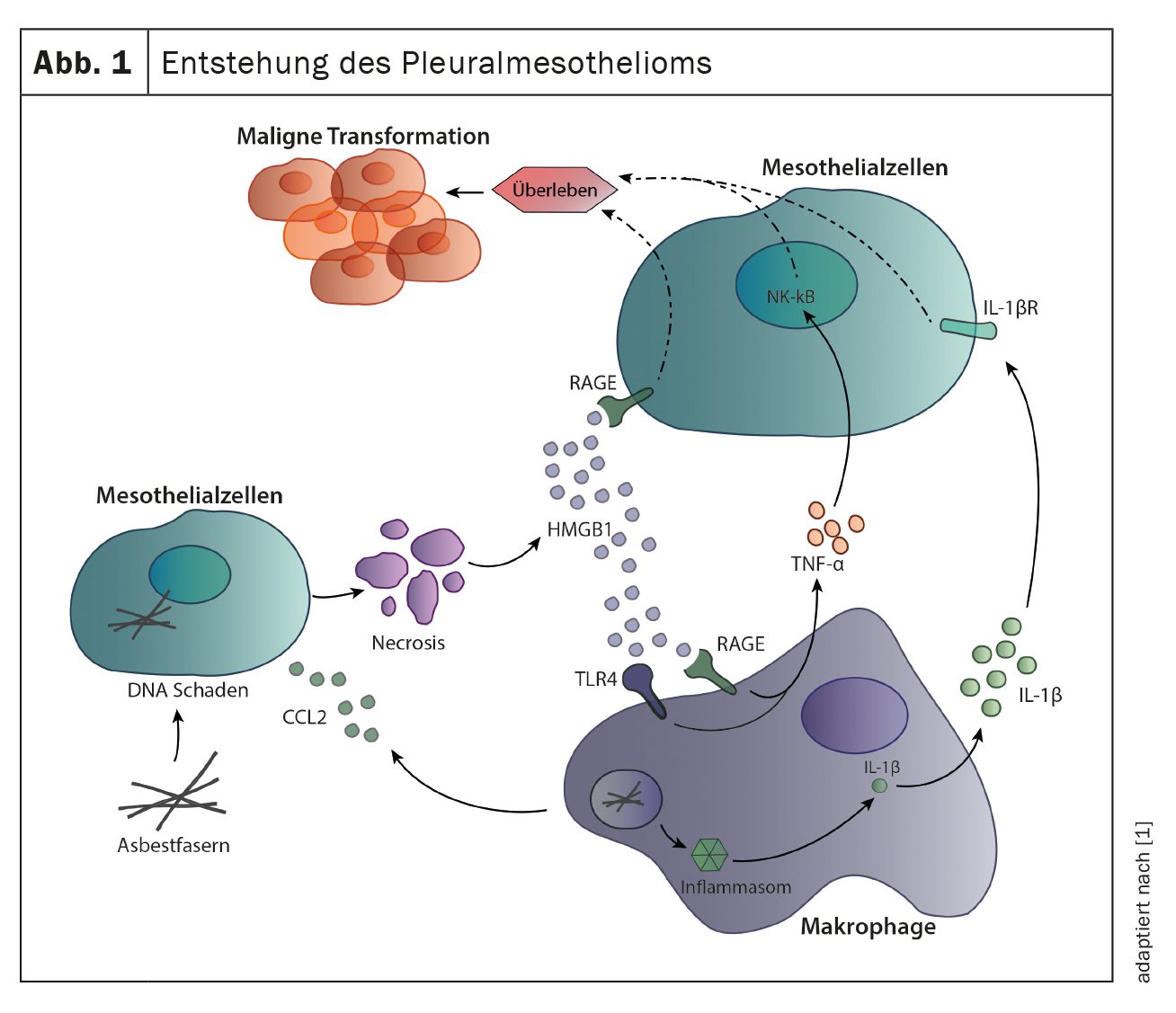
La causa más común para el desarrollo del mesotelioma pleural es la exposición a fibras de amianto, normalmente décadas antes de que aparezcan los primeros síntomas. La inhalación de las fibras provoca una inflamación crónica de la pleura, que contribuye a la transformación maligna de las células mesoteliales. Las fibras pueden causar directamente daños en el ADN de las células mesoteliales, lo que provoca la muerte celular y la liberación de mediadores inflamatorios como el HMGB1 y el CCL2. Los mediadores inflamatorios, especialmente el CCL2, reclutan macrófagos y actúan directamente sobre las células mesoteliales uniéndose a los receptores RAGE de las células mesoteliales e induciendo su división y migración celular. Los macrófagos reclutados también contribuyen a la inflamación local y a la proliferación de las células mesoteliales. La captación de fibras de amianto por los macrófagos estimula el sensor inmunitario inflamasoma, que conduce a la secreción de IL-1β. Además de IL-1β, los macrófagos también segregan TNF-α, ambas citocinas contribuyen a la supervivencia de las células mesoteliales y a su posterior transformación maligna (Fig. 1) [1].
Firmas genéticas
Alrededor del 80% de los tumores tienen una exposición al amianto décadas antes. Una predisposición genética familiar debida a mutaciones en la línea germinal del gen BAP1puede aumentar la probabilidad de desarrollar un mesotelioma pleural. A diferencia de otras enfermedades tumorales, en las que es frecuente la presencia de mutaciones activadoras en oncogenes, el mesotelioma pleural se caracteriza principalmente por la alteración y pérdida de partes cromosómicas completas y por mutaciones en genes supresores de tumores. Durante mucho tiempo se prestó poca atención a los cambios genéticos en el mesotelioma pleural, debido a la baja tasa de mutaciones de este tipo de cáncer y a los pocos casos en los que sería posible una terapia dirigida. Las mutaciones y deleciones más frecuentes afectan a los genes BAP1, CDKN2A y NF2. BAP1 es un gen supresor de tumores que interviene en la reparación de daños en el ADN y en el control del ciclo celular. El BAP1 está alterado en aproximadamente el 45% de todos los mesoteliomas pleurales, aunque esta cifra puede variar entre las distintas histologías.
CDKN2A es también un gen supresor de tumores que se elimina con frecuencia en el mesotelioma pleural. Los cambios en este gen se encuentran en alrededor del 47% de todos los tumores. El CDKN2A desempeña un papel importante en la regulación del ciclo celular, codificando el inhibidor de la quinasa dependiente de ciclinas 4 y 6. La pérdida de este gen conduce, por tanto, a una señalización promitótica y a la supervivencia celular.
La NF2 también interviene en la regulación del ciclo celular y está alterada en aproximadamente el 32% de todos los mesoteliomas pleurales. La NF2 regula la vía de señalización Hippo a través de las proteínas YAP y TAZ. La inactivación de la NF2 conduce a la hiperactivación de la YAP y a una división celular descontrolada.
Sólo unos pocos mesoteliomas pleurales presentan mutaciones en genes a los que pueden dirigirse los inhibidores de moléculas pequeñas. En un estudio pudimos demostrar que en aproximadamente el 5% de todos los mesoteliomas pleurales se encuentran mutados los genes ALK, KRAS EGFR, PDGFRA/B, ERBB2 o FGFR3, que podrían tratarse con terapias dirigidas [2]. Otros estudios aún deben demostrar la eficacia de este tratamiento en el mesotelioma pleural.
Entorno tumoral
La interacción de distintos tipos de células, como las células inmunitarias, las células estromales, las células tumorales y las células endoteliales de los vasos sanguíneos del tumor, es muy compleja y aún no se comprende del todo en el mesotelioma pleural. Dependiendo del tipo de tumor y del paciente, la heterogeneidad de tipos y funciones celulares es grande. Por ello, las terapias que actúan directamente sobre el entorno tumoral son difíciles de desarrollar. Además, las células inmunitarias suelen tener un fenotipo inhibidor y regulador, representado principalmente por células T reguladoras, macrófagos de tipo 2 y células mieloides supresoras.
Los macrófagos son las células inmunitarias más comunes en el mesotelioma pleural y son reclutados desde la sangre en forma de monocitos por el CCL2, que segregan las células mesoteliales. Los macrófagos asociados a tumores expresan un fenotipo inmunosupresor de tipo 2 y favorecen la proliferación de células mesoteliales malignas y el crecimiento tumoral, lo que también se correlaciona con un mal pronóstico. Las segundas células inmunitarias más abundantes en el mesotelioma pleural son los linfocitos T, con presencia de todos los subtipos, como las células T auxiliares CD4+, las células T citotóxicas CD8+ y las células T reguladoras FoxP3+. Las células T citotóxicas suelen expresar marcadores como Lag-3, Tim-3, PD-1, que definen un fenotipo no reactivo. Estas células T ya no son capaces de llevar a cabo funciones efectoras, lo que da a las células tumorales una ventaja de supervivencia. La presencia de células T en el tumor se asocia positivamente con la supervivencia en el mesotelioma pleural, según el estudio, pero esto puede variar en función de la histología y del fenotipo específico de las células T. Así, las células T reguladoras en el tumor se asocian a una menor supervivencia. Otras células inmunitarias supresoras del tumor son las células mieloides supresoras, que pueden representar hasta el 10% de todas las células inmunitarias infiltrantes. Tienen un efecto negativo sobre las células T y pueden inhibir su división celular.
Patología
El mesotelioma pleural se divide en tres subtipos histológicos, el mesotelioma pleural epitelioide (aproximadamente el 80% de los casos), el bifásico y el sarcomatoide. El subtipo bifásico se caracteriza por una combinación de estructuras epitelioides y sarcomatoides.
Los subtipos histológicos difieren principalmente en la esperanza de vida. Los pacientes con mesotelioma pleural epitelioide tienen una mayor esperanza de vida en comparación con los pacientes con mesotelioma pleural bifásico o sarcomatoide. Además, los pacientes con un subtipo epitelioide suelen beneficiarse de la resección, mientras que los demás subtipos no se benefician de la cirugía. En ocasiones, el diagnóstico del mesotelioma pleural es difícil debido a la morfología celular, ya que, por un lado, la pleura suele estar alterada por cambios inflamatorios o hay metástasis de otra enfermedad maligna. Por lo tanto, es necesario un análisis más detallado de una biopsia pleural mediante inmunohistoquímica (IHC) de dos marcadores de mesotelioma como la calretinina, la podoplanina, el tumor-1 de Wilms (WT-1) o la citoqueratina 5/6. Además, pueden excluirse otros carcinomas mediante tinción con CEA, Ber-EP4, pancitoqueratina o claudina-4. El mesotelioma pleural con un cambio similar al de las células escamosas puede distinguirse del carcinoma de células escamosas mediante la tinción para los marcadores p40 y p63. Además, a menudo se producen alteraciones genéticas en los genes BAP1 y CDKN2A, que dan lugar a la pérdida de expresión de estas proteínas en el tumor. Por ello, el análisis inmunohistoquímico de la expresión de BAP1 y MTAP (el MTAP se analiza como sustituto del CDKN2A, ya que estos genes están situados directamente adyacentes en el segmento cromosómico 9p21 y a menudo se produce una codeleción) también puede ser útil para realizar un diagnóstico definitivo.
Síntomas, diagnóstico y estadiaje
Los pacientes suelen presentar síntomas inexplicables de disnea, dolor torácico y pérdida de peso. Los pacientes suelen presentar un derrame pleural unilateral. El diagnóstico del mesotelioma pleural se realiza mediante varios exámenes: i) Exámenes radiológicos, incluida la tomografía computarizada del tórax, ii) Biopsia pleural por toracoscopia para confirmar aún más el diagnóstico de mesotelioma pleural y determinar la histología. Por lo tanto, una biopsia pleural debe extenderse siempre hasta la grasa subpleural y tomarse de tres o más localizaciones diferentes. Para evitar el riesgo de implantación de células tumorales en la pared torácica, sólo deben utilizarse 1-2 puntos de entrada toracoscópica [3]. Preferiblemente, se colocan en el mismo espacio intercostal de la resección macroscópicamente completa prevista en el curso posterior.
La estadificación se realiza mediante tomografía por emisión de positrones (PET-TAC) y se complementa con mediastinoscopia o ecografía endobronquial (EBUS) si se sospecha una afectación de los ganglios linfáticos mediastínicos, mediante toracoscopia contralateral si se sospecha una afectación pleural contralateral o mediante laparoscopia si se sospecha una afectación peritoneal. La resonancia magnética (RM) del tórax también puede proporcionar información valiosa a efectos de estadificación sobre la infiltración en el diafragma, la pared torácica, el pericardio o el mediastino.
Intervenciones quirúrgicas
El tratamiento debe discutirse en una junta tubmoratoria interdisciplinar con representantes especializados de cirugía torácica, oncología, radiooncología, patología y radiología. Si el estadio tumoral y el estado general del paciente lo cualifican para un concepto de tratamiento multimodal, la quimioterapia neoadyuvante con citostáticos que contienen platino y antagonistas del ácido fólico va seguida de una nueva estadificación mediante PET-TC para reevaluar la operabilidad. Debido a la situación anatómica con proximidad a las estructuras mediastínicas, no se pueden mantener distancias de seguridad suficientes durante una resección de MPM. Por lo tanto, resección radical significa aquí una resección macroscópicamente completa con el objetivo de una citorreducción máxima, pero con el riesgo de tumor microscópico residual [4]. Puede conseguirse una resección macroscópicamente completa mediante una neumonectomía extrapleural (EPP) o una pleurectomía ampliada y decorticación (EPD) que preserve el parénquima pulmonar [4]. Mientras que la PPE implica una resección en bloque del pulmón afectado con pleura visceral y parietal, así como diafragma y pericardio, en la EPD sólo se desprenden y extirpan la pleura parietal y visceral junto con el diafragma y el pericardio afectados, dejando el pulmón intacto [4]. En ausencia de signos de afectación pericárdica o diafragmática, puede optarse por una pleurectomía aislada y decorticación (DP). En todas las resecciones quirúrgicas debe realizarse también una linfadenectomía mediastínica sistemática. En los últimos años, se ha pasado cada vez más de la PPE a la EPD, ya que se preserva el parénquima pulmonar y las reservas funcionales, lo que permite al paciente tener una mejor calidad de vida. La PPE también se asocia a una mayor morbilidad y mortalidad perioperatorias. La PPE sólo debe considerarse en casos seleccionados con infiltración extensa del parénquima pulmonar y reservas cardiopulmonares suficientes y sólo debe realizarse en centros experimentados.
En los pacientes en los que la citorreducción máxima mediante resección macroscópica completa no es una opción, la reaparición del derrame pleural sintomático puede prevenirse en un enfoque paliativo. En el caso de pulmones extensos, se realiza mediante pleurodesis toracoscópica con talco, en el caso de pulmones atrapados crónicamente mediante un sistema de catéter tunelizado subcutáneo, que también puede utilizarse para el drenaje regular de derrames en el entorno doméstico.
La VATS-PP paliativa se recomienda para controlar los derrames pleurales recurrentes en pacientes lo suficientemente aptos para el tratamiento quirúrgico y que no pueden beneficiarse de la pleurodesis química (o tras una pleurodesis infructuosa) o de los catéteres permanentes [5].
Terapia del sistema
Desde 2004, los pacientes han sido tratados con una terapia sistémica combinada de pemetrexed y quimioterapia basada en platino. La introducción del bevacizumab, un inhibidor de la angiogénesis, en combinación con cisplatino/pemetrexed consiguió aumentar la esperanza de vida en unos 2,5 meses. Debido al éxito de los inhibidores de los puntos de control inmunitarios en diversos tumores sólidos, se probó la terapia combinada de ipilimumab (anticuerpo anti-CTLA-4) y nivolumab (anticuerpo anti-PD-1). Esta terapia mostró una mejora significativa de la supervivencia en el mesotelioma pleural sarcomatoide y epitelioide con PD-L1>1% [6]. Así, este tratamiento fue aprobado por la FDA y la EMA como terapia de primera línea en 2020. Sin embargo, en las últimas líneas de tratamiento, el mesotelioma pleural sigue siendo una enfermedad sin tratamientos estandarizados y los pacientes suelen inscribirse en ensayos clínicos.
Mensajes para llevar a casa
- En pacientes seleccionados con MPM en estadio inicial y reservas cardiopulmonares suficientes, se recomienda la citorreducción quirúrgica máxima mediante resección macroscópica completa.
- Una resección macroscópicamente completa debe realizarse siempre como parte de un concepto de terapia multimodal en combinación con quimioterapia.
- Las recomendaciones y decisiones de tratamiento deben tomarse siempre en una junta interdisciplinar de tumores de oncología torácica en presencia de oncólogos, oncólogos radioterapeutas, neumólogos y cirujanos torácicos.
- La terapia de primera línea en pacientes no operables se basa en nivolumab e ipilimumab para pacientes con mesotelioma pleural epitelioide con expresión de PD-L1 >1% y para todos los demás subtipos histológicos. De lo contrario, el tratamiento con platino-pemetrexed y bevacizumab es la otra opción.
Literatura:
- Hiltbrunner S, Mannarino L, Kirschner MB, et al.: Tumor Immune Microenvironment and Genetic Alterations in Mesothelioma, Frontiers in oncology 11 (2021) 660039.
- Hiltbrunner S, Fleischmann Z, Sokol E, Curioni-Fontecedro A: 1734P Genomic landscape of pleural and peritoneal mesothelioma tumors, Annals of Oncology 32 (2021) S1200.
- Kindler HL, Ismaila N, Armato SG, et al.: Treatment of Malignant Pleural Mesothelioma: American Society of Clinical Oncology Clinical Practice Guideline, J Clin Oncol 36(13) (2018): 1343–1373.
- Rice D, Rusch V, Pass H, et al.: Recommendations for uniform definitions of surgical techniques for malignant pleural mesothelioma: a consensus report of the international association for the study of lung cancer international staging committee and the international mesothelioma interest group, J Thorac Oncol 6(8) (2011): 1304–1312.
- Opitz I, Scherpereel A, Berghmans T, et al.: ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma, Eur J Cardiothorac Surg 58(1) (2020): 1–24.
- Baas P, Scherpereel A, Nowak AK, et al.: First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial, Lancet 397(10272) (2021) 375–386.
InFo ONKOLOGIE & HÄMATOLOGIE 2024; 12(6): 6–9