Der Schlaganfall ist eine der Hauptursachen für Behinderungen. Kognitive Beeinträchtigungen nach einem Schlaganfall wurden viele Jahre lang eher vernachlässigt. Die Übersicht konzentriert sich auf die Inzidenz und Prävalenz des kognitiven Verfalls nach einem Schlaganfall, auf die wichtigsten prädisponierenden Faktoren, auf bildgebende Faktoren und auf potenzielle Biomarker.
Der Schlaganfall ist eine der Hauptursachen für Behinderungen [1]. Während sich die meisten Forschungen und Interventionen auf körperliche Behinderungen konzentrierten [2], wurden kognitive Beeinträchtigungen nach einem Schlaganfall viele Jahre lang eher vernachlässigt [3,4]. Es ist heute bekannt, dass selbst kleinere Schlaganfälle das tägliche Funktionieren und die Kognition beeinträchtigen können und somit die Lebensqualität beeinflussen [5]. Ein ischämischer Schlaganfall kann den Ausbruch einer vaskulären Demenz begünstigen und einen bereits bestehenden kognitiven Abbau verschlimmern. Der Beginn des kognitiven Abbaus kann sich unmittelbar nach einem ischämischen Schlaganfall manifestieren, aber oft kommt es nach einem Schlaganfall zu einer Verzögerung bei der Entwicklung des kognitiven Abbaus [6]. Sowohl neurodegenerative als auch vaskuläre Mechanismen werden aktiviert und führen wahrscheinlich zu sich überschneidenden Prozessen innerhalb der neurovaskulären Einheit [7]. In der vorliegenden Übersicht konzentrieren wir uns auf die Inzidenz und Prävalenz des kognitiven Verfalls nach einem Schlaganfall, auf die wichtigsten prädisponierenden Faktoren, auf bildgebende Faktoren und auf potenzielle Biomarker.
Epidemiologie
Schlaganfall-Überlebende haben ein erhöhtes Risiko, kognitive Beeinträchtigungen zu entwickeln. Die Schätzungen der Prävalenz von Demenz stimmen in verschiedenen Studien überein: 10 % der Patienten weisen bereits vor dem ersten Schlaganfall eine Demenz auf, 10 % entwickeln nach dem ersten Schlaganfall eine neue Demenz und mehr als ein Drittel leidet nach einem erneuten Schlaganfall an einer Demenz [8,9].
Die starke Assoziation von Demenz nach einem Schlaganfall mit mehreren Schlaganfällen unterstreicht die zentrale kausale Rolle des Schlaganfalls und damit die wahrscheinliche Wirkung einer optimalen akuten Schlaganfallversorgung und Sekundärprävention bei der Verringerung der Demenzbelastung [8]. Die Prävalenz kognitiver Beeinträchtigungen bei Schlaganfallüberlebenden variiert je nach Umfeld, Population, Ausschlusskriterien (Demenz vor dem Schlaganfall, rezidivierender Schlaganfall, Aphasie), den für die Diagnose kognitiver Beeinträchtigungen verwendeten Kriterien und dem Zeitintervall seit dem Schlaganfall [10]. Die Prävalenz der Demenz nach einem Schlaganfall im ersten Jahr nach dem Schlaganfall reicht von 7 % in bevölkerungsbasierten Studien über den ersten Schlaganfall ohne Demenz vor dem Schlaganfall bis zu 41 % in krankenhausbasierten Studien, die einen wiederkehrenden Schlaganfall und Demenz vor dem Schlaganfall einschließen [8]. Es wurde festgestellt, dass das Risiko einer Demenz nach dem Schlaganfall in den ersten Monaten nach dem Schlaganfall am höchsten ist, was zum Teil auf nicht erkannte kognitive Beeinträchtigungen vor dem Schlaganfall zurückzuführen sein könnte [10]. Nach der anfänglichen Inzidenz der Demenz nach dem Schlaganfall steigt die kumulative Inzidenz in krankenhausbasierten und bevölkerungsbasierten Studien linear mit einer Rate von 3 % bzw. 1,7 % pro Jahr an [11]. Nur wenige Studien befassten sich mit Langzeitergebnissen: Der längste Beobachtungszeitraum war 25 Jahre in einer bevölkerungsbasierten Studie, in der eine kumulative Inzidenz von Demenz nach einem Schlaganfall von 48% im Jahr 25 [12] festgestellt wurde.
Kognitive Beeinträchtigungen können auch nach einer TIA auftreten. In einer kürzlich durchgeführten systematischen Überprüfung, an der 1167 Patienten teilnahmen, lag die Prävalenz der leichten kognitiven Beeinträchtigung nach einer TIA zwischen 29 und 68%. Schwere kognitive Beeinträchtigungen wurden bei 8-22% der Patienten festgestellt. Studien, die ein kognitives Screening-Instrument verwenden, und solche, die kurz nach einer TIA oder einige Jahre später durchgeführt wurden, berichteten die höchsten Häufigkeiten von Beeinträchtigungen [13].
Definitionen
Vaskuläre Demenz ist nach der Alzheimer-Krankheit die zweithäufigste Ursache für einen kognitiven Abbau und umfasst auch die Demenz nach einem Schlaganfall. Daher sind die Begriffe PSD und vaskuläre Demenz nicht synonym. Vaskuläre Demenz ist ein Konzept, das nicht nur multiple kortikale und/oder subkortikale Infarkte, sondern auch strategische Einzelinfarkte, Läsionen der weißen Substanz ohne Infarkt, Hämorrhagien und Hypoperfusion als mögliche Ursachen von Demenz umfasst. Außerdem muss betont werden, dass nicht alle Fälle von Demenz nach einem Schlaganfall einen vaskulären Ursprung haben. Dementsprechend wird der Begriff der Post-Schlaganfall-Demenz (PSD) für jede Demenz verwendet, die sich nach einem klinischen zerebrovaskulären Ereignis entwickelt. Auf diese Weise deutet der Begriff PSD nicht auf einen bestimmten neuropathologischen Prozess hin. Darüber hinaus ist es wichtig, den kognitiven Zustand vor dem Schlaganfall zu erkennen, um eine angemessene Klassifizierung zu ermöglichen. Ein Patient mit vorbestehenden kognitiven Beeinträchtigungen, der einen leichten Schlaganfall erleidet, sollte nicht als PSD eingestuft werden. Darüber hinaus ist die zeitliche Einschätzung der kognitiven Beeinträchtigung ein weiterer wichtiger diagnostischer Faktor. Nach einem Schlaganfall werden häufig akute Defizite bei kognitiven Tests beobachtet, und eine erneute Untersuchung nach einigen Wochen zeigt oft Verbesserungen [10]. Es wird daher empfohlen, die endgültige Diagnose der PSD erst mindestens sechs Monate nach dem Ereignis zu stellen.
Der Begriff “nach einem Schlaganfall” umfasst nicht nur Schlaganfälle und kleinere Schlaganfälle, sondern auch transitorische ischämische Attacken (TIA), denn es gibt Hinweise darauf, dass auch TIAs mit einer ungünstigen kognitiven Prognose verbunden sein können [13].
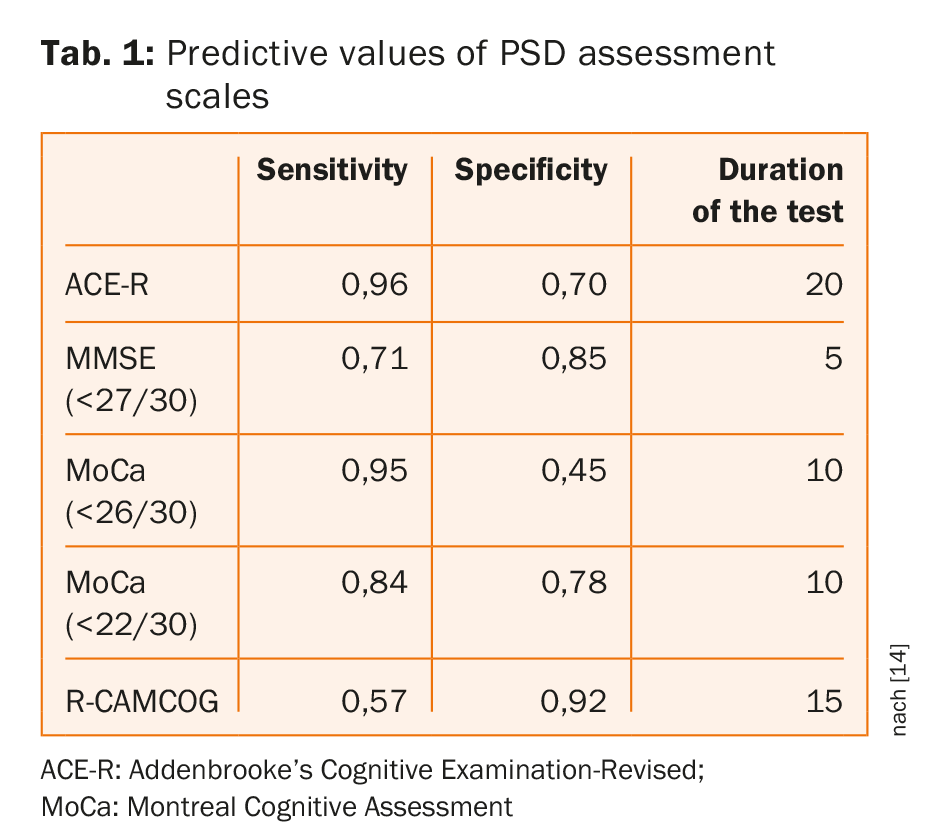
Screening-Tests
Gängige kognitive Screening-Instrumente weisen eine ähnliche Genauigkeit bei der Erkennung von Demenz/mehrfachen Beeinträchtigungen auf, wobei es keinen eindeutig überlegenen Test gibt und keine Hinweise darauf, dass Screening-Instrumente mit längerer Verabreichungszeit besser abschneiden [14]. Wie aus Tabelle 1 hervorgeht, bietet der MoCA mit dem üblichen Schwellenwert eine kurze Beurteilungszeit bei hoher Sensitivität, allerdings auf Kosten der Spezifität; angepasste Cutoffs verbesserten die Spezifität, ohne die Sensitivität zu beeinträchtigen [14].
Risikofaktoren für Demenz nach einem Schlaganfall
Die wichtigsten Risikofaktoren für Demenz nach einem Schlaganfall sind in Tabelle 2 aufgeführt . In der Tat wirken diese Parameter auf verschiedenen Ebenen, einige eher auf den Zustand vor dem Schlaganfall, andere auf den Zustand nach dem Schlaganfall. In einer systematischen Übersichtsarbeit und Metaanalyse mit 7511 Patienten zeigten Pendlebury und Kollegen, dass die Atrophie des medialen Temporallappens, das weibliche Geschlecht und eine Demenz in der Familienanamnese stark mit einer Demenz vor dem Schlaganfall assoziiert waren, während die Merkmale und Komplikationen des Schlaganfalls und das Vorhandensein multipler Läsionen in Zeit und Ort stärker mit einer Demenz nach dem Schlaganfall verbunden waren [8].
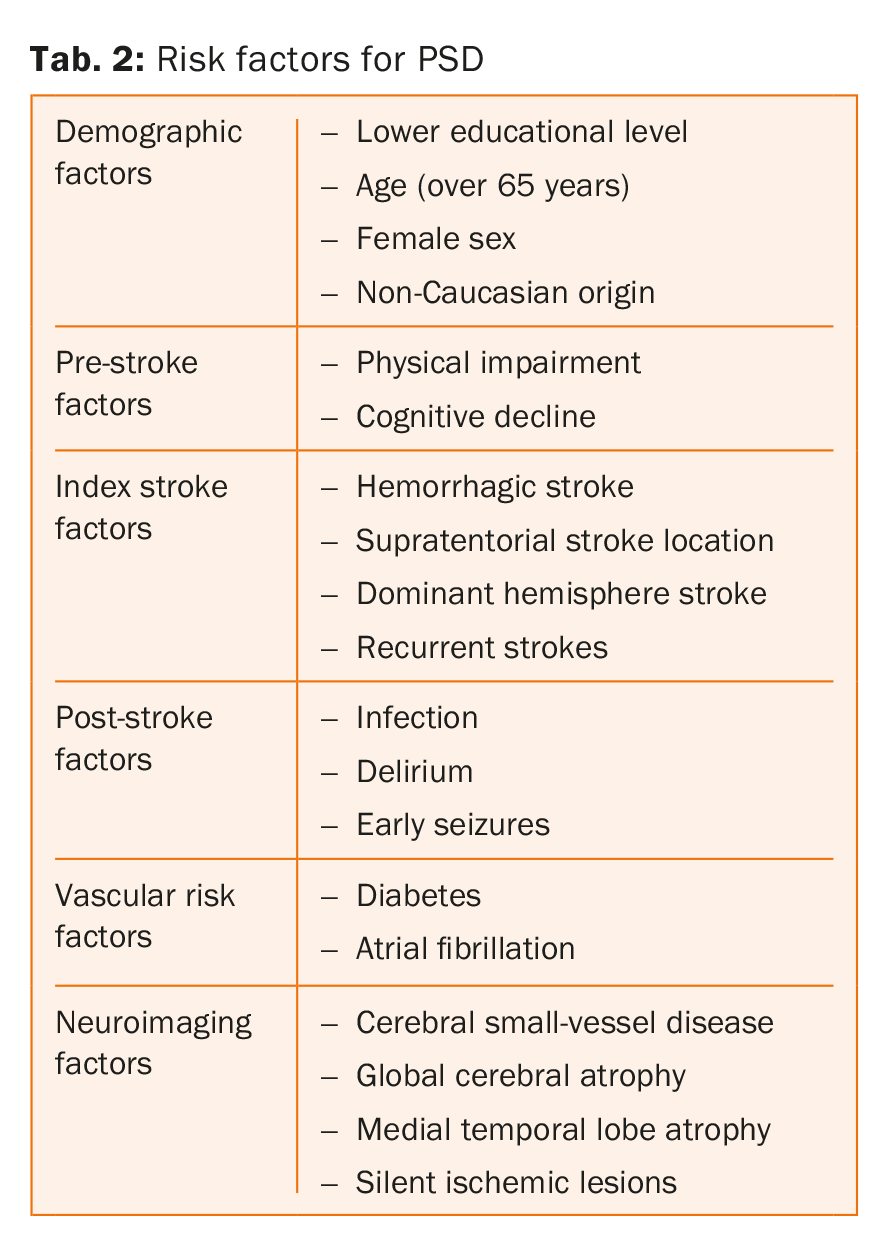
Bemerkenswert ist auch die Tatsache, dass vaskuläre Risikofaktoren wie Diabetes und Vorhofflimmern unabhängig von der kognitiven Beeinträchtigung vor dem Schlaganfall mit einem erhöhten Risiko für eine Demenz nach dem Schlaganfall verbunden sind, während dies für zwei andere bekannte Risikofaktoren, Bluthochdruck und Rauchen, nicht festgestellt wurde [8,15-18]. Dieser Befund steht jedoch im Widerspruch zu den Ergebnissen anderer Studien, die zeigen, dass arterielle Hypertonie eine wichtige Determinante für kognitive Beeinträchtigungen ist [19,20]. Schließlich fehlen Hinweise darauf, ob lebensstilbedingte vaskuläre Risikofaktoren wie Bewegungsmangel und ungesunde Ernährung auch unabhängige Risikofaktoren für PSD sind [21].
Schlaganfall-Subtypen
Es wird allgemein angenommen, dass lakunäre Schlaganfälle weniger wahrscheinlich die Kognition beeinträchtigen als schwerere, größere kortikale Schlaganfälle. Lakunäre Schlaganfälle sind jedoch in der Regel mit zerebralen Erkrankungen der kleinen Gefäße verbunden, einer häufigen Ursache für kognitive Beeinträchtigungen und Demenz, insbesondere bei älteren Menschen [22]. In einer kürzlich durchgeführten Meta-Analyse verglichen Makin und Mitarbeiter die Häufigkeit kognitiver Beeinträchtigungen in Abhängigkeit von verschiedenen Schlaganfall-Subtypen [23]. Die Autoren wiesen bei 7575 Patienten, darunter 2860 mit lakunärem Schlaganfall, nach, dass 24% eine leichte kognitive Beeinträchtigung (MCI) oder PSD aufwiesen. Die Prävalenz von Demenz nach lakunärem Schlaganfall (sechs Studien, n=1421) betrug 20% (95% CI 9 bis 33) und die Inzidenz von MCI oder Demenz (vier Studien, n=275) betrug 37% (95% CI 23 bis 53). Die Autoren kamen zu dem Schluss, dass kognitive Beeinträchtigungen nach lakunären Schlaganfällen trotz ihrer geringen Größe weit verbreitet zu sein scheinen, was darauf hindeutet, dass die damit verbundene SVD ihre Auswirkungen verstärken kann. Es wurde kein signifikanter Unterschied hinsichtlich der Prävalenz der PSD zwischen lakunären und nicht-lakunären Schlaganfällen festgestellt.
Neuroimaging
Die Neurobildgebung ist ein wichtiges diagnostisches Instrument bei PSD. Die Magnetresonanztomographie (MRT) ist das wichtigste bildgebende Verfahren im Bereich der Neurologie, das eine hohe Sensitivität und Spezifität bei der Erkennung pathologischer Veränderungen, einschließlich Erkrankungen der kleinen Gefäße, aufweist. Für die Diagnose von Erkrankungen der kleinen Gefäße und des kognitiven Verfalls nach einem Schlaganfall sollte die MRT mit mehreren Sequenzen eingesetzt werden. Es werden Standards für die Neurobildgebung mit einer weithin akzeptierten Terminologie empfohlen, die einen Vergleich der Befunde ermöglicht [26].
Die Positronen-Emissions-Tomographie (PET) ermöglicht die Darstellung von lokalisierten und/oder diffusen Stoffwechselstörungen, die für kognitive Beeinträchtigungen und Demenz verantwortlich sind, und ist wirksam bei der Unterscheidung zwischen vaskulären und degenerativen Demenzen wie der Alzheimer-Krankheit (verminderter Stoffwechsel im temporo-mesialen, temporo-parietalen Kortex und im hinteren Cingulum, erhaltener Stoffwechsel im frontalen und visuellen Kortex, in der zentralen Region und den Basalganglien). Es kann auch entzündliche Veränderungen und deren Interaktion mit Amyloid-Ablagerungen für die Entwicklung von gemischten Demenzerkrankungen nach einem Schlaganfall nachweisen [27].
Prädiktoren für die Bildgebung
Einige Merkmale der MRT-Bildgebung haben einen prädiktiven Wert für das Auftreten einer PSD. In einer kürzlich durchgeführten Studie wurden 294 Patienten mit SVD drei bis fünf Jahre nach der Erstvorstellung eines subkortikalen Schlaganfalls vom lakunären Typ [28] untersucht. Bei der Nachuntersuchung wurde bei 188 (63,9%) der SVD-Patienten eine vaskuläre kognitive Beeinträchtigung (VCI) jeglicher Art festgestellt, wobei 65 (22,1%) die Kriterien für eine vaskuläre Demenz erfüllten. Die multivariate logistische Regressionsanalyse, bereinigt um Alter und Geschlecht, identifizierte den Gesamtschweregrad der Hyperintensitäten der weißen Substanz (tARWMC HR 1,42, 95% CI 1,01-2,00; p0,043) und die Gesamtzahl der lakunären Infarkte (HR 3,06, 95% CI 1,71-5,50, p < 0,001) als unabhängige Prädiktoren für den kognitiven Abbau. Eine andere Studie verglich den prognostischen Wert der Atrophie des medialen Temporallappens und Merkmale der SVD in einer Kohorte von 234 Patienten mit Schlaganfall oder TIA [29]. Die Beziehung zwischen radiologischen Merkmalen, die auf die Alzheimer-Krankheit und SVD hindeuten, wurde erforscht und der Zusammenhang zwischen jedem dieser Merkmale und dem kognitiven Status nach einem Jahr wurde untersucht. SVD-Merkmale waren unabhängig voneinander mit MTA assoziiert (p<0,001). Nach Anpassung für Alter, Geschlecht, Behinderung nach Schlaganfall, Bluthochdruck und Diabetes mellitus war die mediale temporale Atrophie das einzige radiologische Merkmal, das unabhängig mit einer kognitiven Beeinträchtigung assoziiert war, definiert unter Verwendung von Schwellenwerten für den Mini Mental State (MMSE) ≤26 (Odds Ratio 1,94; 95% CI1,28-2,94) und MMSE ≤23 (Odds Ratio 2,31; 95% CI1,48-3,62).
Biomarker
Zu den Biomarkern für PSD können metabolische, genetische und entzündliche Mediatoren gehören. Das e4-Allel von Apolipoprotein E (APOE4) ist ein bekannter Risikofaktor für die Alzheimer-Krankheit [30,31]. APOE4 wird auch mit Herz-Kreislauf-Erkrankungen und Hirninfarkten in Verbindung gebracht [31]. Es gibt widersprüchliche Daten über die Assoziation des APOE4-Polymorphismus mit vaskulärer Demenz und PSD [32–35]. Es wird berichtet, dass das Renin-Angiotensin-System sowohl über metabolische als auch über vaskuläre Effekte an der Entstehung von Demenz beteiligt ist [36,37]. Das Angiotensin-konvertierende Enzym (ACE) ist eines der Enzyme des Renin-Angiotensin-Systems. Patienten mit dem ACE-Genotyp weisen hohe ACE-Spiegel im Plasma auf und haben ein höheres Risiko für kardiovaskuläre Komorbiditäten [38–40]. Frühere Studien zeigten einen Zusammenhang zwischen dem ACE-Allel und dem kognitiven Abbau. Dieser Effekt kann bei Vorhandensein von APOE4 [41,42] stärker sein. Studien, die ACE als Prädiktor für den kognitiven Abbau nach einem Schlaganfall untersuchten, endeten jedoch mit widersprüchlichen Daten [42,43]. Andere Biomarker wie das B-Sekretase-Enzym (BACE1) und die Rezeptorwerte für fortgeschrittene Glykationsendprodukte (sRAGE) korrelieren mit kognitiven Beeinträchtigungen unmittelbar nach dem Schlaganfall (zwei Wochen nach dem Schlaganfall) [39]. Homocystein-, Vitamin B12- und Folsäurespiegel wurden mit kognitivem Verfall und Schlaganfall in Verbindung gebracht und könnten auch bei PSD eine Rolle spielen. In der VITATOPS-Studie hatte die Supplementierung mit B-Vitaminen jedoch keinen Einfluss auf das Auftreten von kognitiven Beeinträchtigungen oder den kognitiven Abbau [44]. Ein übermäßiges entzündliches Milieu im Gehirn könnte den post-ischämischen Schaden verschlimmern. Daher sind Personen mit einer erhöhten Entzündungsreaktion auf den ischämischen Insult möglicherweise anfälliger für weitere Gewebeschäden und die Entwicklung einer PSD.
Es ist bekannt, dass systemische Entzündungen und Entzündungsmarker mit kognitiven Beeinträchtigungen verbunden sind [45], insbesondere mit degenerativen Demenzen wie der Alzheimer-Krankheit [46–48]. Längsschnittstudien zeigten einen Zusammenhang zwischen einer höheren Ausgangskonzentration von Interleukin 6 (IL-6) [48] und C-reaktivem Protein (CRP) [49] und kognitivem Abbau. Der Zusammenhang zwischen Entzündungen und PSD ist jedoch noch nicht erwiesen. Mehrere neuere Studien haben den Zusammenhang zwischen Entzündungsmarkern und PSD untersucht. Die Erythrozytensedimentationsrate (ESR) [50], CRP und IL-6 [51] wurden als Prädiktoren für PSD vorgeschlagen.
Pharmakologische Behandlung und Prävention
Es gibt verschiedene pharmakologische Interventionen zur Vorbeugung des kognitiven Verfalls nach einem Schlaganfall. Die langfristige Senkung des Blutdrucks nach einem Schlaganfall mit Perindopril war in der PROGRESS-Studie [52] mit einem geringeren kognitiven Abbau und einem Trend zu weniger Demenz verbunden.
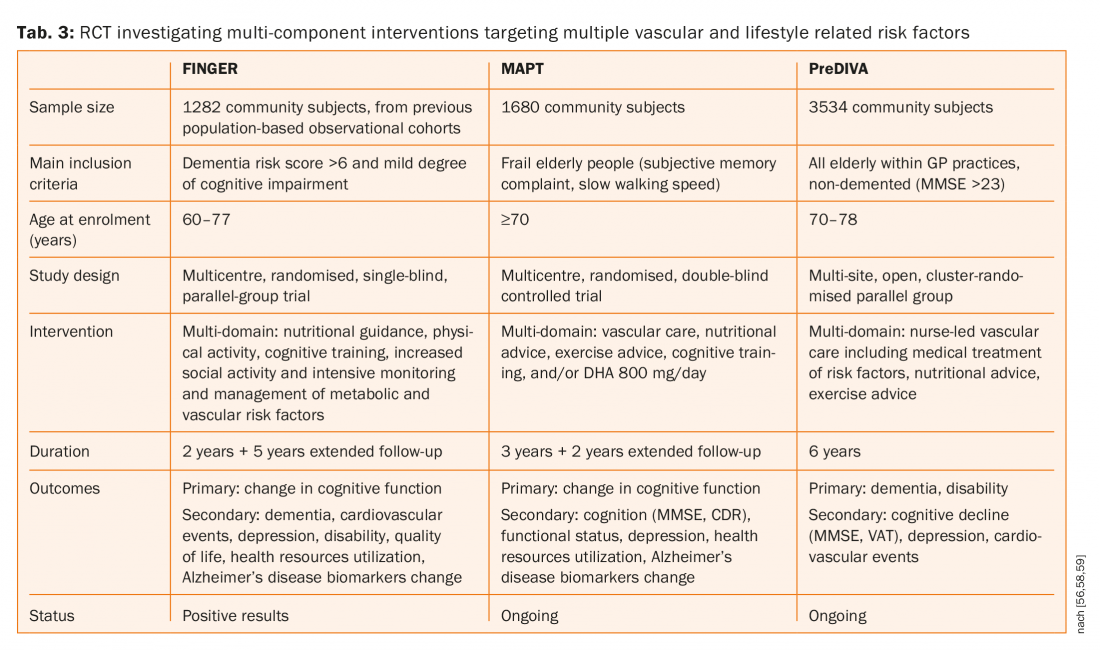
Darüber hinaus hat sich gezeigt, dass Statine sowohl den ersten als auch den wiederkehrenden Schlaganfall reduzieren, aber weder Simvastatin noch Pravastatin hatten einen Einfluss auf die Kognition [53,54]. Drei große randomisierte kontrollierte Studien (FINGER, MAPT und preDIVA, Registerkarte. 3) zur Untersuchung von Multikomponenten-Interventionen, die auf mehrere vaskuläre und lebensstilbedingte Risikofaktoren abzielen, im Vergleich zu allgemeiner Gesundheitsberatung (Kontrollgruppe), um kognitiven Abbau und Demenz zu verhindern [55–58]. Eine dieser drei Studien (FINGER) veröffentlichte ihre Ergebnisse und deutete darauf hin, dass eine Intervention in mehreren Bereichen die kognitiven Funktionen bei gefährdeten älteren Menschen verbessern oder erhalten könnte [55,56]. Es wurden 1260 Patienten nach dem Zufallsprinzip der Interventionsgruppe (n=631) oder der Kontrollgruppe (n=629) zugewiesen. 591 (94%) Teilnehmer in der Interventionsgruppe und 599 (95%) in der Kontrollgruppe hatten mindestens eine Nachuntersuchung und wurden in die modifizierte Intention-to-Treat-Analyse einbezogen. Die geschätzte mittlere Veränderung der Werte der neuropsychologischen Testbatterie nach zwei Jahren betrug 0,20 in der Interventionsgruppe und 0-16 in der Kontrollgruppe. Der Unterschied zwischen den Gruppen bei der Veränderung des Gesamtscores der neuropsychologischen Testbatterie pro Jahr betrug 0,022 (95% CI 0,002-0,042; p=0,030).
Fazit
Ein großer Teil der Patienten leidet nach einem Schlaganfall oder sogar einer TIA an Demenz oder leichteren Formen des kognitiven Verfalls. Eine Reihe von klinischen und radiologischen Parametern kann das Auftreten einer PSD vorhersagen. Obwohl das Risiko unmittelbar nach dem Schlaganfall am höchsten sein soll, bleibt es auch noch nach mehreren Jahren hoch. Das Vorhandensein dieser Verzögerung zwischen dem Zeitpunkt des Schlaganfalls und dem Ausbruch der Demenz ermöglicht es außerdem, ein therapeutisches Zeitfenster für die Intervention zu nutzen. Pharmakologische Studien haben gezeigt, dass eine langfristige Senkung des Blutdrucks nach einem Schlaganfall mit einem geringeren kognitiven Abbau verbunden ist. Kürzlich hat eine große randomisierte kontrollierte Studie gezeigt, dass eine Intervention in mehreren Bereichen die kognitiven Fähigkeiten von gefährdeten älteren Menschen verbessern oder erhalten kann. Diese Ergebnisse deuten auf den positiven Einfluss von Multikomponenten-Interventionen hin, die auf mehrere vaskuläre und lebensstilbedingte Risikofaktoren abzielen, auf das Auftreten von Demenz nach einem Schlaganfall.
Take-Home-Botschaften
- Schlaganfall-Überlebende haben ein erhöhtes Risiko, kognitive Beeinträchtigungen zu entwickeln.
- Die Demenz nach einem Schlaganfall (PSD) wird mit mehreren Faktoren in Verbindung gebracht, die einerseits auf eine verringerte kognitive Reserve hinweisen, einschließlich des kognitiven Rückgangs vor dem Schlaganfall, prämorbider Behinderung, Erkrankungen der weißen Substanz und zerebraler Atrophie, und andererseits auf spezifische Aspekte des Schlaganfalls.
- Die Magnetresonanztomographie (MRT) ist die wichtigste Modalität der Neurobildgebung.
- Obwohl eine große Anzahl von Biomarkern für PSD vorgeschlagen wurde, hat sich bisher kein spezifischer Parameter als robuste Vorhersage für PSD erwiesen.
- Pharmakologische Studien haben gezeigt, dass eine langfristige Senkung des Blutdrucks nach einem Schlaganfall mit einem geringeren kognitiven Abbau verbunden ist.
- Eine große randomisierte kontrollierte Studie hat vor kurzem ergeben, dass eine Intervention in mehreren Bereichen die kognitiven Fähigkeiten von gefährdeten älteren Menschen verbessern oder erhalten kann.
Referenzen:
- Strong K, Mathers C, et al: Schlaganfall-Prävention: Leben retten auf der ganzen Welt. Lancet Neurol. 2007; 6: 182-187.
- Lees R, Fearon P, Harrison JK, et al: Bewertung von Kognition und Stimmung in der Schlaganfallforschung: Fokussierter Überblick über aktuelle Studien. Schlaganfall. 2012; 43: 1678-1680.
- McKevitt C, Fudge N, et al: Selbstberichtete langfristige Bedürfnisse nach einem Schlaganfall. Schlaganfall. 2011; 42: 1398-1393.
- Pollock A, St. George B, et al: Die zehn wichtigsten Forschungsprioritäten für das Leben nach dem Schlaganfall. Lancet Neurol. 2012; 11: 209.
- Fride Y, Adamit T, et al: Was sind die Korrelate der Kognition und der Teilnahme an der Rückkehr zur Arbeit nach dem ersten leichten Schlaganfall? Top Schlaganfall Rehabil. 2015;22(5): 317-325.
- Ballard C, Rowan E, et al: Prospektive Follow-up-Studie zwischen 3 und 15 Monaten nach dem Schlaganfall: Verbesserungen und Verschlechterung der kognitiven Funktion bei Überlebenden eines Schlaganfalls ohne Demenz >75 Jahre. Schlaganfall 2003; 34: 2440-2444.
- Kalaria RN: Zerebrovaskuläre Erkrankungen und Mechanismen der kognitiven Beeinträchtigung: Erkenntnisse aus klinisch-pathologischen Studien am Menschen.Stroke 2012; 43: 2526-2534.
- Pendlebury ST, Rothwell PM: Prävalenz, Inzidenz und Faktoren im Zusammenhang mit Demenz vor und nach einem Schlaganfall: eine systematische Überprüfung und Meta-Analyse. Lancet Neurol. 2009; 8: 1006-1018.
- Pendlebury ST, Chen PJ, et al: Oxford Vascular Study. Methodische Faktoren bei der Bestimmung des Demenzrisikos nach einer transitorischen ischämischen Attacke und einem Schlaganfall: (I) Auswirkung der Baseline-Auswahlverzerrung. Schlaganfall. 2015; 46: 641-646.
- Henon H, Pasquier F, Leys D: Demenz nach Schlaganfall. Cerebrovasc Dis 2006; 22: 61-70.
- Mijajlović MD, Pavlović A, et al: Demenz nach Schlaganfall – eine umfassende Übersicht. BMC Med. 2017 Jan 18; 15(1):11.
- Kokmen E, Whisnant JP, et al: Demenz nach ischämischem Schlaganfall: eine bevölkerungsbasierte Studie in Rochester, Minnesota (1960-1984). Neurologie 1996; 46: 154-159.
- Van Rooij FG, Kessels RP, et al: Kognitive Beeinträchtigung bei Patienten mit transitorischen ischämischen Attacken: eine systematische Übersicht. Cerebrovasc Dis. 2016; 42(1-2): 1-9.
- Lees R, Selvarajah J et al.:Testgenauigkeit kognitiver Screening-Tests für die Diagnose von Demenz und kognitiver Beeinträchtigung in mehreren Bereichen bei Schlaganfall. Schlaganfall. 2014 Oct; 45(10): 3008-3018.
- Gottesman RF, Hillis AE: Prädiktoren und Bewertung der kognitiven Dysfunktion nach einem ischämischen Schlaganfall. Lancet Neurol 2010; 9: 895-905.
- Pasquier F, Hénon H, Leys D: Risikofaktoren und Mechanismen der Demenz nach einem Schlaganfall. Rev Neurol. 1999; 155(9): 749-753.
- Chaudhari TS, Verma R, et al: Klinisch-radiologische Prädiktoren der vaskulären kognitiven Beeinträchtigung (VCI) bei Patienten mit Schlaganfall: eine prospektive Beobachtungsstudie. J Neurol Sci. 2014 May 15; 340(1-2): 150-158.
- Arba F, Quinn T, et al: VISTA Kollaboration. Determinanten der kognitiven Beeinträchtigung nach einem Schlaganfall: Analyse von VISTA. Acta Neurol Scand. 2017 Jun; 135(6): 603-607.
- Iulita MF, Girouard H: Behandlung von Bluthochdruck zur Vorbeugung von kognitivem Verfall und Demenz: Re-Opening the Debate. Adv Exp Med Biol. 2017; 956: 447-473.
- Kalaria RN: Risikofaktoren und neurodegenerative Mechanismen bei schlaganfallbedingter Demenz. Panminerva Med. 2012 Sep; 54(3):139-148.
- Teuschl Y, Matz K, Brainin M: Prevention of post-stroke cognitive decline: a review focusing on lifestyle interventions. Eur J Neurol. 2013 Jan; 20(1): 35-49.
- Wardlaw JM, Smith EE, et al: Neuroimaging-Standards für die Erforschung von Erkrankungen der kleinen Gefäße und deren Beitrag zu Alterung und Neurodegeneration. Lancet Neurol 2013; 12: 822-838.
- Makin SD, Turpin S, et al: Kognitive Beeinträchtigung nach lakunärem Schlaganfall: Systematische Überprüfung und Meta-Analyse der Inzidenz, Prävalenz und Vergleich mit anderen Schlaganfall-Subtypen. J Neurol Neurosurg Psychiatry. 2013 Aug; 84(8): 893-900.
- Schmidt R, Ropele S, et al: Diffusionsgewichtete Bildgebung und Kognition in der Leukoariose- und Behinderungsstudie bei älteren Menschen. Schlaganfall 2010; 41: e402-e408.
- Blair GW, Hernandez MV, et al: Advanced Neuroimaging of Cerebral Small Vessel Disease. Curr Treat Options Cardiovasc Med. 2017 Jul; 19(7): 56.
- Wardlaw JM, Smith EE, et al: Neuroimaging-Standards für die Erforschung von Erkrankungen der kleinen Gefäße und deren Beitrag zu Alterung und Neurodegeneration. Lancet Neurol. 2013; 12: 822-838.
- Heiss W-D, Zimmermann-Meinzingen S: PET-Bildgebung in der Differentialdiagnose der vaskulären Demenz. J Neurol Sci 2012; 322: 268-273.
- Pavlovic AM, Pekmezovic T, et al: Baseline-Prädiktoren für den kognitiven Verfall bei Patienten mit zerebraler Kleingefäßerkrankung. J Alzheimers Dis. 2014; 42 Suppl 3: 37-43.
- Arba F, Quinn T, et al: VISTA. Zerebrale Erkrankung der kleinen Gefäße, Atrophie des medialen Temporallappens und kognitiver Status bei Patienten mit ischämischem Schlaganfall und transitorischer ischämischer Attacke. Eur J Neurol. 2017 Feb; 24(2): 276-282.
- Bu G: Apolipoprotein E und seine Rezeptoren bei der Alzheimer-Krankheit: Signalwege, Pathogenese und Therapie. Nat Rev Neurosci 2009; 10: 333-344.
- Davidson Y, Gibbons L et al: Häufigkeit des Apolipoprotein E epsilon4-Allels bei vaskulärer Demenz. Dement Geriatr Cogn Disord 2006; 22: 15-19.
- Hsiung G-YR, Sadovnick AD, Feldman H: Der Apolipoprotein E epsilon4-Genotyp als Risikofaktor für kognitiven Verfall und Demenz: Daten aus der Canadian Study of Health and Aging. CMAJ 2004; 171: 863-867.
- Mortimer JA, Snowdon DA, Markesbery WR: Die Wirkung von APOE-epsilon4 auf Demenz wird durch die Alzheimer-Neuropathologie vermittelt. Alzheimer Dis Assoc Disord 2009; 23: 152-157.
- Rippon GA, Tang MX, et al: Familiäre Alzheimer-Krankheit bei Latinos: Wechselwirkung zwischen APOE, Schlaganfall und Östrogenersatz. Neurologie 2006; 66: 35-40.
- Jin YP, Østbye T, et al: Gemeinsame Auswirkungen von Schlaganfall und APOE 4 auf das Demenzrisiko: die Canadian Study of Health and Aging. Neurologie 2008; 70: 9-16.
- Qian L, Ding L, et al: Frühe Biomarker für kognitive Beeinträchtigungen nach einem Schlaganfall. J Neurol 2012; 259: 2111-2118.
- Kolsch H, Jessen F, et al: Der ACE I/D-Polymorphismus ist ein Risikofaktor für die Alzheimer-Krankheit, aber nicht für vaskuläre Demenz. Neurosci Lett 2005; 377: 37-39.
- Hassan A, Lansbury A, et al: Angiotensin-Converting-Enzym-Insertion/Deletion-Genotyp ist mit Leukoaraiose bei lacunären Syndromen verbunden. J Neurol Neurosurg Psychiatry 2002; 72: 343-346.
- Szolnoki Z, Maasz A, et al: Koexistenz von Angiotensin-II-Typ-1-Rezeptor A1166C und Angiotensin-Converting-Enzym-D/D-Polymorphismus deutet auf Anfälligkeit für kleingefäßassoziierte ischämische Schlaganfälle hin. Neuromolekulare Medizin 2006; 8: 353-360.
- Bartres-Faz D, Junque C, et al: Polymorphismus des Angiotensin-II-Converting-Enzyms bei Menschen mit altersbedingten Gedächtnisstörungen: Beziehung zur kognitiven Leistung. Neurosci Lett 2000; 290: 177-180.
- Richard F, Berr C, et al: Auswirkung des Polymorphismus des Angiotensin-I-konvertierenden Enzyms I/D auf den kognitiven Abbau. Die EVA-Studiengruppe. Neurobiol Aging 2000; 21: 75-80.
- Bour AMJ, Rasquin SMC, et al: Die Auswirkung des APOE-epsilon4-Allels und des ACE-I/D-Polymorphismus auf die Kognition während einer zweijährigen Nachbeobachtungszeit bei Patienten mit erstem Schlaganfall. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Bour AMJJ, Rasquin SMC, et al: Die Auswirkung des APOE-epsilon4-Allels und des ACE-I/D-Polymorphismus auf die Kognition während einer zweijährigen Nachbeobachtungszeit bei Patienten mit erstem Schlaganfall. Dement Geriatr Cogn Disord 2010; 29: 534-542.
- Baum L, Chen X, et al: Polymorphismen und vaskuläre kognitive Beeinträchtigung nach einem ischämischen Schlaganfall. J Geriatr Psychiatry Neurol 2007; 20: 93-99.
- Hankey GJ, Ford AH et al: Wirkung von B-Vitaminen und der Senkung von Homocystein auf kognitive Beeinträchtigungen bei Patienten mit vorangegangenem Schlaganfall oder transitorischer ischämischer Attacke: eine vordefinierte Sekundäranalyse einer randomisierten, placebokontrollierten Studie und Metaanalyse. Schlaganfall 2013; 44: 2232-2239.
- Karlsson H, Ahlborg B, et al: Zusammenhang zwischen Blutsenkungsgeschwindigkeit und IQ bei schwedischen Männern im Alter von 18-20 Jahren. Brain Behav Immun 2010; 24: 868-873.
- Craft S: Die Rolle von Stoffwechselstörungen bei Alzheimer-Krankheit und vaskulärer Demenz: Zwei Wege führen zusammen. Arch Neurol 2009; 66: 300-305.
- Eikelenboom P, van Exel E, et al: Neuroinflammation – ein frühes Ereignis in der Geschichte und Pathogenese der Alzheimer-Krankheit. Neurodegener Dis 2010; 7: 38-41.
- Schram MT, Euser SM et al: Systemische Entzündungsmarker und kognitiver Abbau im Alter. J Am Geriatr Soc 2007; 55: 708-716.
- Hoth KF, Haley AP, et al: Erhöhtes C-reaktives Protein steht im Zusammenhang mit dem kognitiven Abbau bei älteren Erwachsenen mit Herz-Kreislauf-Erkrankungen. J Am Geriatr Soc 2008; 56: 1898-1903.
- Kliper E, Bashat DB et al: Kognitiver Abbau nach Schlaganfall: Beziehung zu Entzündungsbiomarkern und Hippocampusvolumen. Schlaganfall 2013; 44: 1433-1435.
- Rothenburg LS, Herrmann N, et al: Die Beziehung zwischen Entzündungsmarkern und kognitiver Beeinträchtigung nach einem Schlaganfall. J Geriatr Psychiatry Neurol 2010; 23: 199-205.
- Tzourio C, Anderson C, et al: Auswirkungen der Blutdrucksenkung mit Perindopril und Indapamid auf Demenz und kognitiven Abbau bei Patienten mit zerebrovaskulären Erkrankungen. Arch Intern Med 2003; 163: 1069-1075.
- Collins R, Armitage J: Heart Protection Study Collaborative Group. Auswirkungen der Cholesterinsenkung mit Simvastatin auf Schlaganfälle und andere schwerwiegende vaskuläre Ereignisse bei 20536 Menschen mit zerebrovaskulären Erkrankungen oder anderen Hochrisikofaktoren. Lancet 2004; 363: 757-767.
- Shepherd J, Blauw GJ, et al: Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360: 1623-1630.
- Kivipelto M, Solomon A, et al: Die finnische geriatrische Interventionsstudie zur Vorbeugung von kognitiven Beeinträchtigungen und Behinderungen (FINGER): Studiendesign und Verlauf. Alzheimers Dement 2013; 9: 657-665.
- Ngandu T, Lehtisalo J, et al: Eine 2-jährige Intervention mit Ernährung, Bewegung, kognitivem Training und Überwachung des vaskulären Risikos zur Vorbeugung des kognitiven Verfalls bei älteren Menschen mit erhöhtem Risiko (FINGER): eine randomisierte kontrollierte Studie. Lancet. 2015 Jun 6; 385(9984): 2255-2263.
- Carrie I, van Kan GA, et al: Rekrutierungsstrategien für Präventionsstudien. Die MAPT-Studie (MultiDomain Alzheimer Preventive Trial). J Nutr Health Aging 2012; 16: 355-359.
- Richard E, Van den Heuvel E, et al: Prävention von Demenz durch intensive vaskuläre Pflege (PreDIVA): eine laufende cluster-randomisierte Studie. Alzheimer Dis Assoc Disord 2009; 23: 198-204.
InFo NEUROLOGIE & PSYCHIATRIE 2018; 16(1): 31-37