
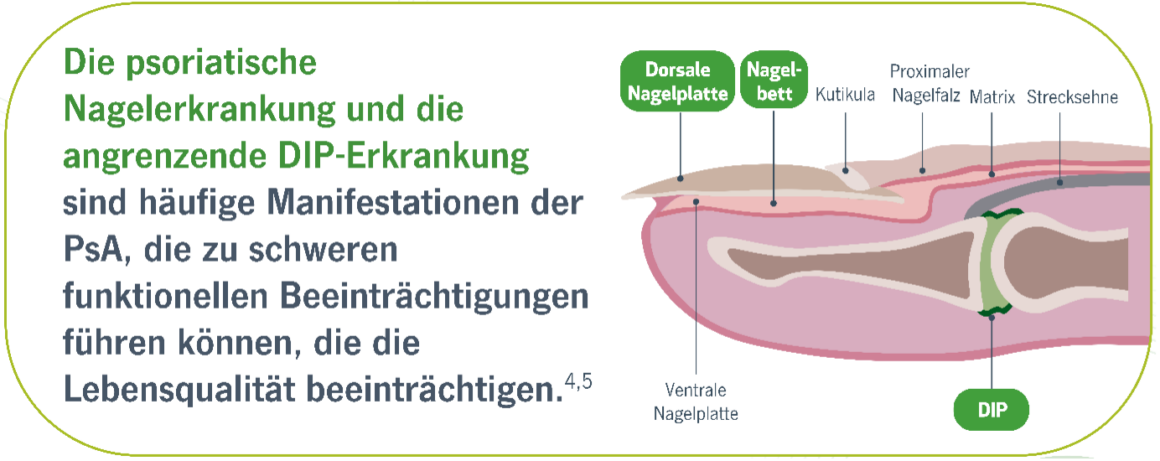
SPIRIT H2H: MEHR PATIENTEN die mit Taltz® behandelt wurden, zeigten eine RÜCKBILDUNG DER NAGELKRANKHEIT IN WOCHE 24 vs. ADALIMUMAB, mit einer anhaltenden Verbesserung bis Woche 522
Ziel
Ziel dieser Post-hoc-Analyse war es, die Wirkung von Taltz und ADA im Bereich der individuellen Finger in der Verbesserung der Nagel- und Gelenkerkrankung, bei Patienten mit PsA und gleichzeitiger Nagel- und DIP-Beteiligung zu bewerten.3
Methoden: SPIRIT-H2H Studiendesign3
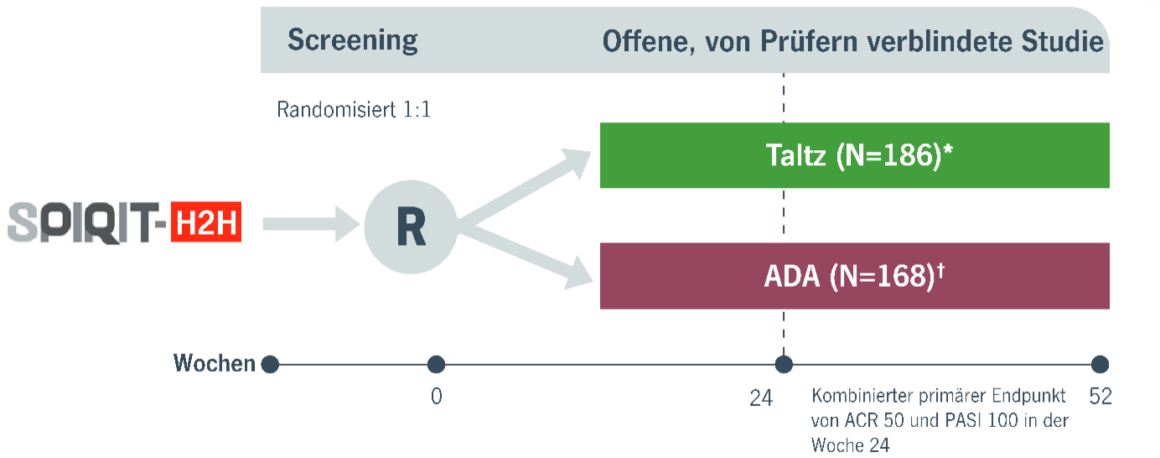
- Randomisierung stratifiziert nach csDMARD-Einsatz bei Studienbeginn und mäßiger bis schwerer Plaque-PsO‡ bei Studienbeginn
- On-Label-Dosierung auf der Grundlage des Vorhandenseins/Fehlens von mäßiger bis schwerer PsO
- Citratfreie Formulierung von ADA verwendet
Ergebnisse
Mit Taltz hatten weniger Patienten eine aktive Nagelerkrankung (NAPSI >0) an allen 10 Fingern in Woche 24, im Vergleich zu ADA§,¶ und zeigten eine anhaltende Verbesserung bis zu Woche 52.3
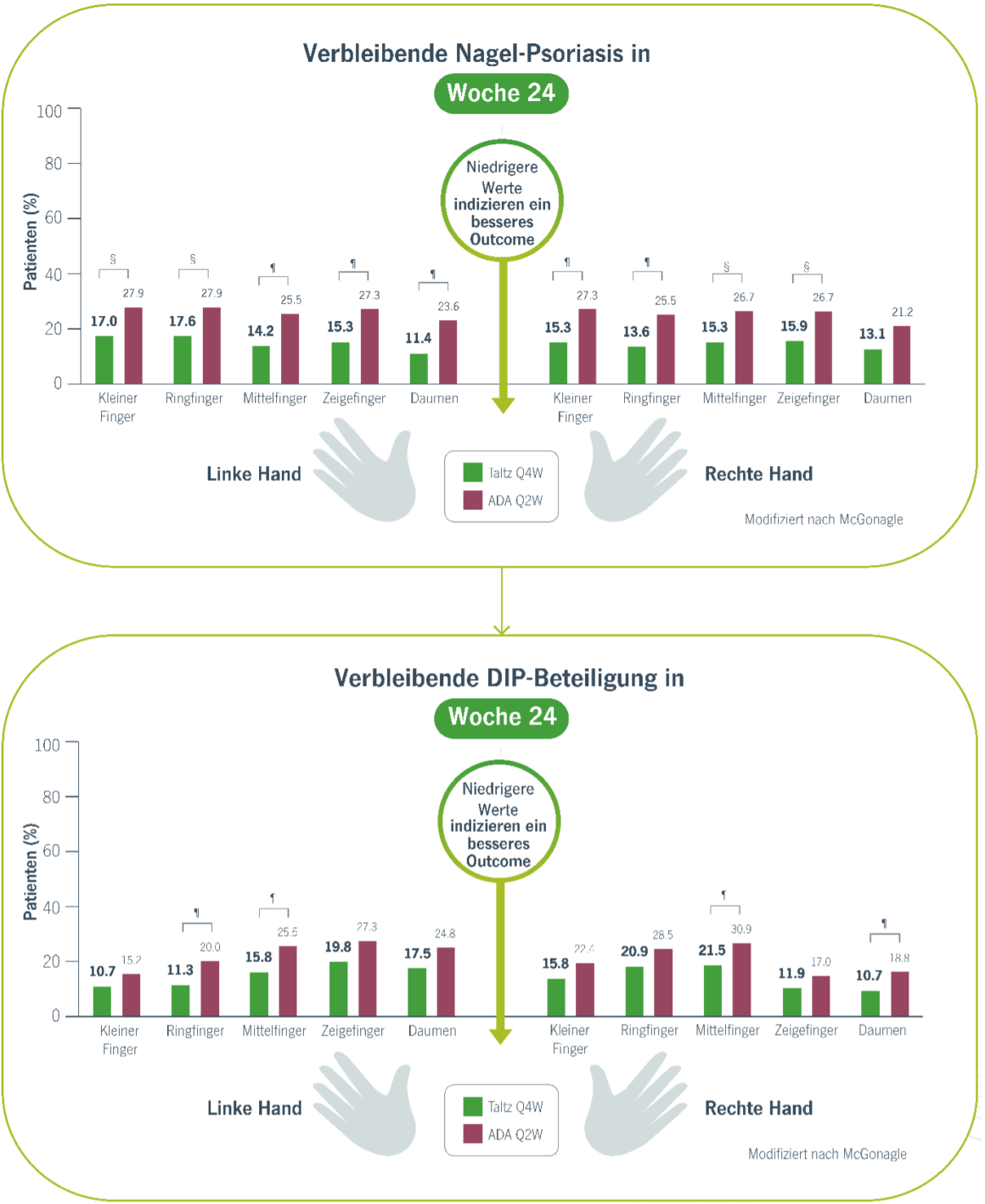
- Bei einem höheren Anteil der mit Taltz behandelten Patienten, war die Nagelerkrankung in Woche 24, im Vergleich zu ADA verschwunden und die Verbesserung hielt bis Woche 52 an.3
- Bei Patienten mit psoriatischer Nagelerkrankung und DIP-Arthritis war Taltz wirksamer bei der Beseitigung der Nagelerkrankung auf der Ebene der einzelnen Fingern.3
*Alle Patienten, denen Taltz verabreicht wurde, erhielten in Woche 0 eine Anfangsdosis von 160 mg; Patienten, die die Kriterien für mäßige bis schwere PsO erfüllten, erhielten Taltz Q2W von Woche 2-12 und danach Taltz Q4W; Patienten ohne mäßige bis schwere PsO erhielten Taltz Q4W ab Woche 4.
†Patienten, denen ADA verabreicht wurde und die die Kriterien für eine mittelschwere bis schwere PsO erfüllten, erhielten eine Anfangsdosis von 80 mg, gefolgt von einer Anfangsdosis von 40 mg Q2W in Woche 1; Patienten, denen ADA verabreicht wurde und die die Kriterien für eine mittelschwere bis schwere PsO nicht erfüllten, erhielten eine Anfangsdosis von 40 mg, gefolgt von 40 mg Q2W in Woche 2.
‡Mäßige bis schwere Plaque-PsO wurde definiert als PASI ≥12, sPGA ≥3 und BSA ≥10%.
§p<0.05 mit Fisher’s exact test.
¶p<0.01 mit Fisher’s exact test.
Die häufigsten berichteten unerwünschten Wirkungen waren Infektionen der oberen Atemwege (einschliesslich Nasopharyngitis und Pharyngitis) (38.7%)** und Reaktionen an der Injektionsstelle (19.2%)#. Die meisten Reaktionen waren von leichtem oder mittlerem Schweregrad.
** Häufigkeit in Plaque-Psoriasis; integrierte Häufigkeit für alle Indikationen beträgt 36.6 %
#Häufigkeit in axialer Spondyloarthritis; integrierte Häufigkeit für alle Indikationen beträgt 16.3 %
INDIKATIONEN1
Plaque-Psoriasis (PsO): Taltz® ist zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, die auf andere systemische Therapien (einschliesslich Ciclosporin oder Methotrexat oder PUVA) nicht angesprochen haben, bei denen diese Therapien kontraindiziert sind oder die diese Therapien nicht tolerieren.
Psoriasis Arthritis (PsA): Taltz®, allein oder in Kombination mit Methotrexat, ist angezeigt für die Behandlung erwachsener Patienten mit aktiver Psoriasis-Arthritis, die unzureichend auf eine oder mehrere krankheitsmodifizierende Antirheumatika (DMARD) angesprochen oder diese nicht vertragen haben.
Abkürzungen
ACR50, American College of Rheumatology Verbesserung um 50 % sowohl bei der Anzahl der Zarten als auch bei der Anzahl der geschwollenen Gelenke; ADA, adalimumab; BSA, body surface area; csDMARD,
conventional synthetic disease-modifying anti-rheumatic drug; DIP, distal interphalangeal joint; MTX, methotrexate; NAPSI, Nail Psoriasis Severity Index; PASI100, Psoriasis Area and Severity Index 100; PsA, Psoriasis Arthritis; PsO, Psoriasis; Q2W, jede zweite Woche; Q4W, jede vierte Woche; sPGA, Static Physician’s Global Assessment.
Taltz® (Ixekizumab) Injektionslösung
I: Zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei erwachsenen Patienten und bei Kindern und Jugendlichen ab 6 Jahren mit einem Körpergewicht von mindestens 25 kg , die auf andere systemische Therapien (einschliesslich Ciclosporin oder Methotrexat oder PUVA) nicht angesprochen haben, bei denen diese Therapien kontraindiziert sind oder die diese Therapien nicht tolerieren. Alleine oder in Kombination mit konventionellen krankheitsmodifizierenden Antirheumatika (DMARD), zur Behandlung erwachsener Patienten mit aktiver Psoriasis-Arthritis, die auf eine Behandlung mit einem oder mehreren DMARDs unzureichend angesprochen haben oder diese nicht vertragen haben. Zur Behandlung der schweren aktiven ankylosierenden Spondylitis bei erwachsenen Patienten, die auf eine konventionelle Therapie (z.B. nichtsteroidale entzündungshemmende Medikamente [NSAIDs]) unzureichend angesprochen haben oder diese nicht vertragen. Zur Behandlung der schweren aktiven nicht-radiographischen axialen Spondyloarthritis bei erwachsenen Patienten, die auf NSAIDs unzureichend angesprochen haben. Patienten sollten objektive Anzeichen einer Entzündung im Magnetresonanztomographie (MRT) und durch erhöhtes C-reaktives Protein (CRP) zeigen.
D: Subkutane Injektion. Plaque-Psoriasis bei Erwachsenen: 160 mg in Woche 0, gefolgt von 80 mg in den Wochen 2, 4, 6, 8, 10 und 12, und danach 80 mg alle 4 Wochen. Bei Patienten <100 kg kann ein alternatives Dosisschema mit 160 mg in Woche 0 und ab Woche 2 80 mg alle 4 Wochen erwogen werden. Plaque-Psoriasis bei Kindern und Jugendlichen (ab 6 Jahren): Gewicht > 50 Kg: 160 mg in Woche 0, gefolgt von 80 mg alle 4 Wochen; Gewicht 25-50 Kg: 80 mg in Woche 0, gefolgt von 40 mg alle 4 Wochen. Psoriasis-Arthritis: 160 mg in Woche 0, gefolgt von 80 mg alle 4 Wochen. Ankylosierende Spondylitis: 80 mg alle 4 Wochen.
KI: Schwere Überempfindlichkeit. Schwere aktive Infektionen (z. B. aktive Tuberkulose, Sepsis, schwere opportunistische Infektionen).
W/V: Vorsicht bei Patienten mit chronischer oder aktiver Infektion oder rezidivierenden Infektionen in der Vorgeschichte. Bei schwerwiegender Überempfindlichkeitsreaktion soll Taltz umgehend abgebrochen werden und eine geeignete Therapie eingeleitet werden. Taltz wird für Patienten mit einer entzündlichen Darmerkrankung nicht empfohlen. Wenn ein Patient Anzeichen und Symptome einer entzündlichen Darmerkrankung oder eine Exazerbation einer bereits existierenden entzündlichen Darmerkrankung entwickelt, soll Taltz abgesetzt und eine angemessene medizinische Behandlung eingeleitet werden. Vorsicht bei psychiatrischen Komorbiditäten (z.B. Depression). Vorsicht bei Patienten mit axSpa und Risiko für MACE. Taltz darf nicht zusammen mit Lebendimpfstoff verwendet werden. Die gleichzeitigeVerabreichung von Taltz mit anderen Biologika wird nicht empfohlen.
IA: Die Sicherheit von Taltz in Kombination mit anderen Immunmodulatoren oder Phototherapie sowie Impfungen mit Lebendimpfstoffen wurde nicht untersucht.
Sch/S: Während der Schwangerschaft und bei gebärfähigen Frauen, die keine wirksame Empfängnisverhütung verwenden, darf Taltz nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich. Patientinnen sollen angewiesen werden für mindestens 10 Wochen nach der letzten Gabe von Taltz wirksame Verhütungsmethoden anzuwenden und nicht zu stillen. Eine Entscheidung, entweder mit dem Stillen aufzuhören oder die Einnahme von Taltz abzubrechen, sollte unter Berücksichtigung der Vorteile des Stillens für das Kind und der Vorteile der Therapie für die Mutter gefällt werden.
UAW: Sehr häufig: Infektionen der oberen Atemwege, Reaktionen an der Injektionsstelle. Häufig: Tinea Infektion, Herpes simplex (mukokutan), orale Candidiasis, Rhinitis, Influenza, Konjunktivitis, oropharyngeale Schmerzen, Übelkeit, Diarrhö, erhöhte Leberenzyme, Urtikaria. Gelegentlich: anaphylaktische Reaktionen, oesophageale Candidiasis, Neutropenie, Thrombozytopenie, Morbus Crohn, Colitis Ulzerosa.. UAW, die im Vergleich zu Erwachsenen häufiger beobachtet wurden oder spezifisch bei Kindern und Jugendlichen auftraten: Sehr häufig: Überempfindlichkeitsreaktionen. Häufig: Neutropenie, Morbus Crohn, Dermatitis, Rash, Ekzem Fieber. Gelegentlich: Bronchospasmus.
P: Taltz 80 mg 1 oder 2 Fertigpen / 1 oder 2 Fertigspritze(n). Abgabekategorie B. Weitere Informationen finden Sie unter www.swissmedicinfo.ch.
Eli Lilly (Suisse) SA, ch. des Coquelicots 16, CP 580, 1214 Vernier (GE). V08-2023
Fachpersonen können die Referenzen beim Unternehmen jederzeit anfordern.
Referenzen:
1. Taltz® Fachinformation, www.swissmedicinfo.ch.
2. Smolen JS et al. Multicentre, randomised, open-label, parallel-group study evaluating the efficacy and safety of ixekizumab versus adalimumab in patients with psoriatic arthritis naïve to biological disease-modifying antirheumatic drug: final results by week 52. Ann Rheum Dis. 2020;79(10):1310-1319
3. McGonagle D. et al. Treatment Effects of Ixekizumab and Adalimumab at the Individual Digit Level With Nail and Distal Interphalangeal Joint Involvement in Patients With Psoriatic Arthritis. Ann Rheum Dis 2023;82:1124-1125. Poster POS1526 presented at EULAR, Milan, May 31 – Jun 3 2023
4. Lai T.L. et al. Psoriatic nail involvement and its relationship with distal interphalangeal joint disease. Clin Rheumatol. 2016; 35(8):2031-2037. Epub 2016 Jun 1. PMID: 27251673.
5. Krajewska-Włodarczyk M. et al. Distal interphalangeal joint extensor tendon enthesopathy in patients with nail psoriasis. Sci Rep. 2019; 9(1):3628.
Dieser Inhalt wurde von Eli Lilly and Company entwickelt, organisiert und finanziert.

© 2023 Eli Lilly (Suisse) SA,
Chemin des Coquelicots 16, P.O. 580, CH-1214 Vernier.
Alle Rechte vorbehalten.
Nur für medizinisches Fachpersonal in der Schweiz bestimmt.
Für weitere informationen zu unseren Lilly Produkten & Therapiegebieten kontaktieren sie bitte unsere Medizinische Information:
Servicezeiten: Montag-Freitag, 08:30-15:00 Uhr
Telefon: +41 44 654 57 52
E-mail: ch_medinfo@lilly.com
PP-IX-CH-1038/10.2023

