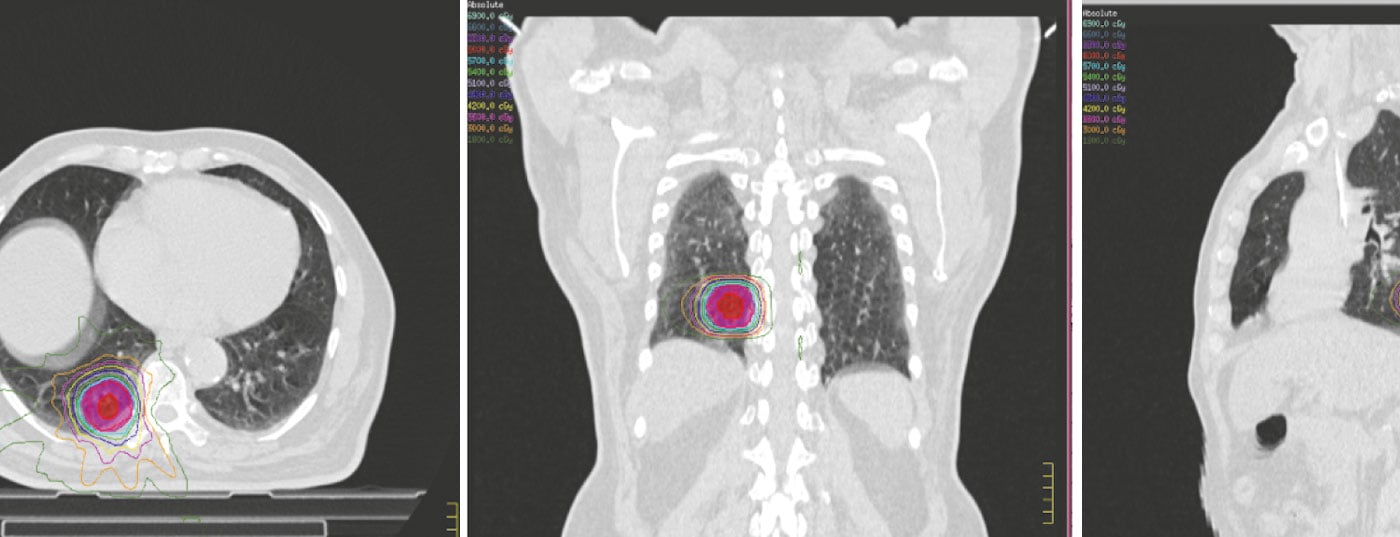
Die Strahlentherapie ist ein wesentlicher Bestandteil der Behandlung von NSCLC. Die jüngsten Fortschritte in der Strahlentherapie bei NSCLC beruhen sowohl auf technischen Fortschritten als auch auf dem besseren Verständnis der Strahlenbiologie in Bezug auf die Toleranzen von normalem Gewebe und die höchsten tolerierbaren maximalen Tumordosen. Die stereotaktische Körperbestrahlung ist jetzt eine akzeptable Behandlungsoption für peripher gelegenen NSCLC im Frühstadium bei Patienten, die für eine endgültige Operation nicht geeignet sind. Andere neuere Strategien umfassen die Erhöhung der Strahlendosis, die Verwendung von PET-CT-basierter Behandlungsplanung, isotoxische Strahlentherapie und die Verwendung von Partikelstrahltherapie.
Lungenkrebs ist eine der häufigsten Krebsarten, die weltweit gemeldet werden. Laut GLOBOCAN 2012 [1] wird geschätzt, dass Lungenkrebs mit einer Inzidenz von 16,7 % weltweit die häufigste Krebserkrankung bei Männern ist und auch die höchste jährliche krebsbedingte Sterblichkeit von 34,2 % verursacht. Bei Frauen liegt die Inzidenz bei 8,8% und die Sterblichkeit bei 13,8%. Die Inzidenz der altersstandardisierten Rate (ASR) für Männer und Frauen wurde mit 34,2 pro 100.000 bzw. 8,8 pro 100.000 angegeben. Für beide Geschlechter zusammen wurde Lungenkrebs als die tödlichste Krankheit mit der höchsten Sterblichkeit von 19,4 % aller bösartigen Erkrankungen angegeben.
Im Jahr 2012 berichtete das Nationale Institut für Krebsepidemiologie und -registrierung (NICER), dass in der Schweiz jährlich etwa 2500 bzw. 1200 neue Fälle bei Männern und Frauen entdeckt werden [2]. Damit ist Lungenkrebs die zweit- bzw. dritthäufigste Krebserkrankung bei Männern und Frauen in diesem Land. Im Zeitraum zwischen 1995-1999 und 2005-2009 hatte sich die prozentuale altersstandardisierte relative Überlebensrate für Männer und Frauen zusammen für das erste Jahr nach der Diagnose von 37,8 auf 44,5% und für das fünfte Jahr von 12,4 auf 15,9% verbessert. Es wurde festgestellt, dass die relative Überlebensrate bei Frauen während dieser beiden Zeiträume durchweg besser war als bei Männern.
Etwa 85-90% aller Lungenkrebsarten sind nicht-kleinzellige Lungenkarzinome (NSCLC). Eine frühzeitige Diagnose und verbesserte therapeutische Interventionen durch Chirurgie, Strahlen- und Chemotherapie könnten sicherlich zu den besseren Ergebnissen in diesem Zeitraum beigetragen haben. Die Chirurgie gilt nach wie vor als die primäre Behandlungsmethode für medizinisch fitte Patienten mit operablem NSCLC im Frühstadium. Die Chemotherapie verfügt inzwischen über eine Reihe neuer Chemotherapeutika und mehrere vielversprechende zielgerichtete Wirkstoffe. Die Strahlentherapie, eine Schlüsselkomponente bei der Behandlung dieser Krebsarten, hat in den letzten Jahren ebenfalls erhebliche technische Verbesserungen erfahren. Dieser Artikel soll einen Überblick über die verschiedenen Indikationen der Strahlentherapie in den verschiedenen Stadien des NSCLC geben und die jüngsten Entwicklungen auf dem Gebiet der Strahlentherapie für NSCLC diskutieren.
Optionen der Strahlentherapie bei NSCLC
Die verschiedenen Strahlentherapieoptionen, die bei nicht-kleinzelligem Lungenkrebs zum Einsatz kommen, hängen vom Stadium der Erkrankung, dem Allgemeinzustand des Patienten und der Verfügbarkeit von speziellen Strahlentherapieeinrichtungen in einer bestimmten Einrichtung ab. Auf der Grundlage der NCCN-, ESMO- und DEGRO-Leitlinien könnte die Strahlentherapie beim nicht-kleinzelligen Bronchialkarzinom also im Großen und Ganzen wie folgt eingesetzt werden (Abb. 1) [3–5]:
– Definitive oder radikale Strahlentherapie allein:
- a) Mit Photonen: 3D-konforme Strahlentherapie (3D CRT), intensitätsmodulierte Strahlentherapie (IMRT) oder volumetrisch modulierte Lichtbogentherapie (VMAT) unterstützt durch bildgeführte Strahlentherapie (IGRT) und stereotaktische Körperbestrahlung (SBRT). All dies kann mit verschiedenen Techniken der Atemwegskontrolle durchgeführt werden, die in einem bestimmten Zentrum zur Verfügung stehen;
- b) Protonenstrahltherapie
– Präoperative oder postoperative Strahlentherapie: mit der entsprechenden Technik wie oben angegeben
– Strahlentherapie in Kombination mit Chemotherapie: Begleitende Chemoradiotherapie (CTRT) oder sequentielle Anwendung der beiden Modalitäten
– Palliative Strahlentherapie mit externer Strahlentherapie oder intraluminaler Brachytherapie.

Die jüngsten Ansätze in der Strahlentherapie des nicht-kleinzelligen Bronchialkarzinoms (NSCLC) umfassen die Behandlungsplanung mit respiratorischem Gating, PET-CT-basierte Behandlungsplanung, Dosiseskalation mit veränderten Fraktionierungsstrategien, stereotaktische Körperbestrahlung (SBRT), isotoxische Strahlentherapieansätze und den Einsatz von Teilchenstrahlen – Protonen und Kohlenstoffionen – und werden in den folgenden Abschnitten zusammengefasst.
Behandlungsplanung und Beatmungstherapie
Die meisten Patienten werden in den verschiedenen multidisziplinären Tumorboards eingehend untersucht, um den optimalen Behandlungsansatz auf der Grundlage des Tumors und der Patientenmerkmale festzulegen. Sobald der Patient für eine Strahlentherapie in Frage kommt, durchläuft er eine Reihe von Schritten zur Planung der Strahlentherapie, die in erster Linie darauf abzielen, die Dosis für die kritischen Strukturen zu minimieren und gleichzeitig eine angemessene Dosis für den Tumor und die angrenzenden Knotenstationen zu liefern (Abb. 2).
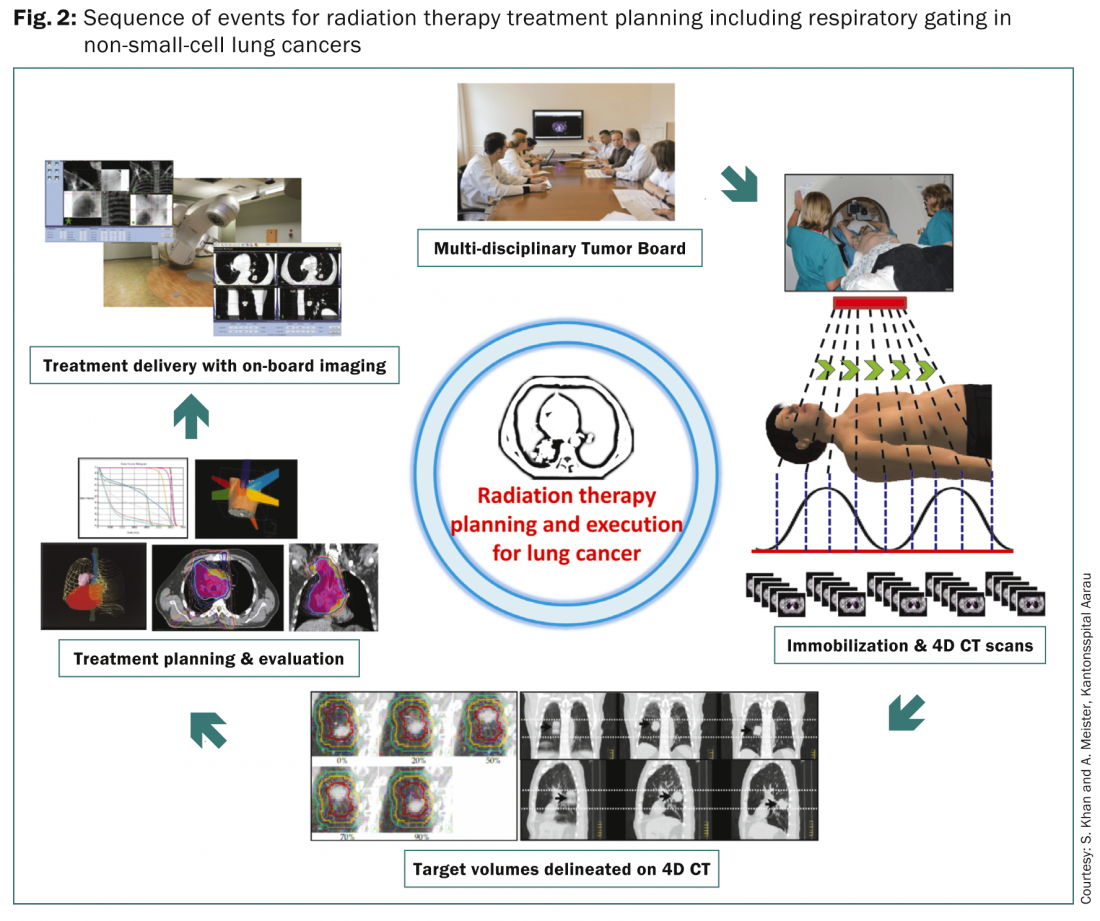
Da die Lungentumore den Atembewegungen folgen, müssen die Atembewegungen und die daraus resultierenden Verschiebungen der primären Läsion in der Lunge berücksichtigt werden. Zurzeit sind mehrere Methoden verfügbar. Dazu gehören die freie Atmung oder das nicht-interne Zielvolumen (Non-ITV) unter Verwendung einer Standard-CT-Simulation ohne 4D-CT oder Fusion von Einatmungs- oder Ausatmungs-Scans, die Atemanhalte- oder Gating-Non-ITV-Methode, bei der ein einzelnes 3D-CT-Bild bei einer vorher festgelegten Atmungsstufe aufgenommen wird, sowie die Verwendung von Bauchkompressionen während der CT; 4D-CT-Ansatz, bei dem mindestens zwei Sätze von 3D-CT-Bildern am Ende des Einatmens oder am Ende des Ausatmens und bis zu zehn Sätze von 3D-CT-Datensätzen, die den verschiedenen Stufen des Atmungszyklus entsprechen, erfasst werden. Das 4D-CT würde zur Definition der Zielvolumina verwendet, während ein separates CT mit freier Atmung für die Behandlungsplanung und die Dosisberechnung aufgenommen wird. Die resultierenden Zielvolumina werden in der Regel gemäß den ICRU-Berichten 62 und 83 [6,7] definiert. Eine ausführliche Diskussion darüber würde den Rahmen dieses Artikels sprengen. Interessierte Leser können sich in den ICRU-Berichten 62 und 83 einen umfassenden Überblick verschaffen.
Sobald die Zielvolumina und die gefährdeten Organe abgegrenzt sind, wird die Behandlungsplanung vorgenommen, um die Kombination von koplanaren oder nicht-koplanaren Strahlen mit unterschiedlichen Gewichtungen, Winkeln, Formen und Einschaltzeiten zu optimieren, je nach der zu verwendenden Behandlungstechnik – 3D CRT, IMRT und VMAT. Es werden eine definierte Strahlendosis und ein Fraktionierungsplan mit Dosisbeschränkungen für verschiedene Risikoorgane, insbesondere Lunge, Rückenmark, Speiseröhre, Plexus brachialis und Herz, festgelegt. Die verschiedenen alternativen Behandlungspläne werden einer sorgfältigen Bewertung unterzogen und der endgültige Plan wird auf der Grundlage der Bewertung der Dosis-Volumen-Histogramme für die Dosen für die Zielvolumina und die verschiedenen Risikoorgane ausgewählt. Die Behandlung erfolgt in der Regel unter sorgfältiger Aufsicht und wird entweder als freie Atmung, Atemanhalten oder Gating durchgeführt. All dies würde eine On-Board-Bildgebung erfordern, um die Fehler zwischen den Behandlungsplänen und ihrer täglichen Ausführung zu minimieren.
PET-CT-basierte Planung der Strahlenbehandlung
FDG PET-CT ist heute eine der routinemäßig eingesetzten Diagnosemethoden für das Staging von NSCLC. Aufgrund mehrerer Vorteile wird es auch für die Planung von Strahlenbehandlungen verwendet [8] (Abb. 3) .
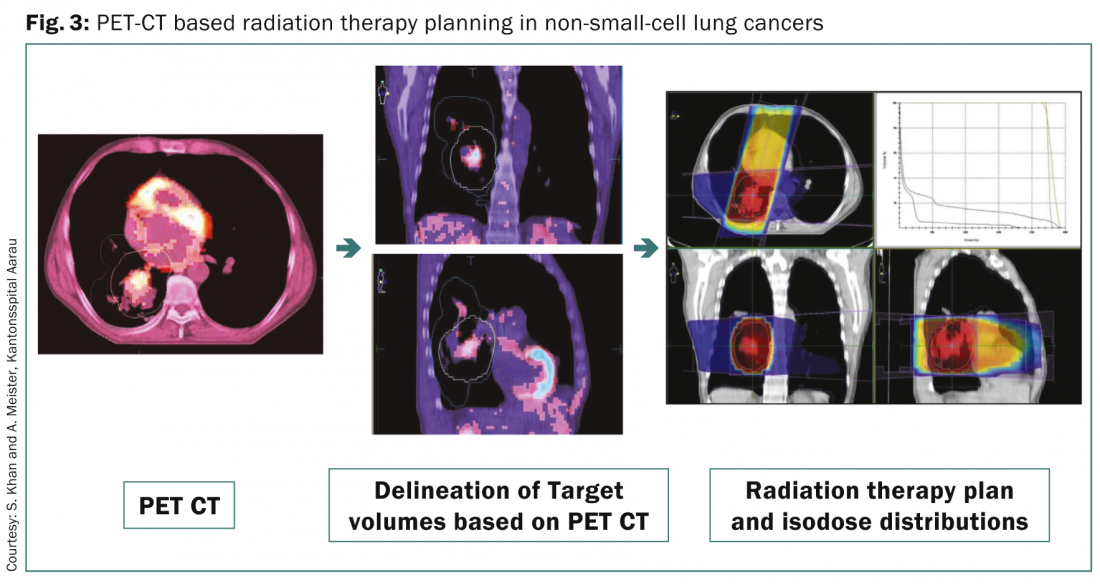
Dazu gehören die Abgrenzung der groben Zielvolumina in einer kollabierten Lunge, die Unterstützung bei der Identifizierung der betroffenen regionalen Lymphknoten für die Bestrahlung und die Planung des CTV, die Erkennung von extrathorakalen Krankheitsausbreitungen, die das Krankheitsstadium und den Behandlungsplan für die Dosiseskalation auf die grobe Erkrankung auf der Grundlage der durch FDG-PET gewonnenen anato-metabolischen Bilder verändern können. 4D-PET-CT hat sich auch als nützlich erwiesen für die genaue Lokalisierung von Patienten mit kleinen Tumoren, die eine atemabhängige Strahlentherapie benötigen, und für deren Planung.
Die klinischen Ergebnisse auf der Grundlage einer PET-CT-basierten Planung sind recht vielversprechend und scheinen eine geringe Inzidenz lokoregionaler Rezidive zu haben. In einer Studie mit 137 Patienten mit NSCLC im Stadium III betrug das lokoregionale Rezidiv bei Patienten, die mit PET-CT geplant wurden, 14,6% [9]. Die Ergebnisse einer Pilotstudie mit 32 Patienten berichteten über jeweils nur einen Patienten mit regionalem Versagen und lokaler Tumorprogression nach PET-CT-basierter gleichzeitiger Chemoradiotherapie [10]. Derzeit erforschen mehrere Gruppen in Europa und den USA den Einsatz von FDG-PET für die Strahlentherapie bei NSCLC (ClinicalTrials.gov Identifier: NCT01024829 und 01507428). Die Anwendung der PET-CT-basierten Planung könnte in zukünftigen Studien, die eine Dosiseskalation zu den Primärtumoren beinhalten, weiter ausgebaut werden. Dies könnte mit PET unter Verwendung von hypoxischen Tracern wie F-MISO, 18F-FAZA oder 18F-HX4 erfolgen, mit denen hypoxische, strahlenresistente Bereiche identifiziert werden können, die von einer selektiven Dosiseskalation besonders profitieren könnten [8].
Strategien zur Dosis-Eskalation und veränderten Fraktionierung
Dosis-Eskalationsstudien wurden durchgeführt, um die lokale Kontrolle zu verbessern, und es wurde gezeigt, dass sich das mediane Überleben von 20 auf 26 Monate verbessert, wenn die Dosis in mehreren kooperativen Phase I/II-Studien zusammen mit einer gleichzeitigen Chemoradiotherapie auf 74 Gy erhöht wird [11–13]. Die kürzlich berichteten Ergebnisse der Phase-III-Studie RTOG 0617, in der Patienten mit 74 Gy in 37 Fraktionen gegenüber dem Standard 60 Gy in 30 Fraktionen mit wöchentlichem Paclitaxel/Carboplatin mit oder ohne Cetuximab randomisiert wurden, zeigten jedoch keinen Vorteil von 74 Gy [14]. Überraschenderweise waren die lokalen und lokoregionalen Misserfolge in der Gruppe mit der höheren Dosis schlimmer, obwohl die Toxizitäten zwischen den beiden Gruppen vergleichbar waren. Mögliche Gründe hierfür könnten eine höhere Herzdosis und die längere Gesamtbehandlungsdauer im Hochdosis-Arm sein. Der Abschlussbericht und die möglichen Gründe für die ausbleibende Verbesserung bei höheren Dosen werden derzeit untersucht.
Veränderte Fraktionierungsschemata mit Hyperfraktionierung (z.B. CHART: 54 Gy in drei täglichen Fraktionen von 1,5 Gy an zwölf aufeinanderfolgenden Tagen) wurden ebenfalls bei NSCLC erforscht und randomisierte Studien haben einen Überlebensvorteil gegenüber konventionellen Fraktionierungsschemata gezeigt [15–17]. Die Regelung ist jedoch logistisch schwierig umzusetzen, auch wenn sie verspricht, die Überlebenschancen zu verbessern.
Mit der Verfügbarkeit von PET-CT-gestützter Behandlungsplanung und modernsten Strahlentherapieverfahren werden derzeit hypofraktionierte Bestrahlungspläne mit höheren Dosen als den standardmäßigen 2 Gy pro Fraktion erforscht und haben sich bei Tumoren im Frühstadium als vielversprechend erwiesen, was zu einem medianen Überleben von 38,5 Monaten geführt hat [18]. Diese haben dazu geführt, dass sie in der stereotaktischen Körperbestrahlung bei NSCLC im Frühstadium eingesetzt werden, insbesondere bei Patienten, die aus medizinischer Sicht nicht für eine Operation geeignet sind.
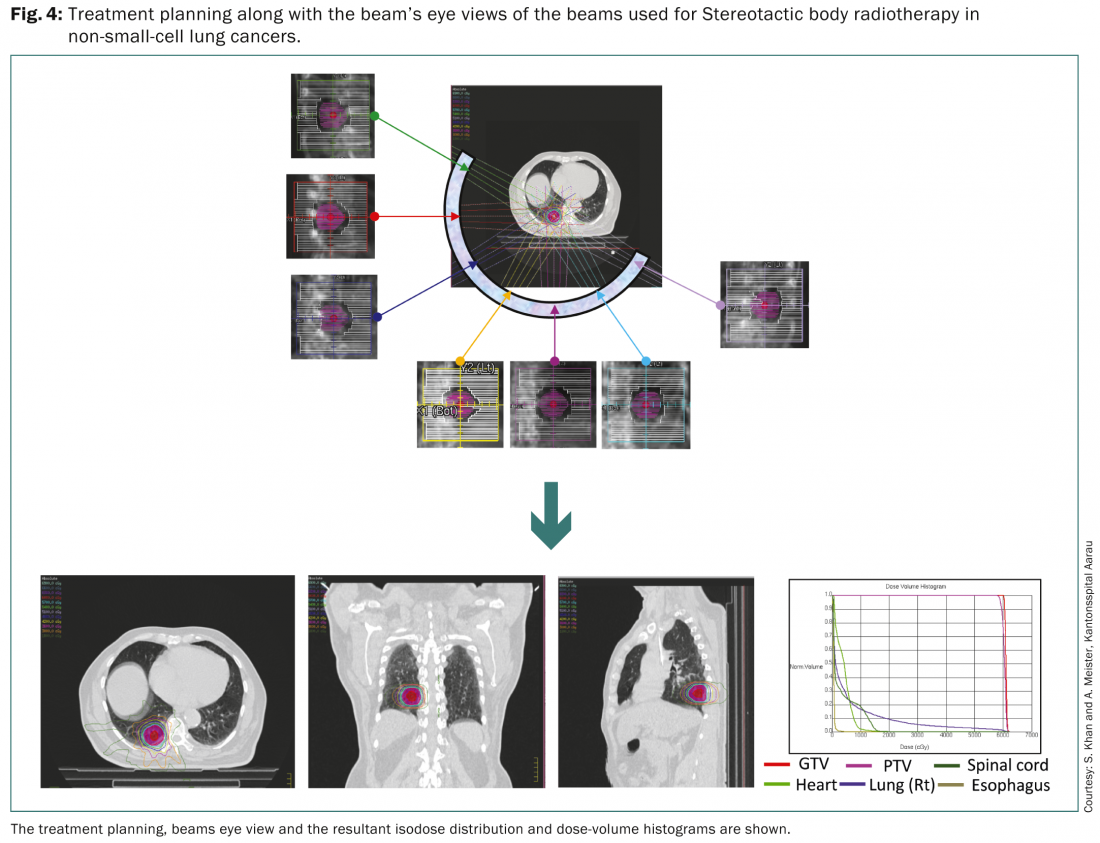
Stereotaktische Körper-Strahlentherapie (SBRT)
Die SBRT ermöglicht die präzise Verabreichung einer hohen Strahlendosis an kleine Tumorvolumina und erlaubt die Durchführung einer hyperfraktionierten Hochdosis-Strahlentherapie. Laut der Europäischen Organisation für Forschung und Behandlung von Krebs (EORTC) ist die SBRT ein geeigneter Ansatz für Patienten mit knotennegativen, peripheren Läsionen von weniger als 6 cm und könnte bei älteren Patienten eingesetzt werden, die nicht für eine Operation geeignet sind [19]. Sie könnte auch bei Patienten angewendet werden, die sich zuvor einer Pneumonektomie unterzogen hatten. Für die Abgrenzung der verschiedenen Zielvolumina wird ein Atemgating zusammen mit einer Behandlungsplanung auf der Basis von FDG PET-CT empfohlen.
In einer systematischen Übersichtsarbeit von Soldà et al. wurden die Ergebnisse mit einer chirurgischen Kohorte aus einer Serie von 45 Berichten verglichen, die 3771 Patienten umfasste [20]. Es wurde über eine breite Palette von Dosisfraktionierungsschemata berichtet. Diese reichten von 30 Gy in einer einzigen Fraktion bis zu 45-72,5 Gy in drei bis zehn Fraktionen. Die 2-Jahres-Überlebensrate für 3201 Patienten mit NSCLC im Stadium I mit SBRT betrug 70% mit einer 2-Jahres-Lokalkontrolle von 91%. Dies ist ein guter Vergleich mit einer 2-Jahres-Überlebensrate von 68% bei 2038 Patienten im Stadium I, die mit einer Operation behandelt wurden. Es gab keinen Unterschied im Überleben oder im lokalen progressionsfreien Überleben zwischen Patienten, die mit verschiedenen Strahlentherapietechniken für SBRT behandelt wurden.
Eine kürzlich veröffentlichte Meta-Analyse wurde an 4850 Patienten aus 40 SBRT-Studien durchgeführt und mit den chirurgischen Ergebnissen aus 23 Studien mit 7071 Patienten im Stadium I des NSCLC verglichen [21]. Das Durchschnittsalter der Patienten, die sich einer SBRT unterzogen, war mit 74 bzw. 66 Jahren niedriger als in der chirurgischen Serie. Bereinigt um den Anteil der operablen Patienten und das Alter, unterschieden sich das Gesamtüberleben, das krankheitsfreie Überleben und die lokale Kontrolle nicht signifikant zwischen SBRT und Operation. Die Autoren kamen zu dem Schluss, dass chirurgische Verfahren nach wie vor der derzeitige Behandlungsstandard für medizinisch operable Patienten sind. Für Patienten, die medizinisch nicht geeignet sind oder eine Operation ablehnen, sollte die SBRT aufgrund ihrer nachgewiesenen Wirksamkeit und geringen Toxizität als Standardbehandlung angeboten werden.
Die SBRT wird in der Regel für periphere Tumore empfohlen. Ihr Einsatz bei zentral gelegenen Tumoren ist wegen des zu erwartenden höheren Toxizitätsrisikos noch ungewiss. Die Ergebnisse der SBRT bei 90 Patienten mit zentralem (50%) und peripherem (56%) NSCLC im Stadium I wurden aus einer kombinierten Datenbank von 13 deutschen und österreichischen akademischen Strahlentherapiezentren [22] berichtet. Periphere Tumore hatten eine höhere biologisch wirksame Dosis (BED10) erhalten (72 Gy für zentrale vs. 84 Gy für periphere Tumore). Das versicherungsmathematische 3-Jahres-Gesamtüberleben betrug 29% bei zentralen gegenüber 51% bei peripheren Tumoren (p<0,001), während die entsprechende Freiheit für eine lokale Progression 52% bzw. 84% betrug (p<0,001). Es wurden keine signifikanten Unterschiede bei den behandlungsbedingten Toxizitäten festgestellt. Diese Ergebnisse deuten zwar darauf hin, dass zentrale Tumore mit SBRT behandelt werden könnten, aber die Ergebnisse sind vielleicht durch eine geringere Dosis bei zentralen Tumoren begrenzt.
Somit ist die SBRT bei Lungenkrebs ein praktikabler Behandlungsansatz für periphere Tumore bis zu 6 cm und könnte als Alternative für Patienten in Betracht gezogen werden, die aus medizinischer Sicht für eine Operation nicht geeignet sind [3–5]. Eine BED von >100Gy, die in der umfassenden Isodosis verschrieben wird, ist normalerweise wünschenswert, um optimale Ergebnisse zu erzielen.
Isotoxische oder personalisierte Strahlentherapie
Die isotoxische oder personalisierte Strahlentherapie beinhaltet die Verabreichung von Strahlendosen, die auf den Einschränkungen des normalen Gewebes des einzelnen Patienten basieren. In der heutigen Praxis der Strahlentherapie werden individuell geformte Strahlen eingesetzt, die an die Tumordimensionen jedes einzelnen Patienten angepasst sind, was einen Schritt in Richtung einer individualisierten Strahlenbehandlungsplanung darstellt. Die individualisierte Behandlung könnte jedoch auch auf die höchste tolerierbare Gesamttumordosis (TTD) ausgedehnt werden, die bei einem bestimmten Patienten unter Berücksichtigung der Einschränkungen des normalen Gewebes verabreicht und toleriert werden kann. Baardwijk et al. stellten die Hypothese auf, dass der beste erreichbare Bestrahlungsplan die höchste TTD auf der Grundlage individueller Beschränkungen der Normalgewebedosis in einer Gesamtbehandlungszeit von weniger als fünf Wochen umfassen würde [23]. Sie konnten die Durchführbarkeit des Verfahrens nachweisen und verabreichten eine mittlere Tumordosis von 63 Gy (Bereich 46,8-79,2 Gy) bei medizinisch inoperablen Patienten mit lokal fortgeschrittenem NSCLC mit akzeptabler akuter und später Gewebetoxizität. Sie erreichten ein vollständiges Ansprechen auf den Stoffwechsel bei 44% der Patienten mit einer 1-Jahres-Gesamtüberlebensrate von 57,1%. Zurzeit laufen mehrere Studien an verschiedenen Zentren in Großbritannien und Europa.
Reymen et al. berichteten kürzlich über die Ergebnisse einer individualisierten isotoxischen akzelerierten Strahlentherapie (INDAR) und Chemotherapie bei NSCLC in den Stadien T4N0-1 und Einzelknotenstation IIIA-N2 [24]. 83 Patienten wurden mit einer medianen Dosis von 65 Gy (43,5-72 Gy) in einer medianen Gesamtbehandlungszeit von 30 Tagen (17-48 Tage) behandelt. Die Behandlung bestand aus 30 Fraktionen von 1,5 Gy zweimal täglich, gefolgt von 2 Gy pro Fraktion bis zu einer maximalen TTD, die durch die Einschränkungen des normalen Gewebes begrenzt wurde. 52 Patienten erhielten eine gleichzeitige, 31 eine sequenzielle Chemotherapie zusammen mit INDAR. Die Gesamtüberlebensrate für T4N0-1 nach 2 und 5 Jahren betrug 55 bzw. 25%, während die entsprechende Überlebensrate für IIIA-N2 53 bzw. 24% betrug. Die schwerwiegendste beobachtete Nebenwirkung war eine Ösophagitis des Grades 3 bei sieben Patienten, die jedoch alle mit einer konservativen Behandlung behoben werden konnten.
Diese Ergebnisse deuten darauf hin, dass die isotoxische Strahlentherapie mit individualisierten Dosisvorgaben die Ergebnisse dieser lokal fortgeschrittenen inoperablen Tumore weiter verbessern und ein langfristiges Überleben mit geringer Morbidität erreichen könnte. Eine weitere Dosiseskalation mit verbesserter Strahlentherapieplanung und -verabreichung, neuartigen Chemotherapeutika oder biologisch gezielten Wirkstoffen oder sogar eine Kombination mit der Chirurgie könnte in zukünftigen Studien zur isotoxischen Strahlentherapie sicherlich erforscht werden.
Teilchenstrahltherapie – Protonen- und Kohlenstoffstrahltherapie
Der charakteristische Bragg-Peak (niedrige Dosis beim Eintritt in den Strahl und ein schneller Abfall bei maximaler Dosisdeposition) bietet einen einzigartigen dosimetrischen Vorteil von Protonen- und Kohlenstoffstrahlen gegenüber den Photonen [25]. Obwohl man annimmt, dass Photonen den Protonen nahezu ähnlich sind, haben Kohlenstoff-Ionen aufgrund ihrer hohen linearen Energietransfereigenschaften einen radiobiologischen Vorteil gegenüber Protonen und Photonen. Theoretisch könnten die Protonen- und Kohlenstoffionen-Dosisverteilungen also konformer an die Zielvolumina angepasst werden, mit geringeren integralen Dosen im Vergleich zur photonenbasierten Strahlentherapie.
Eine Reihe von Phase I/II-Studien mit Partikelstrahlen haben sich bei NSCLC im Stadium I als sicher und wirksam erwiesen. Eine von Grutters et al. durchgeführte Meta-Analyse hat die vergleichende Wirksamkeit von Protonen, Photonen und Kohlenstoffen [26] untersucht. Das korrigierte 2-Jahres-Gesamtüberleben betrug 53% für die konventionelle Photonen-Strahlentherapie, 70% für SBRT, 61% für Protonen und 74% für Kohlenstoff. Nach 5 Jahren war die Gesamtüberlebensrate bei der konventionellen Strahlentherapie (20%) signifikant niedriger als bei der SBRT (42%), der Protonen- (40%) und der Kohlenstoffionen-Therapie (42%). Es scheint also, dass die Ergebnisse der Partikeltherapie zwar besser sind als die der konventionellen Photonenbestrahlung, aber immer noch mit denen der SBRT vergleichbar sind. Es wird vermutet, dass die Partikeltherapie beim nicht-kleinzelligen Lungenkrebs im Stadium III, bei dem die 2-Jahres-Gesamtüberlebensrate mit konventioneller Chemoradiotherapie auf nur 26-36% sinkt, möglicherweise von größerem Nutzen sein könnte [26].
In einem kürzlich erschienenen Bericht von Chang et al. wurde hervorgehoben, dass die intensitätsmodulierte Protonentherapie (IMPT) zusammen mit einem 4D-CT-basierten Atemwegsmanagement bei NSCLC durchführbar ist. In einer Pilotstudie mit 34 konsekutiven Patienten wurde festgestellt, dass IMPT mit respiratorischem Gating zu einer signifikanten Reduzierung aller betrachteten dosimetrischen Parameter im Vergleich zur Standard-IMRT führt [27].
Mit der Zunahme von Protonenstrahlanlagen, der Einführung der intensitätsmodulierten Protonentherapie (IMPT) und der On-Board-Volumenbildführung könnten sich die Ergebnisse der Protonentherapie verbessern, obwohl dies noch durch randomisierte Studien mit SBRT bestätigt werden muss.
Schlussfolgerungen
Der nicht-kleinzellige Lungenkrebs (NSCLC) stellt für die behandelnden Onkologen nach wie vor eine Herausforderung dar, die bestmöglichen Optionen aus einer Kombination von Operation, Strahlentherapie und Chemotherapie zu integrieren. Selbst mit den neuesten Entwicklungen bei jeder dieser Modalitäten sind sowohl die lokale Kontrolle als auch die Gesamtüberlebensrate für die behandelnden Onkologen weiterhin von Bedeutung.
Die gegenwärtigen technologischen Entwicklungen in der Strahlentherapie haben zusammen mit dem Verständnis der strahlenbiologischen Auswirkungen der verschiedenen Dosisfraktionsschemata sicherlich eine sicherere und präzisere Durchführung der Strahlentherapie ermöglicht. Dies hat die verschiedenen Optionen wie SBRT, isotoxische Strahlentherapie, Partikelstrahl usw. als mögliche Alternative für eine ausgewählte Gruppe von Patienten eröffnet. Die Integration mit anderen Modalitäten wie Chemotherapeutika und den neu entwickelten molekularen zielgerichteten Therapien muss jedoch weiter untersucht werden, und zwar sowohl auf der Grundlage von Evidenz als auch von personalisierter Medizin, um die gewünschten Ergebnisse zu erzielen.
Prof. Dr. med. Niloy Ranjan Datta
Dr. med. Silvia Gómez Ordóñez
Prof. Dr. med. Stephan Bodis
Literatur:
- Ferlay J, et al.: GLOBOCAN 2012 v1.0, Krebsinzidenz und -sterblichkeit weltweit: IARC Cancer Base No. 11 [Internet]. Lyon, Frankreich: International Agency for Research on Cancer; 2013. Verfügbar unter: http://globocan.iarc.fr.
- Bordoni A, et al: Trends bei der Überlebensrate von Lungenkrebs in der Schweiz. Schweizer Krebsbulletin 2012; 3. Verfügbar unter: www.nicer.org/assets/files/skb_3-2012_nicer_lung_cancer_survival_in_ch.pdf.
- Vansteenkiste J, et al: Annl Oncol 2013; 24(suppl 6): vi89-vi98.
- NCCN Leitlinien für die klinische Praxis in der Onkologie: Nicht-kleinzelliger Lungenkrebs, Version 4. 2014. Verfügbar unter: www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- Deutsche Gesellschaft für Radioonkologie (DEGRO): Leitlinien für die extrakranielle stereotaktische Strahlentherapie. Verfügbar unter: www.degro.org/dav/html/download/pdf/ESRT_Leitlinie.pdf.
- International Commission on Radiation Units and Measurements: Prescribing, Recording and Reporting Photon Beam Therapy (Supplement to ICRU Report 50), ICRU Report 62, Bethesda, MD, 1999.
- International Commission on Radiation Units and Measurements: Prescribing, Recording and Reporting Photon Beam Intensity Modulated Radiation Therapy, ICRU Report 83, Bethesda, MD, 2010.
- Chi A, Nguyen NP: Front Oncol 2014 Oct 7; 4: 273.
- van Baardwijk A, et al: Eur J Cancer 2012; 48: 2339-2346.
- Fleckenstein J, et al: Int J Radiat Oncol Biol Phys 2011; 81: e282-289.
- Bradley JD, et al: Int J Radiat Oncol Biol Phys 2010; 77: 367-372.
- Schild SE, et al: Int J Radiat Oncol Biol Phys 2006; 65: 1106-1111.
- Sociniski MA, et al: J Clin Oncol 2008; 26: 2457-2463.
- Bradley J, et al: J Clin Oncol 2013; 31(15): 7501.
- Belani CP, et al: J Clin Oncol 2005; 23: 3760-3767.
- Hatton M, et al: Int J Radiat Oncol Biol Phys 2011; 81: 712-718.
- Saunders M, et al: Lancet 1977; 350: 161-165.
- Bogart JA, et al: J Clin Oncol 2010; 28: 202-206.
- Ruysscher DD, et al: J Clin Oncol 2010; 28: 5301-5310.
- Soldà F, et al: Radiother Oncol 2013; 109: 1-7.
- Zheng X, et al: Int J Radiat Oncol Biol Phys 2014; 90: 603-611.
- Schanne DH, et al.: Strahlenther Onkol 2014, doi: 10.1007/s00066-014-0739-5.
- van Baardwijk A, et al: Int J Radiat Oncol Biol Phys 2008; 71: 1394-1401.
- Reymen B, et al: Radiother Oncol 2014; 110: 482-487.
- Grant JD, Chang JY: Biomed Res Int 2014: 389048. doi: 10.1155/2014/389048.
- Grutters JPC, et al: Radiother Oncol 2010; 95: 32-40.
- Chang JY, et al: Int J Radiat Oncol Biol Phys 2014; 90: 809-818.
InFo ONKOLOGIE & HÄMATOLOGIE 2015; 3(1): 6-12