Wie wichtig sind Schmerzen für Patienten mit SpA?
– Sponsored Content –
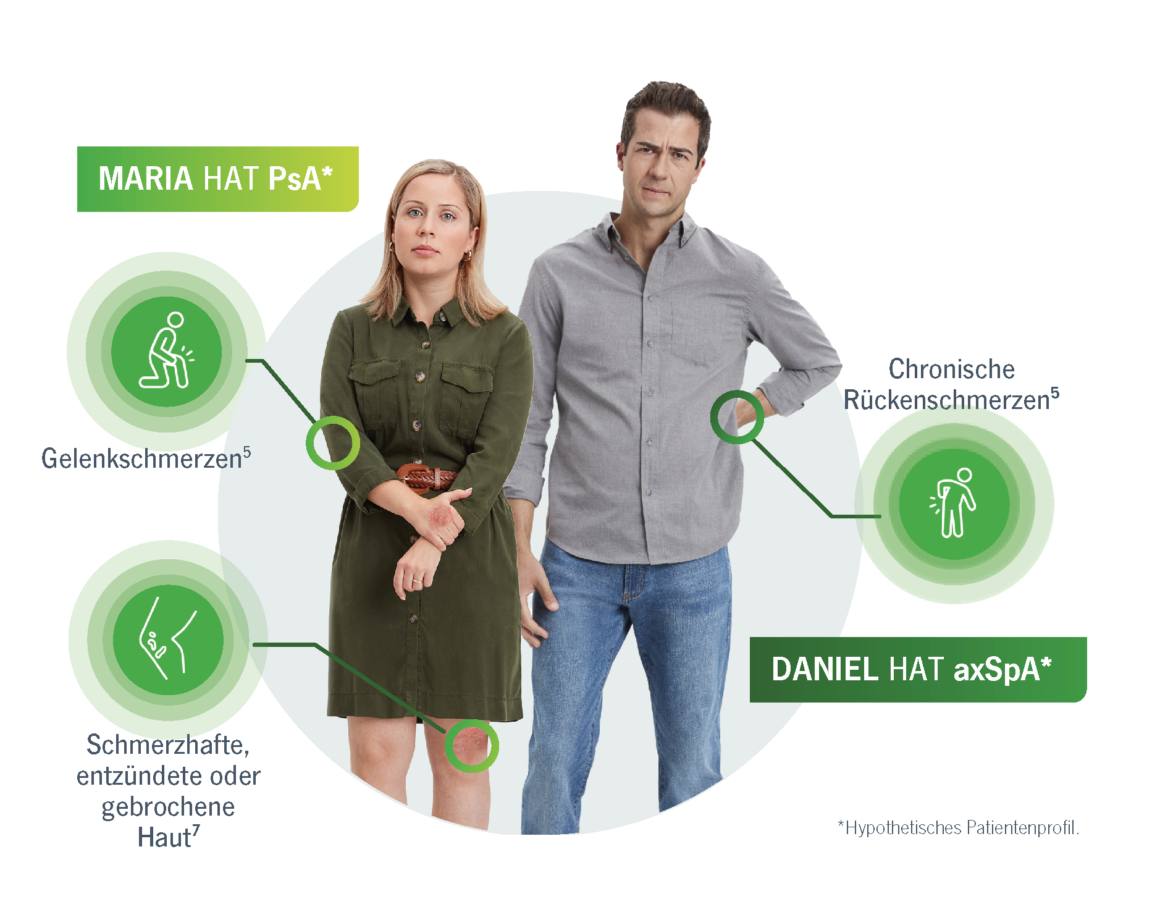
PsA und axSpA haben viele Symptome gemeinsam, darunter auch Schmerzen, die für Patienten mit SpA eine erhebliche körperliche und emotionale Belastung darstellen können.5
Patienten und Rheumatologen stimmen zu, dass Gelenkschmerzen ein wichtiger Faktor für die Schwere der Erkrankung sind.6
In diesem Artikel erkunden wir, wie Taltz® die Schmerzsymptome bei Patienten mit PsA und axSpA schnell verbessern kann und wie diese Wirkung angehalten wird.1-4
Schauen Sie ein kurzes Video an, in dem Prof. Carlo Selmi erläutert, wie Taltz Schmerzen bei Patienten mit PsA und axSpA lindern kann.
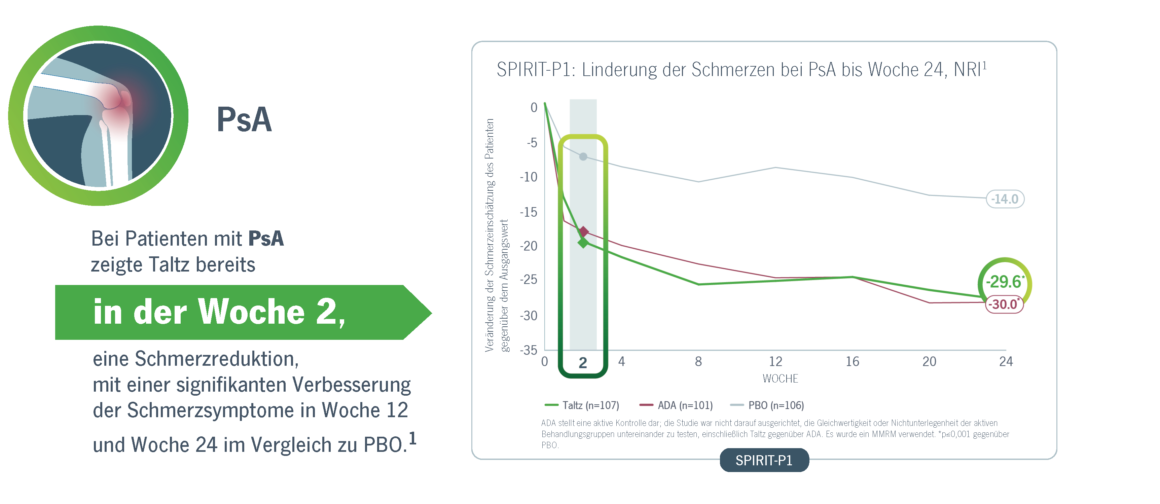
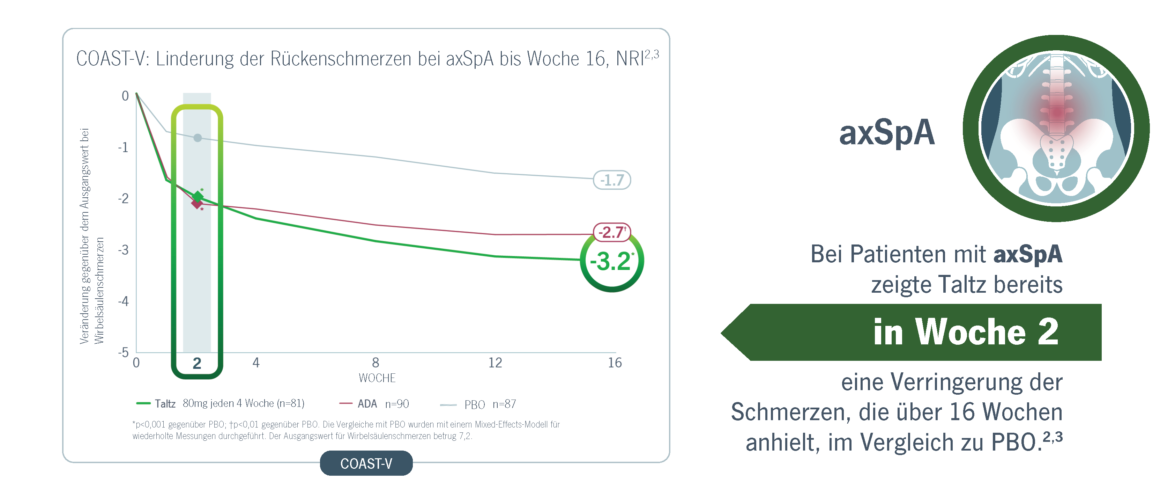
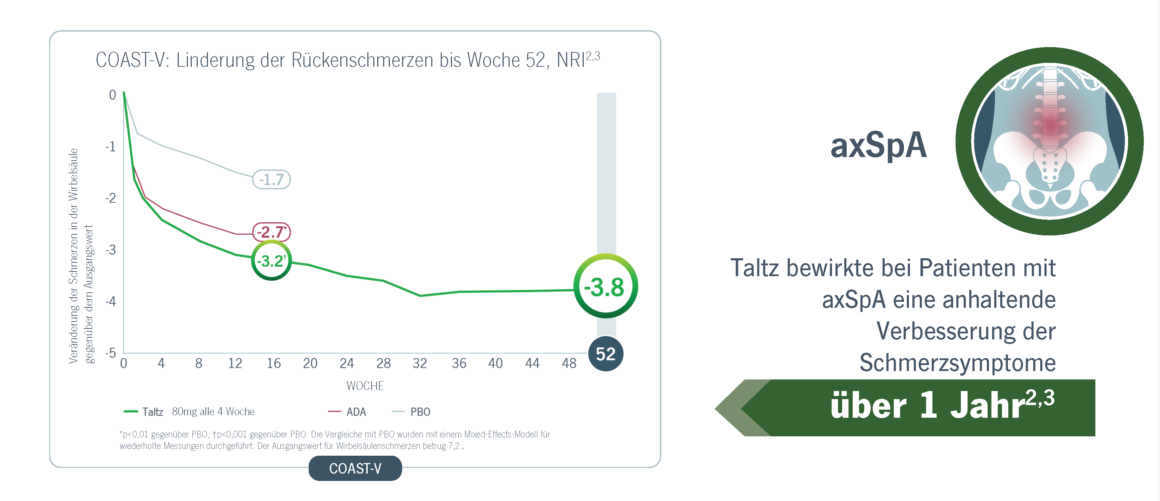
Taltz erreichte eine signifikante und schnelle Verbesserungen der Schmerzen bei Patienten mit PsA und axSpA

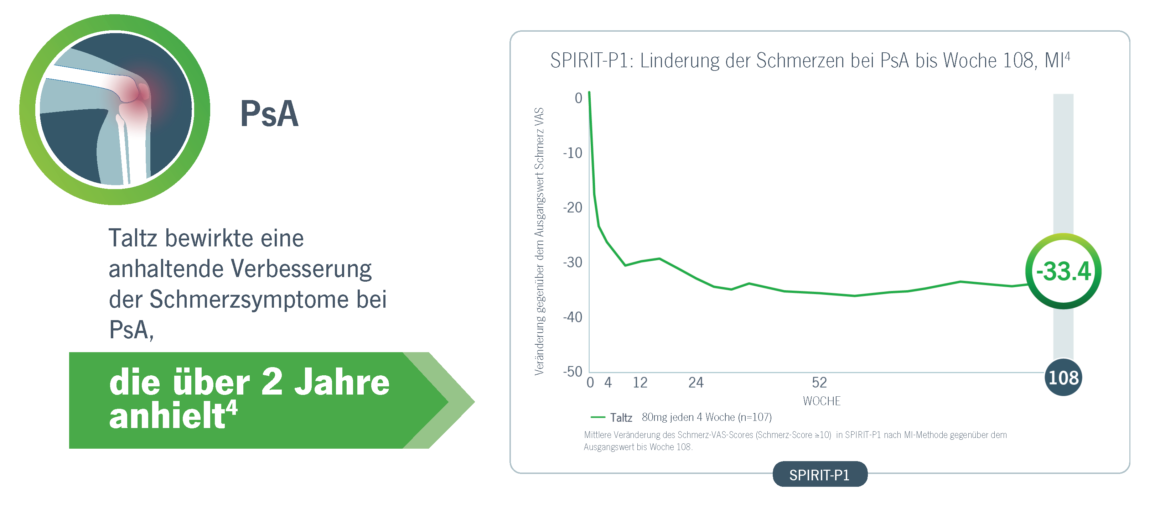
Taltz führte zu einer anhaltenden Verbesserung der Schmerzsymptome bei PsA und axSpA4

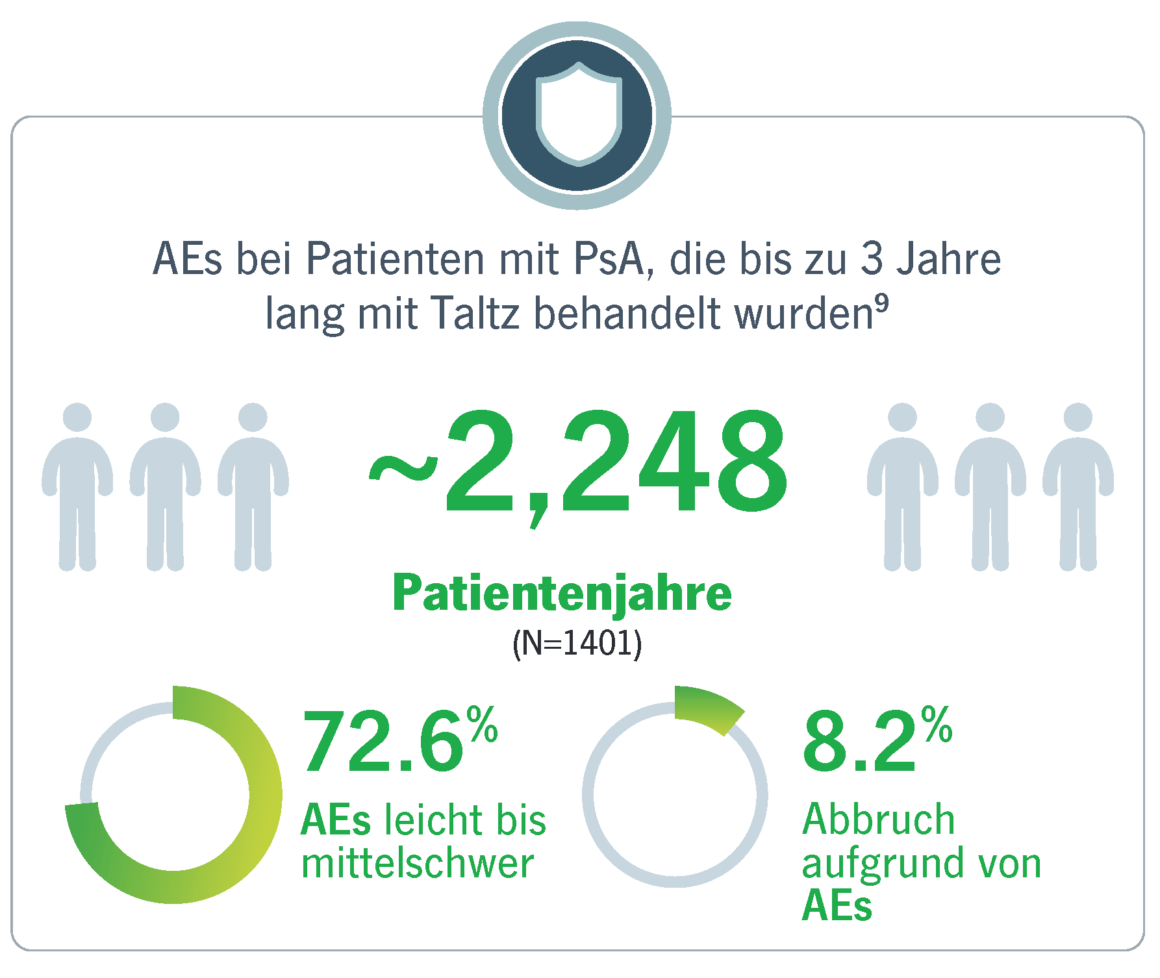
21 klinische Studien zu Taltz® bestätigen die gute Verträglichkeit des IL-17A-Inhibitors.8
Das Sicherheitsprofil von Taltz wurde in
21 klinischen Studien für alle Indikationen bei
>8,000 Patienten mit
>20,000 Patientenjahren
des Exposures festgestellt.8
Bei Patienten mit aktiver PsA, die bis zu drei Jahre lang mit Taltz behandelt wurden, waren die meisten TEAEs leicht bis mittelschwer.9 Die am häufigsten berichteten TEAEs waren Nasopharyngitis und Infektionen der oberen Atemwege.9 Das allgemeine Sicherheitsprofil und die Verträglichkeit von Taltz bei Patienten mit PsA stimmten mit dem bekannten Sicherheitsprofil von Taltz überein.9,10
- Die Schmerzen von Patienten mit PsA und axSpA führen zu einer erheblichen körperlichen und emotionalen Belastung.5
- Taltz wirkt gegen Schmerzsymptome bei PsA und axSpA und bietet schnelle und nachhaltige Linderung.1-4
- Taltz hat ein etabliertes Sicherheitsprofil.9
Indikationen10
Psoriasis Arthritis (PsA): Taltz®, allein oder in Kombination mit Methotrexat, ist angezeigt für die Behandlung erwachsener Patienten mit aktiver Psoriasis-Arthritis, die unzureichend auf eine oder mehrere krankheitsmodifizierende Antirheumatika (DMARD) angesprochen oder diese nicht vertragen haben.
Axiale Spondyloarthritis (axSpA): Ankylosierende Spondylitis (Morbus Bechterew) Taltz ist indiziert zur Behandlung der schweren aktiven ankylosierenden Spondylitis bei erwachsenen Patienten, die auf eine konventionelle Therapie (z.B. nichtsteroidale entzündungshemmende Medikamente [NSAIDs]) unzureichend angesprochen haben oder diese nicht vertragen.
Nicht-radiographische axiale Spondyloarthritis: Taltz ist indiziert zur Behandlung der schweren aktiven nicht-radiographischen axialen Spondyloarthritis bei erwachsenen Patienten, die auf NSAIDs unzureichend angesprochen haben. Patienten sollten objektive Anzeichen einer Entzündung im Magnetresonanztomographie (MRT) und durch erhöhtes C-reaktives Protein (CRP) zeigen.
Abkürzungen
ACR20, American College of Rheumatology 20% response; ADA, Adalimumab; ADR, adverse drug reaction; AE, unerwünschte Ereignisse; AS, ankylosierende Spondylitis; ASAS40, Assessment of Spondyloarthritis International Society response criteria, ≥40% improvement; (nr/r)-axSpA, (nicht-radiographisch/radiographisch) Axiale Spondyloarthritis; CRP, C-reactive protein; DMARD, disease-modifying antirheumatic drug; MCID, minimal clinically important difference; MMRM, mixed-effects model for repeated measures; MRI, Magnetresonsnztomographie; MTX, Methotrexate; NRI, non-responder imputation; NSAID, nonsteroidal anti-inflammatory drugs; PBO, placebo; PsA, Psoriasis Arthritis ; SpA, Spondyloarthritis; TEAE, treatment-emergent adverse event; VAS, visual analogue scale.
Taltz® (Ixekizumab) Injektionslösung
I: Zur Behandlung der mittelschweren bis schweren Plaque-Psoriasis bei erwachsenen Patienten und bei Kindern und Jugendlichen ab 6 Jahren mit einem Körpergewicht von mindestens 25 kg, die auf andere systemische Therapien (einschliesslich Ciclosporin oder Methotrexat oder PUVA) nicht angesprochen haben, bei denen diese Therapien kontraindiziert sind oder die diese Therapien nicht tolerieren. Alleine oder in Kombination mit konventionellen krankheitsmodifizierenden Antirheumatika (DMARD), zur Behandlung erwachsener Patienten mit aktiver Psoriasis-Arthritis, die auf eine Behandlung mit einem oder mehreren DMARDs unzureichend angesprochen haben oder diese nicht vertragen haben. Zur Behandlung der schweren aktiven ankylosierenden Spondylitis bei erwachsenen Patienten, die auf eine konventionelle Therapie (z.B. nichtsteroidale entzündungshemmende Medikamente [NSAIDs]) unzureichend angesprochen haben oder diese nicht vertragen. Zur Behandlung der schweren aktiven nicht-radiographischen axialen Spondyloarthritis bei erwachsenen Patienten, die auf NSAIDs unzureichend angesprochen haben. Patienten sollten objektive Anzeichen einer Entzündung im Magnetresonanztomographie (MRT) und durch erhöhtes C-reaktives Protein (CRP) zeigen.
D: Subkutane Injektion. Plaque-Psoriasis bei Erwachsenen: 160 mg in Woche 0, gefolgt von 80 mg in den Wochen 2, 4, 6, 8, 10 und 12, und danach 80 mg alle 4 Wochen. Bei Patienten <100 kg kann ein alternatives Dosisschema mit 160 mg in Woche 0 und ab Woche 2 80 mg alle 4 Wochen erwogen werden. Plaque-Psoriasis bei Kindern und Jugendlichen (ab 6 Jahren): Gewicht > 50 Kg: 160 mg in Woche 0, gefolgt von 80 mg alle 4 Wochen; Gewicht 25-50 Kg: 80 mg in Woche 0, gefolgt von 40 mg alle 4 Wochen. Psoriasis-Arthritis: 160 mg in Woche 0, gefolgt von 80 mg alle 4 Wochen. Ankylosierende Spondylitis: 80 mg alle 4 Wochen.
KI: Schwere Überempfindlichkeit. Schwere aktive Infektionen (z. B. aktive Tuberkulose, Sepsis, schwere opportunistische Infektionen).
W/V: Vorsicht bei Patienten mit chronischer oder aktiver Infektion oder rezidivierenden Infektionen in der Vorgeschichte. Bei schwerwiegender Überempfindlichkeitsreaktion soll Taltz umgehend abgebrochen werden und eine geeignete Therapie eingeleitet werden. Taltz wird für Patienten mit einer entzündlichen Darmerkrankung nicht empfohlen. Wenn ein Patient Anzeichen und Symptome einer entzündlichen Darmerkrankung oder eine Exazerbation einer bereits existierenden entzündlichen Darmerkrankung entwickelt, soll Taltz abgesetzt und eine angemessene medizinische Behandlung eingeleitet werden. Vorsicht bei psychiatrischen Komorbiditäten (z.B. Depression). Vorsicht bei Patienten mit axSpa und Risiko für MACE. Taltz darf nicht zusammen mit Lebendimpfstoff verwendet werden. Die gleichzeitigeVerabreichung von Taltz mit anderen Biologika wird nicht empfohlen.
IA: Die Sicherheit von Taltz in Kombination mit anderen Immunmodulatoren oder Phototherapie sowie Impfungen mit Lebendimpfstoffenwurde nicht untersucht.
Sch/S: Während der Schwangerschaft und bei gebärfähigen Frauen, die keine wirksame Empfängnisverhütung verwenden, darf Taltz nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich. Patientinnen sollen angewiesen werden für mindestens 10 Wochen nach der letzten Gabe von Taltz wirksame Verhütungsmethoden anzuwenden und nicht zu stillen. Eine Entscheidung, entweder mit dem Stillen aufzuhören oder die Einnahme von Taltz abzubrechen, sollte unter Berücksichtigung der Vorteile des Stillens für das Kind und der Vorteile der Therapie für die Mutter gefällt werden.
UAW: Sehr häufig: Infektionen der oberen Atemwege, Reaktionen an der Injektionsstelle. Häufig: Tinea Infektion, Herpes simplex (mukokutan), orale Candidiasis, Rhinitis, Influenza, Konjunktivitis, oropharyngeale Schmerzen, Übelkeit, Diarrhö, erhöhte Leberenzyme, Urtikaria. Gelegentlich: anaphylaktische Reaktionen, oesophageale Candidiasis, Neutropenie, Thrombozytopenie, Morbus Crohn, Colitis Ulzerosa.. UAW, die im Vergleich zu Erwachsenen häufiger beobachtet wurden oder spezifisch bei Kindern und Jugendlichen auftraten: Sehr häufig: Überempfindlichkeitsreaktionen. Häufig: Neutropenie, Morbus Crohn, Dermatitis, Rash, Ekzem Fieber. Gelegentlich: Bronchospasmus.
P: Taltz 80 mg 1 oder 2 Fertigpen / 1 oder 2 Fertigspritze(n). Abgabekategorie B. Weitere Informationen finden Sie unter www.swissmedicinfo.ch.
Eli Lilly (Suisse) SA, ch. des Coquelicots 16, CP 580, 1214 Vernier (GE). V08-2023
Fachpersonen können die Referenzen beim Unternehmen jederzeit anfordern.
Referenzen
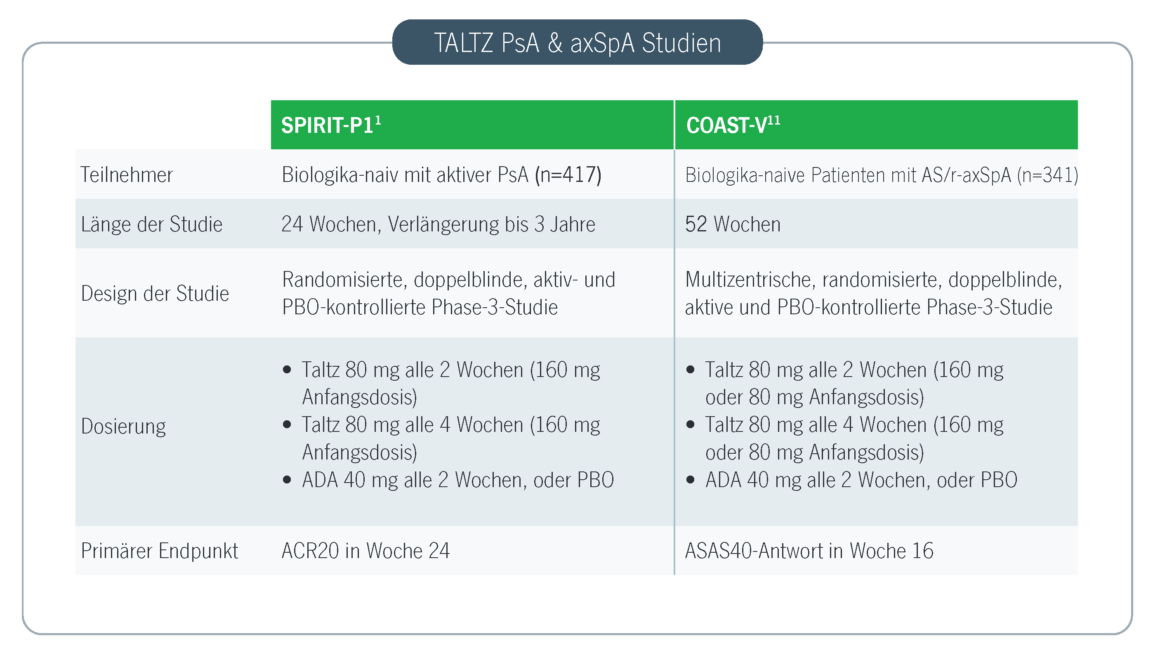
- Mease P.J. et al. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo-controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis. 2017; 76(1):79-87.
- Deodhar A.A. et al. Ixekizumab improves spinal pain, function, fatigue, stiffness, and sleep in radiographic axial Spondyloarthritis: COAST-V/W 52-week results. BMC Rheumatol. 2021; 5(1):35.
- Mease P. et al. Translating Improvements with Ixekizumab in Clinical Trial Outcomes into Clinical Practice: ASAS40, Pain, Fatigue, and Sleep in Ankylosing Spondylitis. Rheumatol Ther. 2019 Sep;6(3):435-450.
- Orbai A.M. et al. Rapid and sustained improvements in patient-reported signs and symptoms with ixekizumab in biologic-naive and TNF-inadequate responder patients with psoriatic arthritis. Clin Exp Rheumatol. 2021; 39(2):329-336.
- Mease PJ, Liu M, Rebello S, Kang H, Yi E, Park Y, Greenberg JD. Comparative Disease Burden in Patients with Rheumatoid Arthritis, Psoriatic Arthritis, or Axial Spondyloarthritis: Data from Two Corrona Registries. Rheumatol Ther. 2019; 6(4):529-542.
- Richette P. et al. Are Patients´ and Rheumatologists´ perceptions of the burden and treatment of psoriatic arthritis aligned? Results from the uplift survey. Annals of the Rheumatic Diseases 2022;81:404-405. Poster POS0309 presented at EULAR 2022, Jun 1-4, Copenhagen, Denmark.
- Tillett W. et al. Disease Characteristics and the Burden of Joint and Skin Involvement Amongst People With Psoriatic Arthritis: A Population Survey. Rheumatol Ther. 2020; 7(3):617-637.
- Genovese M.C. et al. Safety of ixekizumab in adult patients with plaque psoriasis, psoriatic arthritis and axial spondyloarthritis: data from 21 clinical trials. Rheumatology (Oxford). 2020; 59(12):3834-3844.
- Deodhar A.A. et al. Safety of ixekizumab in patients with psoriatic arthritis: data from four clinical trials with over 2000 patient-years of exposure. Ann Rheum Dis. 2022;81(7):944-950.
- Taltz® Fachinformation, www.swissmedicinfo.ch.
- van der Heijde D. et al. Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V): 16 week results of a phase 3 randomised, double-blind, active-controlled and placebo-controlled trial. Lancet. 2018;392(10163):2441-2451
Dieser Inhalt wurde von Eli Lilly and Company entwickelt, organisiert und finanziert. Nur für medizinisches Fachpersonal in der Schweiz bestimmt. Fachpersonen können die Referenzen beim Unternehmen jederzeit anfordern.

Für weitere Informationen zu unseren Lilly Produkten & Therapiegebieten kontaktieren Sie bitte unsere medizinische Information:
Servicezeiten: Montag-Freitag, 09:00-17:00 Uhr
Telefon: +41 44 654 57 52
E-Mail: ch_medinfo@lilly.com
© 2023 Eli Lilly (Suisse) SA,
Chemin des Coquelicots 16, P.O. 580, CH-1214 Vernier.
Alle Rechte vorbehalten.
PP-IX-CH-0976/08.2023


