In der fortlaufenden PSoHO-Beobachtungsstudie wird die Wirksamkeit von 11 Psoriasis-Biologika verglichen.2,a Die Daten vom EADV-Kongress 2022 zeigen: IL-17A-Inhibitoren konnten das Hautbild unter realen Versorgungsbedingungen anhaltend verbessern.3

Mehrheit der Patient:innen hält Ansprechen unter Ixekizumab (Taltz®) über 1 Jahr aufrecht3
Primärer Endpunkt der Studie war eine nahezu erscheinungsfreie Haut nach 12 Wochen, definiert als eine 90%ige Verbesserung des Psoriasis Area & Severity Index (PASI 90-Ansprechen) und/oder ein static Physician’s Global Assessment (sPGA) von 0 oder 1 auf einer 6‑Punkteskala.2
- Den primären Endpunkt erzielten 75% der Patientinnen und Patienten unter Ixekizumab. Weitere Informationen zu den 12‑Wochenergebnissen finden Sie in >> diesem Beitrag.
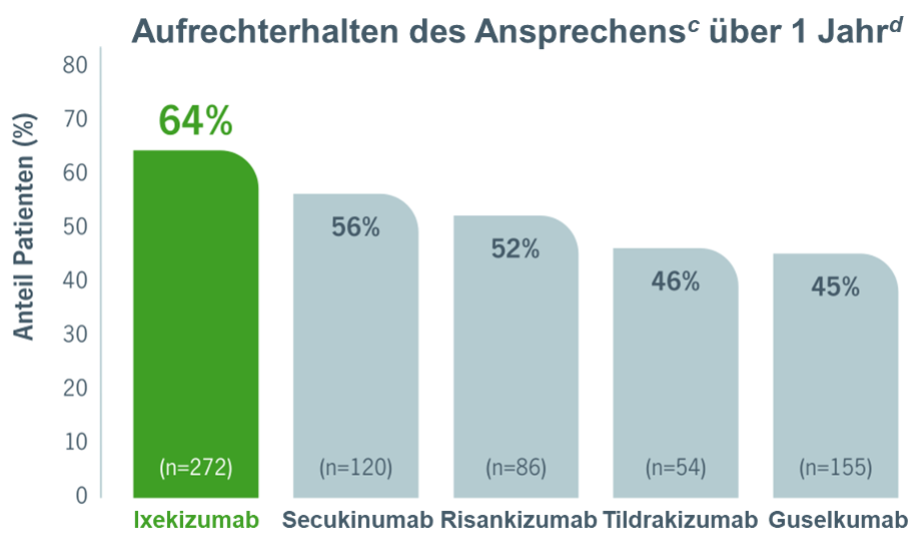
Die 1‑Jahresdaten einer Interimsanalyse zeigen (vgl. Abb. 1):3
- 64% der Ixekizumab-(Taltz®)-Behandelten, die den primären Endpunkt erreicht hatten, zeigten sowohl nach 6 Monaten als auch nach 1 Jahr eine nahezu erscheinungsfreie Haut (PASI 90 und/oder sPGA 0,1 und/oder eine ≥ 2‑Punktverbesserung im sPGA).b
- Unter Ixekizumab wurde dieser sekundäre Endpunkt häufiger erzielt als unter Secukinumab, Risankizumab, Tildrakizumab und Guselkumab.a
Zudem zeigte mehr als die Hälfte der Ixekizumab-Behandelten (54%), die in Woche 12 und nach 6 Monaten einen PASI 100 erreichten, ein vollständig erscheinungsfreies Hautbild (PASI 100) auch nach 1 Jahr Therapie.3
c Ansprechen definiert als Anteil an Patient:innen, die sowohl in Woche 12 PASI 90 und/oder sPGA 0/1 erzielten als auch an Monat 6 und Monat 12 mindestens PASI 90 und/oder sPGA 0/1 und/oder eine ≥ 2-Punkt-Verbesserung im sPGA aufwiesen.d Keine direkte Vergleichsstudie, deskriptiv, Non-Responder Imputation, Interimsanalyse von 910 Patient:innen, Evidenz limitiert u.a. durch reduzierte Probandenzahl und möglicher Auswahlverzerrung (Interimsanalyse) sowie möglicherweise nicht erfasster Störfaktoren im Real-World-Setting. Darstellung der Ergebnisse ausschliesslich für IL‑17A- und IL‑23-Inhibitoren (exkl. Adalimumab, Brodalumab und Ustekinumab).
Wie komplementieren die PSoHO‑Ergebnisse die klinischen Studien?

Randomisierte klinische Studien (RCTs) liefern aufgrund ihrer strikten Selektionskriterien und Behandlungsprotokolle zuverlässige Antworten auf die Frage, wie wirksam eine Therapie sein kann.
Den Praxisalltag können RCTs jedoch nicht vollständig abbilden, denn gemischte Populationen und Krankheitsausprägungen erfordern individuelle Therapieentscheidungen. Unter diesem Gesichtspunkt gewinnen die ‚Real World‘-Studien an Bedeutung.4
Real-World-Studien wie PSoHO liefern Hinweise darauf, wie gut sich eine Therapie unter realen Versorgungsbedingungen behaupten kann.5

In Real-World-Studien können unter Berücksichtigung der Limitationen verschiedene Wirkstoffe im Praxisalltag verglichen und auch solche Patientinnen und Patienten berücksichtigt werden, die von klinischen Studien z. B. wegen Komorbiditäten ausgeschlossen gewesen wären.6,7
Populationsbedingt fallen die beobachteten Effektstärken der Therapien in der Regel niedriger aus als in RCTs.6 Im Falle von Ixekizumab gibt es jedoch eine hohe Konsistenz zwischen Real‑World‑ und klinischen Studiendaten:
| Ixekizumab: PSoHO bestätigt klinische Studiendaten |
| Die bisherigen PSoHO-Ergebnisse2,3 bestätigene die aus RCTs8-11 bekannte Effektivität Ixekizumabs. Ähnlich viele Behandelte erreichten ein PASI 100-Ansprechen: • nach 12 Wochen: 39% in PSoHO2,e vs. 36–41% in den RCTs8-10,f,g,h • nach 1 Jahr: 54% in PSoHO3 vs. 55% in Woche 60 der klinischen Langzeitstudie11 (non-responder imputation für alle Daten) |
Weitere Beiträge zur Psoriasis:
>> Patient nach 10 Wochen erscheinungsfrei
NRI: Non-responder imputation
§ Taltz® ist zur Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, die auf andere systemische Therapien (einschliesslich Ciclosporin oder Methotrexat oder PUVA) nicht angesprochen haben, bei denen diese Therapien kontraindiziert sind oder die diese Therapien nicht tolerieren.1
a Keine direkte Vergleichsstudie, deskriptiv, NRI, Interimsanalyse von 910 Patient:innen, Evidenz limitiert u.a. durch reduzierte Probandenzahl und möglicher Auswahlverzerrung (Interimsanalyse) sowie möglicherweise nicht erfasster Störfaktoren im Real-World-Setting.
b Non-responder imputation, logistische Regression.
c Ansprechen definiert als Anteil an Patient:innen, die sowohl in Woche 12 PASI 90 und/oder sPGA 0/1 erzielten als auch an Monat 6 und Monat 12 mindestens PASI 90 und/oder sPGA 0/1 und/oder eine ≥ 2‑Punkteverbesserung im sPGA aufwiesen.
d Darstellung der Ergebnisse ausschliesslich für IL‑17A- und IL‑23-Inhibitoren (exkl. Adalimumab, Brodalumab und Ustekinumab).
e PSoHO ist eine fortlaufende 36‑monatige, prospektive, multizentrische, internationale Beobachtungsstudie zur chronischen mittelschweren bis schweren Plaque-Psoriasis bei Erwachsenen, die eine Biologikatherapie initiieren oder auf ein neues Biologikum wechseln (n=1.981). Gezeigte Daten stammen von einer Subgruppe an Patient:innen, die die von der EMA zugelassenen Dosierungen erhielten. Primärer Endpunkt war der Anteil an Patient:innen mit PASI 90 und/oder sPGA-Score von 0 oder 1 in Woche 12 zwischen Patient:innen mit anti‑IL‑17-Biologika vs. alle anderen zugelassenen Biologika (Daten nicht gezeigt). Für fehlende Daten wurde NRI genutzt.2
f IXORA‑R war eine randomisierte, doppelverblindete, multizentrische Parallelgruppen-Studie der Phase 4, in der Patient:innen mit mittelschwerer bis schwerer Plaque-Psoriasis 1:1 auf Ixekizumab (n=520) oder Guselkumab (n=507) randomisiert wurden. Primärer Endpunkt war der Prozentsatz der Patient:innen mit PASI 100 in Woche 12. Für fehlende Daten wurde NRI genutzt.10
g IXORA‑S war eine randomisierte, doppelverblindete, kontrollierte, multizentrische Phase‑3b-Studie, in der Patient:innen mit mittelschwerer bis schwerer Psoriasis 1:1 auf Ixekizumab (n=136) oder Ustekinumab (n=166) randomisiert wurden. Primärer Endpunkt war der Anteil an Patient:innen mit PASI 90 in Woche 12 (Daten nicht gezeigt). Für fehlende Daten wurde NRI genutzt.9
h UNCOVER‑2 und UNCOVER‑3 waren prospektive, doppelverblindete, multizentrische Phase‑3-Studien, in denen Patient:innen mit mittelschwerer bis schwerer Psoriasis 1:2:2:2 randomisiert wurden auf: Placebo (n=168), Etanercept (2x wöchentlich 50 mg, n=358), 80 mg Ixekizumab Q2W (n=351) bzw. 80 mg Ixekizumab Q4W (n=347) jeweils nach einer Starterdosis von 160 mg (gezeigt sind die Daten von Patient:innen mit einer Initialdosis von 160 mg gefolgt von 80 mg Q2W bis Woche 12). Co‑primäre Endpunkte waren der Anteil an Patient:innen mit PASI 75 und sPGA-Scores von 0 oder 1 mit einer ≥ 2-Punkteverbesserung vs. Baseline (Daten nicht gezeigt). Für fehlende Daten wurde NRI genutzt.8
i Metaanalyse, kein direkter Vergleich; untersucht wurde das PASI‑75/90/100- und DLQI‑(0,1)-Ansprechen für Ixekizumab und Secukinumab mittels Bucher- und zwei Signorovitch-Methoden. Eingeschlossen wurden Studien mit sowohl aktiven Kontrollarmen sowie Placebo. Beim Vergleich von Studien mit aktivem Kontrollarm war über alle Methoden hinweg Ixekizumab in Woche 12 im PASI‑90- und PASI‑100-Ansprechen signifikant stärker als Secukinumab (p < 0,05). Limitationen: Unterschiede im Studiendesign, in der Studiendurchführung und Studienpopulation oder möglicherweise nicht erfasste Störfaktoren. Die UNCOVER-Studien haben ein grundlegend anderes Studiendesign als die FIXTURE-, ERASURE- und JUNCTURE-Studien, was einen Vergleich über einen Zeitraum länger als 12 Wochen erschwert. Die IXORA‑S- und CLEAR-Studien haben kleinere Studienpopulationen, was die Aussagekraft der indirekten Vergleiche mit diesen Studien möglicherweise schmälert. Das maximale Ansprechen kann bei verschiedenen Substanzen an unterschiedlichen Zeitpunkten vorliegen.12
Referenzen
- Fachinformation Taltz®, abrufbar unter: www.swissmedicinfo.ch.
- Pinter A et al. Comparative effectiveness of biologics in clinical practice: week 12 primary outcomes from an international observational psoriasis study of health outcomes (PSoHO). J Eur Acad Dermatol Venereol. 2022;36(11):2087-2100.
- Costanzo A et al. Initial Report on the Month 12 Results From the Psoriasis Study of Health Outcomes (PSoHO) for Patients With Moderate-to-Severe Psoriasis Treated With Biologics in the Real-World Setting [Poster P1452] präsentiert beim EADV-Kongress, Milan (Italien), 08.-10. September 2022.
- Hong YD et al. Comparative effectiveness and safety of pharmaceuticals assessed in observational studies compared with randomized controlled trials. BMC Med. 2021;19(1):307.RI).
- Kim HS et al. Real-world Evidence versus Randomized Controlled Trial: Clinical Research Based on Electronic Medical Records. J Korean Med Sci. 2018;33(34):e213.
- Yiu ZZN et al. A standardization approach to compare treatment safety and effectiveness outcomes between clinical trials and real-world populations in psoriasis. Br J Dermatol. 2019;181(6):1265-1271.
- Masson Regnault M et al. Users of biologics in clinical practice: would they be eligible for phase III clinical studies? Cohort Study in the French Psoriasis Registry PSOBIOTEQ. J Eur Acad Dermatol Venereol. 2020;34(2):293-300.
- Griffiths CE et al. Comparison of ixekizumab with etanercept or placebo in moderate-to-severe psoriasis (UNCOVER-2 and UNCOVER-3): results from two phase 3 randomised trials. Lancet. 2015;386(9993):541-551.
- Reich K et al. Comparison of ixekizumab with ustekinumab in moderate-to-severe psoriasis: 24-week results from IXORA-S, a phase III study. Br J Dermatol. 2017;177(4):1014-1023.
- Blauvelt A et al. A head-to-head comparison of ixekizumab vs. guselkumab in patients with moderate-to-severe plaque psoriasis: 12-week efficacy, safety and speed of response from a randomized, double-blinded trial. Br J Dermatol. 2020;182(6):1348-1358.
- Gordon KB et al. Phase 3 Trials of Ixekizumab in Moderate-to-Severe Plaque Psoriasis. N Engl J Med. 2016;375(4):345-356.
- Warren RB et al. Matching-adjusted indirect comparison of efficacy in patients with moderate-to-severe plaque psoriasis treated with ixekizumab vs. secukinumab. Br J Dermatol. 2018;178(5):1064-1071.
Titelbild: © upixa via iStock.
Fachpersonen können die Referenzen beim Unternehmen jederzeit anfordern.
Entgeltliche Einschaltung im Auftrag von Eli Lilly (Suisse) S.A. 16, Ch. Des Coquelicots, CH-1214 Vernier – Geneva
Zur Taltz® Fachinformation bitte hier klicken.
PP-IX-CH-0916/ 05.2023