Mit der Indikationserweiterung eines bekannten Januskinase-Inhibitors steht erstmals eine zugelassene Therapie für die schwere Alopecia areata zur Verfügung. Die aktuelle Studienlage zu Verträglichkeit und Wirkung im Überblick.
Bisherige Therapieoptionen
Neben der lokalen Steroidtherapie beruhte die Behandlung von Alopecia areata bisher im Wesentlichen auf den konventionellen Systemetherapien mit Kontaktallergenen und intraläsionalen Kortikosteroid-Injektionen.2 Diese Therapieoptionen sind jedoch nicht zur Behandlung der Alopecia areata zugelassen und führen meist nicht zu einem zufriedenstellenden Ansprechen mit hohen Rezidivraten.2-4 Lange waren keine Evidenzen für die Wirksamkeit systemischer Therapien zur Behandlung der Alopecia areata in klinischen Studien verfügbar.4,5
Seit Ende Mai 2023 steht mit Olumiant® (Baricitinib) die erste und bislang einzige für die Behandlung der schweren Alopecia areata zugelassene Systemtherapie zur Verfügung.1 Dabei ist der Wirkstoff kein Unbekannter: der JAK-Inhibitor Baricitinib wird bereits seit 2017 für die Therapie der rheumatoiden Arthritisǂ und seit 2021 zur Behandlung von atopischer Dermatitis# eingesetzt.1
| Wer kann von Baricitinib profitieren |
| Baricitinib ist zur Behandlung einer schweren Alopecia areata bei Erwachsenen zugelassen.1 Die Zulassungserweiterung bietet erstmalig einen neuen Behandlungsansatz für schwere Formen dieser chronischen Erkrankung. Da der grossflächige Haarverlust bei Alopecia areata im Alltag direkt sichtbar ist, leiden viele Betroffene unter einem geringen Selbstwertgefühl. Die Erkrankung ist daher für viele Patientinnen und Patienten eine grosse psychosoziale Belastung und geht mit einem Verlust an Lebensqualität einher.3 |
So wirkt Baricitinib
Der Wirkmechanismus des JAK-Inhibitors beruht auf einer selektiven und reversiblen Hemmung der Januskinasen 1 und 2 (JAK1, JAK2).1,3 Diese intrazellulären Enzyme sind an der Signalweiterleitung von Zytokinen und Wachstumsfaktoren in den Zellkern beteiligt. So auch für die Zytokine Interferon(IFN)-γ und Interleukin(IL)-15, welche an der Pathogenese der Alopecia areata beteiligt sind.6,7 Die JAK-STAT-abhängige IFN-γ- und IL-15-Rückkopplungsschleife trägt weiter zur lokalen Entzündungsreaktion bei.6 Durch eine vorübergehende Hemmung von JAK1 und JAK2 wirkt Baricitinib entzündungshemmend und immunmodulierend.1,3
Starke und anhaltende Wirkung auf das Haarwachstumα,8,9
Das zulassungsrelevante Studienprogramm BRAVE-AA umfasste 2 randomisierte, kontrollierte Studien der Phase III. Darin wurde die Wirksamkeit und Sicherheit von Baricitinib in den täglichen Dosierungen von 4 mg und 2 mg mit Placebo bei Patientinnen und Patienten mit schwerer Alopecia areata verglichen.8 Baricitinib zeigte eine starke Wirksamkeit mit deutlicher Verbesserung des Haarwachstums:
- Unter beiden Dosierungen Baricitinibs erreichte ein signifikant höherer Anteil an Patientinnen und Patienten in Woche 36 einen SALT-Score* ≤ 20 im Vergleich zur Kontrollgruppe (p≤0,001; Abb. 1) – mit einer signifikanten Verbesserung des Haarwachstums auf der Kopfhaut (Abb. 2). Der primäre Endpunkt der Studien wurde damit erreicht.8
- Bei fast 40% der Patientinnen und Patienten unter 4 mg Baricitinib wuchsen die Kopfhaare bis Woche 52 nahezu vollständig nach (SALT-Score ≤ 20; Abb. 1).9
- 33% bzw. knapp 34% der Patientinnen und Patienten unter 4 mg Baricitinib erreichten in Woche 36 ein klinisch relevantes Nachwachsen (um ≥ 2 Punkte des ClinRO+) der Augenbrauen bzw. der Wimpern gegenüber dem Ausgangswert.9
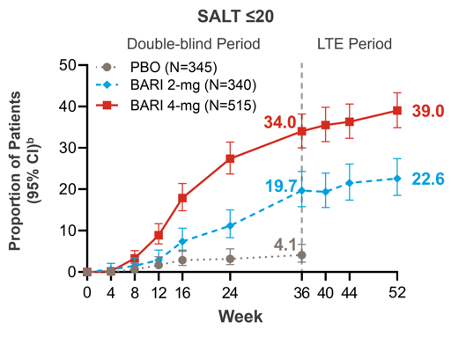
Abb. 1: Anteil der Patientinnen und Patienten, die bis Woche 52 SALT ≤ 20 erreichten (modifiziert nach Kwon O et al, 20239). Gepoolte Daten aus den Studien BRAVE-AA1 und BRAVE-AA2 (Non-Responder Imputation für fehlende Datenpunkte). Patienten, die zu Beginn auf BARI 2 mg oder BARI 4 mg randomisiert wurden, behielten die Behandlungszuweisung bis Woche 52 bei, während Patienten, die auf PBO nicht ansprachen, in Woche 36 auf BARI 2 mg oder 4 mg umgestellt wurden.
b CIs wurden nach der Wilson-Methode ohne Kontinuitätskorrektur berechnet.
BARI = Baricitinib; CI = Confidence Intervall, Konfidenzintervall; LTE = Long-term extension, Langzeit-Verlängerung; PBO = Placebo; SALT = Severity of Alopecia Tool, Ausmass der Kopfhautbeteiligung.
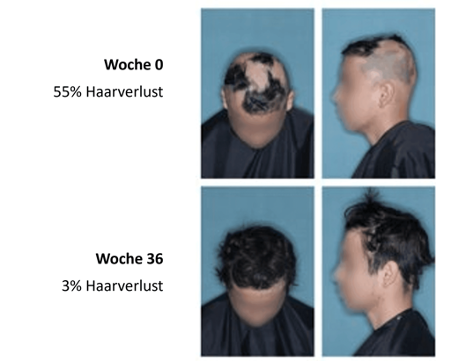
Abb. 2: Ansprechen eines 18-jährigen Patienten nach 36-wöchiger Behandlung mit 4 mg Baricitinib (modifiziert nach Kwon O et al, 20239).
| Gutes Sicherheitsprofil |
| Die Verträglichkeit Baricitinibs bei schwerer Alopecia areata konnte in den Studien des BRAVE-AA-Programms bestätigt werden.8 Die häufigsten unerwünschten Ereignisse waren: Infektionen der oberen Atemwege, Kopfschmerzen, Nasopharyngitis, Akne, Harnwegsinfektionen und erhöhte Kreatinkinase-Werte.8 Therapieabbrüche aufgrund von unerwünschten Ereignissen waren unter Baricitinib nicht häufiger als in der Placebogruppe.8 Insgesamt war die Verträglichkeit Baricitinibs bei schwerer Alopecia areata konsistent zu früheren Beobachtungen bei rheumatoider Arthritisǂ und atopischer Dermatitis#. Es gab keine neuen oder unerwarteten Sicherheitssignale.10-12 |
° Olumiant® ist indiziert für die Behandlung von schwerer Alopecia areata (≥50% der Kopfhaut betroffen) bei erwachsenen Patienten bis maximal 60 Jahre, deren Erkrankung durch topische Therapien nicht ausreichend kontrolliert werden kann (siehe «Eigenschaften/Wirkungen, Klinische Wirksamkeit»). Olumiant® sollte nicht in Kombination mit anderen systemischen Therapien für Alopecia areata angewendet werden.1
ǂ Rheumatoide Arthritis (RA): Kombinationstherapie mit konventionellen DMARDs einschliesslich Methotrexat (MTX) bei erwachsenen Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis, die auf eine Behandlung mit einem oder mehreren DMARDs unzureichend angesprochen haben oder diese nicht vertragen haben. Monotherapie bei Unverträglichkeit gegenüber MTX oder wenn eine Behandlung mit MTX nicht angebracht ist.
# Olumiant® ist indiziert für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer atopischer Dermatitis (AD), wenn eine Therapie mit topischen Medikamenten keine angemessene Krankheitskontrolle ermöglicht oder nicht empfohlen wird.
α Sowohl unter 2 mg als auch 4 mg Olumiant® erreichte ein signifikant höherer Anteil an Patientinnen und Patienten in Woche 36 einen SALT-Score* ≤ 20 im Vergleich zur Kontrollgruppe (p ≤ 0,001).8
* SALT = Severity of Alopecia Tool – normiertes Mass zur Beurteilung des Haarverlusts auf der Kopfhaut auf einer Skala von 0 bis 100.12
+ Clinician-reported Outcome
Referenzen:
- Fachinformation Olumiant®, verfügbar unter www.swissmedic.ch.
- Messenger AG et al. British Association of Dermatologists’ guidelines for the management of alopecia areata 2012. British Journal of Dermatology. 2012;166(5):916-926.
- Lintzeri DA et al. Alopecia areata – Aktuelles Verständnis und Management. J Dtsch Dermatol Ges. 2022;20(1):59-93.
- Meah N et al. The Alopecia Areata Consensus of Experts (ACE) study: Results of an international expert opinion on treatments for alopecia areata. Journal of the American Academy of Dermatology. 2020;83(1):123-130.
- Lai VWY et al. Systemic treatments for alopecia areata: A systematic review. Australas J Dermatol. 2019;60(1):e1-e13.
- Divito SJ, Kupper TS. Inhibiting Janus kinases to treat alopecia areata. Nature Medicine. 2014;20(9):989-990.
- Triyangkulsri K, Suchonwanit P. Role of janus kinase inhibitors in the treatment of alopecia areata. Drug Design, Development and Therapy. 2018;12:2323-2335.
- King B et al. Two Phase 3 Trials of Baricitinib for Alopecia Areata. New England Journal of Medicine. 2022;386(18):1687-1699 (+ Suppl. Append.).
- Kwon O et al. Efficacy and Safety of Baricitinib in Patients with Severe Alopecia Areata over 52 Weeks of Continuous Therapy in Two Phase III Trials (BRAVE-AA1 and BRAVE-AA2). Am J Clin Dermatol. 2023 Mar 1:1–9.
- Bieber T et al. Pooled safety analysis of baricitinib in adult patients with atopic dermatitis from 8 randomized clinical trials. Journal of the European Academy of Dermatology and Venereology. 2021;35(2):476-485.
- Genovese MC et al. Safety Profile of Baricitinib for the Treatment of Rheumatoid Arthritis up to 8.4 Years: An Updated Integrated Safety Analysis Annals of the Rheumatic Diseases. 2020;79(Suppl 1):642-643.
- King B, et al. Integrated Safety Analysis of Baricitinib in Adults With Severe Alopecia Areata from Two Randomised Clinical Trials [Poster 33966] präsentiert beim AAD-Kongress, New Orleans (USA). 17. – 21. März 2023.
- Olsen EA et al. Alopecia areata investigational assessment guidelines–Part II. National Alopecia Areata Foundation. Journal of the American Academy of Dermatology. 2004;51(3):440-447.
Bildquelle: © Eli Lilly and Company.
Fachpersonen können die Referenzen beim Unternehmen jederzeit anfordern.
Entgeltliche Einschaltung im Auftrag von Eli Lilly (Suisse) S.A. 16, Ch. Des Coquelicots, CH-1214 Vernier – Geneva
Zur Fachinformation bitte hier klicken.
PP-BA-CH-0769 / 05.2023