Beim Pyoderma gangraenosum handelt es sich um eine immunologisch bedingte Wunde, deren genaue Pathogenese allerdings noch nicht geklärt ist. Der Paracelsus-Score ist ein wichtiges validiertes Tool zur Diagnostik dieser äusserst schmerzhaften Ulzerationen, die bevorzugt an den Streckseiten der Unterschenkel vorkommen. Die Therapie basiert auf mehreren Pfeilern, wobei systemische Behandlung eine zentrale Bedeutung hat.
Klinisch präsentiert sich das Pyoderma gangraenosum (PG) in Form von schmerzhaften Ulzerationen mit einem häufig livid-erythematös unterminierten Randsaum. «Ganz wichtig ist, dass wir viele Differenzialdiagnosen haben, die ähnlich aussehen», so Prof. Dr. med. Joachim Dissemond, Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie, Universitätsklinikum Essen [1]. Das PG wird als seltene, primär sterile, neutrophile Dermatose klassifiziert. Die Lebensqualität der Betroffenen kann erheblich beeinträchtigt sein und man sollte nicht vergessen, dass ein PG potenziell lebensbedrohlich ist [2].
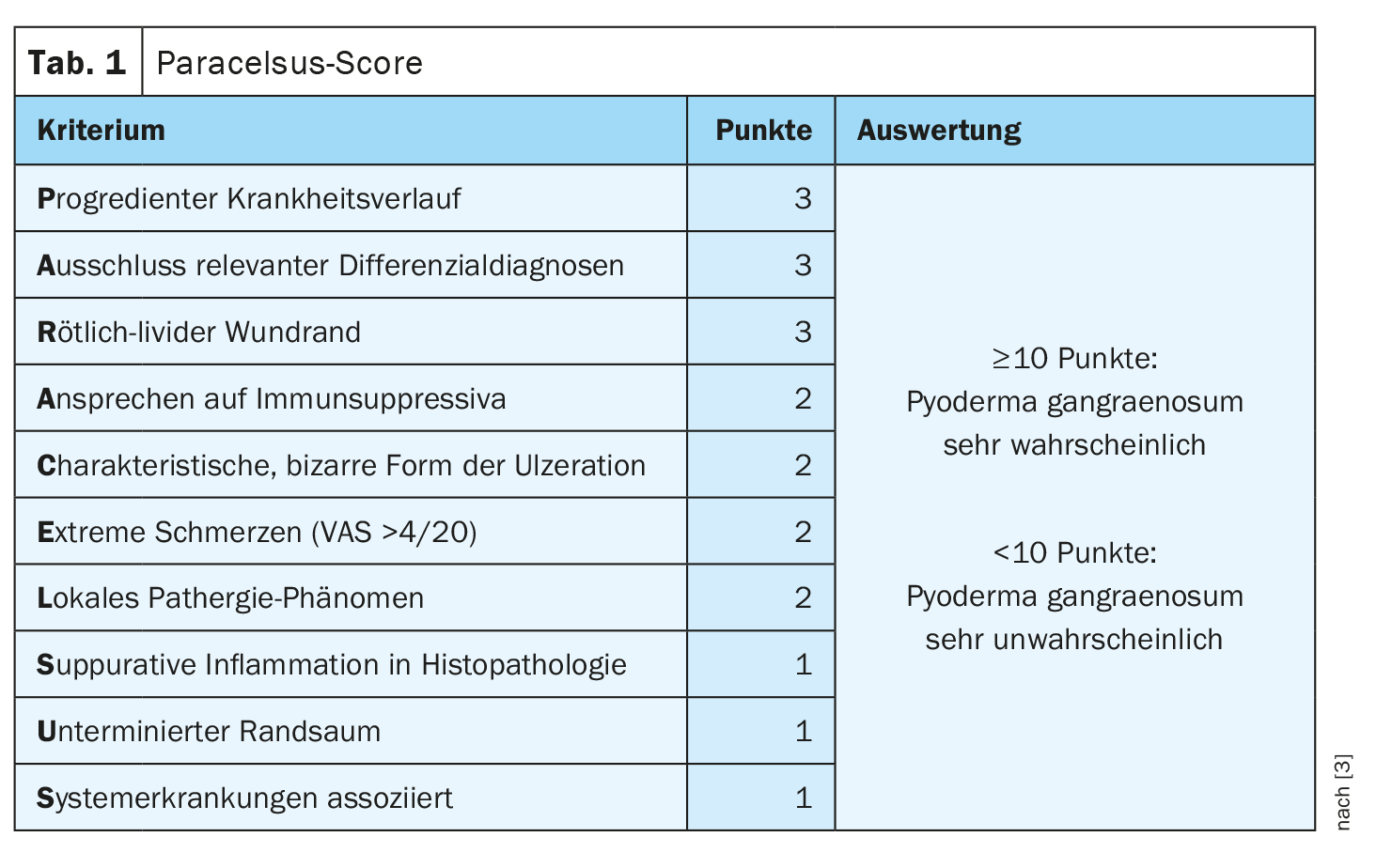
Bei Verdachtsdiagnose hilft der Paracelsus-Score weiter
Inflammation ist beim PG eine zentrale Komponente, wobei der entzündliche Aspekt häufig mit Infektion verwechselt werde, was dazu führen kann, dass fälschlicherweise Antibiotika eingesetzt werden. «Wir versuchen, Differenzialdiagnosen auszuschliessen», ergänzt Prof. Dissemond. Ein PG kann grundsätzlich überall entstehen, aber es gibt eine klare Prädilektionsstelle: in 70% der Fälle sind die Streckseiten der Unterschenkel betroffen. Bei Frauen ist die zweithäufigste Lokalisation der Brustbereich. «Häufig tritt das Pyoderma dort auf, wo ein Trauma stattgefunden hat», wobei es auch kleine Verletzungen sein können, wie der Referent erklärt. Zu den wichtigen Differenzialdiagnosen mit ähnlichem Erscheinungsbild wie PG, aber anderer Therapie, zählen Vaskulitis, Livedovaskulopathie, Calciphylaxie, Ulcus hypertonicum Martorell und artifizielle Wunden.
Der Paracelsus-Score gilt aktuell als der beste validierte Diagnostik-Score [3]. Für ein Hauptkriterium werden drei Punkte, für ein Nebenkriterium zwei Punkte und für ein Zusatzkriterium jeweils ein Punkt vergeben. Ein additiver Punktwert von ≥10 macht das Vorliegen eines PG sehr wahrscheinlich (Tab. 1). Ein progredienter Krankheitsverlauf und Ausschluss relevanter Diagnosen sind die beiden erstgenannten Hauptkriterien. Der rötlich-livide Randsaum ist ein sehr wichtiges, aber unspezifisches Merkmal für Inflammation. «Da es sich um ein Autoinflammatorisches Krankheitsbild handelt, sollte es auf Immunsuppression ansprechen», erläutert der Prof. Dissemond. Morphologisch fällt eine charakteristisch bizarre Form der Ulzeration auf. Ebenfalls ein Paracelsus-Kriterium ist die extreme Schmerzhaftigkeit. «Ein Pyoderma gangraenosum tut weh», betont der Referent. Bezüglich des lokalen Pathergie-Phänomens – eine krankheitsspezifische Hautreaktion auf einen unspezifischen Reiz – ist anzumerken, dass es auch negativ ausfallen kann. Zur Durchführung des Pathergie-Tests wird 1 ml 0,9% NaCl injiziiert. Bildet sich innert 48 Stunden eine Pustel, Rötung oder neutrophilenreiche Entzündung kann dies als positives Pathergie-Phänomen gewertet werden [2]. Auch eine histopathologische Untersuchung sollte nicht fehlen. Biopsien werden meistens im Randbereich der Ulzeration gemacht, wobei sich eine kleine schmale Spindelbiopsie am besten eigne, so der Referent. Suppurative Inflammation in der Histopathologie spricht für ein PG. Man sollte aber wissen, dass der Befund auch unklar bleiben könne. Ein unterminierter livider Randsaum ist ein wichtiges differenzialdiagnostisches Merkmal zur Livedovaskulopathie und ein weiteres Paracelsus-Kriterium [4]. Ausserdem ist bekannt, dass eine Assoziation mit anderen systemischen Erkrankungen beim PG häufig ist.
Pyoderma gangraenosum ist häufig mit Komorbiditäten vergesellschaftet
Bei 9–36% der Patienten liegt eine chronisch-entzündliche Darmerkrankung (Colitis ulcerosa, Morbus Crohn) vor und 8–33% der Betroffenen haben eine rheumatoide Arthritis. Diese Komorbiditäten seien kein Zufall, weiss Prof. Dissemond. «Wir reden hier über eine systemische inflammatorische Erkrankung, die viele Ähnlichkeiten mit anderen autoiinfammatorischen Symptomen hat». Was oft vergessen werde, sei, dass es sich um eine potenziell paraneoplastische Krankheit handle. 4–21% der Patienten haben eine begleitende ämatologische Neoplasie (myelodysplastisches Syndrom, Nierenzell-Karzinom). Es lohne sich daher, ein Differenzialblutbild zu machen. Neben diesen seit vielen Jahren bekannten Assoziationen, besteht darüber hinaus offenbar auch ein gehäuftes Auftreten verschiedener Erkrankungen aus dem Formenkreis des metabolischen Syndroms (z.B. arterieller Hypertonus, Diabetes mellitus, Lipidstoffwechselstörung) [2]. Darüber hinaus gibt es Manifestationen eines PG im Rahmen autoinflammatorischer Erkrankungen (z.B. PAPA-Syndrom, PASH-Syndrom, PA-PASH-Syndrom).

Systemtherapie ist das A & O
Aufgrund der Seltenheit der Erkrankung und durch mangelnde Evidenz in Form von randomisierten klinischen Studien (RCTs) existiert kein einheitlicher Therapiestandard beim Pyoderma gangraenosum, die Leitlinie gibt aber basierend auf Fallberichten und klinischer Expertise Empfehlungen ab (Abb. 1) [2]. Eine immunsuppressive Systemtherapie ist bei den meisten Patienten mit PG indiziert, insbesondere bei starker Krankheitsaktivität und multiplen Läsionen bzw. nach Versagen einer topischen Therapie [2]. Bei den systemischen Therapeutika werden Glukokortikoide (Prednison, 0,5–1 mg/kg KG) am häufigsten eingesetzt, gefolgt von Ciclosporin (2–5 mg/kgKG), als Monotherapie oder in Kombination [5]. Zu den nachrangigen, ebenfalls häufig eingesetzten Systemtherapien zählen TNFα-Inhibitoren, Azathioprin (100–150 mg/d) oder Mycophenolatmofetil [5]. Ergänzend dazu, resp. bei initialem und leichtem Krankheitsverlauf, kommen topische und lokal intraläsionale Therapieoptionen zur Anwendung. In der Akutphase kann man ein topisches Kortikosteroid der Stärkeklasse III oder IV oder einen topischen Calcineurin-Inhibitoren einsetzen. Systemtherapie ist aber eindeutig der wichtigste Behandlungspfeiler. Die Leitlinie rät allerdings von einer längerfristigen Monotherapie mit systemischen Glukokortikoiden ab wegen der unerwünschten Nebenwirkungen [2]. Daher oder bei unzureichender Wirksamkeit einer Monotherapie mit Glukokortikoiden ist eine frühzeitige Kombination mit steroidsparenden Immunsuppressiva wie Ciclosporin oder Azathioprin oder auch TNF-α-Inhibitoren oder aber eine Monotherapie mit TNF-α-Inhibitoren empfehlenswert. Die monoklonalen Antikörper Infliximab, Adalimumab, Golimumab und Certolizumab pegol oder Etanercept sind die Therapie der Wahl, wenn das PG als Begleiterkrankung einer rheumatoiden Arthritis oder einer chronisch-entzündlichen Darmerkrankung auftritt. Andernfalls handelt es sich bei diesen TNF-α-Antagonisten um off-label use. Als immunmodulatorische Therapieoption werden in der Leitlinie auch intravenöse Immunglobuline (0,5–2 g/kg KG) empfohlen, wobei es sich hierbei um eine relativ kostenintensive Therapie handelt [1,2]. Darüber hinaus werden in der Leitlinie einige weitere zu prüfende Systemtherapeutika genannt (Abb. 1).
Kongress: Wundkongress Nürnberg
Literatur:
- «Update Pyoderma gangraenosum», Prof. Dr. Joachim Dissemond, Wundkongress Nürnberg, 01.12.2022.
- S1-Leitlinie «Pyoderma gangrenosum», AWMF-Register-Nr.: 013–091, 2020, https://register.awmf.org/assets/guidelines/013-091l_S1_Pyoderma-gangre
nosum_2020-10_1.pdf, (letzter Abruf 13.12.2022). - Jockenhöfer F, et al.: The PARACELSUS score: a novel diagnostic tool for pyoderma gangrenosum. Br J Dermatol 2019; 180: 615–620.
- Schiffmann ML, et al. S1-Leitlinie Diagnostik und Therapie der Livedovaskulopathie. J Dtsch Dermatol Ges 2021; 19(11): 1667–1678.
- Al Ghazal P, Dissemond J: Therapy of pyoderma gangrenosum in Germany: results of a survey among wound experts. J Dtsch Dermatol Ges. 2015; 13: 317–324.
HAUSARZT PRAXIS 2023; 18(1): 30–31 (veröffentlicht am 26.1.23, ahead of print)